
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Теория химического строения Бутлерова
Со второй половины XIX в. в истории химии начинается период крупнейших теоретических обобщений.
Этому в немалой степени способствовало широкое использование в промышленности органических веществ, характеризуемых многообразием их свойств, при крайне однообразном элементном составе (углерод, водород, кислород, сера, фосфор).
Создание в 1860 г. выдающимся русским химиком А.М. Бутлеровым (1828–1886) теории химического строения вещества ознаменовало возникновение более высокого уровня познания вещества – структурной химии. Период становления структурной химии иногда называют "триумфальным маршем органического синтеза". В этот период зарождалась технология органических веществ. Были получены всевозможные красители для тканей, фармацевтические препараты, искусственные материалы и т.п.
Основными положениями теории химического строения являются следующие утверждения:
· атомы в молекулах соединены в определенном порядке, согласно их валентности;
· физические и химические свойства вещества определяются не только его качественным и количественным составом, но и химическим строением;
· атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
До Бутлерова считалось невозможным познать строение молекулы, т.е. порядок химических связей между атомами. Так, совершенно непонятным казалось явление изомерии, открытое в 1823 г. немецкими химиками Ф. Велером (1800–1882) и Ю. Либихом (1803–1873) и заключающееся в существовании химических соединений – изомеров, имеющих один и тот же качественный и количественный состав, одинаковую молекулярную массу, но отличающихся друг от друга строением, а следовательно, и свойствами. Изомерами, например, являются этиловый спирт и диметиловый эфир, структурные формулы которых имеют вид:

Эти два вещества, несмотря на одинаковый качественный и количественный состав C2 H6 O и одинаковую молекулярную массу, имеют совершенно различные свойства: этиловый спирт – жидкость, кипящая при +78,4°C , смешивающаяся с водой в любых соотношениях, а диметиловый эфир – газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химическим свойствам.
Явление было объяснено в 1861 г. Бутлеровым на основе созданной им теории химического строения. Более того, Бутлеров предсказал существование двух изомеров бутана – веществ, имеющих одинаковый состав, но отличающихся порядком соединения атомов в молекулах. В 1867 г. Бутлеров синтезировал предсказанный изомер, это был изобутан, который от нормального бутана отличается строением молекулы, хотя оба имеют одинаковую эмпирическую формулу C4 H10 :
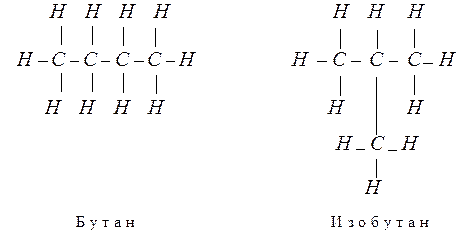
Синтез изобутана был первым большим успехом теории химического строения.
Теория химического строения Бутлерова, развитая и дополненная представлениями об электронном строении атома, является важнейшей частью теоретического фундамента химии органических соединений.
Согласно современным представлениям структура молекул – это пространственная и энергетическая упорядоченность квантовомеханической системы, состоящей из атомных ядер и электронов.
Теория Бутлерова способствовала развитию органического синтеза. Так, в 1860-е годы были синтезированы на основе простейших углеводородов из каменноугольной смолы и аммиака анилиновые красители: фуксин, анилиновая соль, ализарин. Кроме того, были получены новые вещества: индиго, флавоны, ксантоны; взрывчатые вещества: тринитротолуол, тринитрофенол, уротропин; лекарственные препараты: аспирин, феноцетин, антифебрин, салол, антипирин и т.п.
Относительно недавно открыт новый класс металлоорганических соединений с двухслойной структурой, названной структурой сэндвичевых соединений. К такому классу относится ферроцен. Хотя подобного рода соединения пока не нашли практического применения, они представляют теоретический интерес при анализе природы валентности и химической связи.
Структурная химия охватывает и неорганические материалы. В структурной неорганической химии можно выделить два перспективных направления:
· синтез кристаллов с максимальным приближением к идеальной решетке для получения материалов с высокими техническими показателями (максимальной прочностью, термической стойкостью, долговечностью в эксплуатации);
· создание кристаллов с заранее запрограммированными дефектами для производства материалов с заданными электрическими, магнитными, оптическими и другими свойствами.
Выращивание кристаллов требует специальных условий, при которых необходимо исключить воздействие внешних факторов, даже таких, как поле гравитации, поэтому некоторые эксперименты по выращиванию кристаллов проводятся в космосе на орбитальных станциях.
Химическая связь
Лишь немногие химические элементы (благородные газы) при обычных условиях находятся в состоянии одноатомного газа. Атомы остальных элементов могут взаимодействовать друг с другом и с атомами других элементов. образуя при этом более или менее сложные частицы (молекулы, молекулярные ионы и свободные радикалы), что указывает на наличие причины, по которой атомы связываются друг с другом. Эта причина получила название химической связи.
Химическая связь – это результат взаимодействия электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании устойчивой химической системы – молекулы.
Доказано, что в образовании химической связи между атомами главную роль играют валентные электроны, расположенные на внешней оболочке атома и, следовательно, связанные с ядром наименее прочно. Именно поэтому строение валентной электронной конфигурации атомов является определяющим фактором при рассмотрении условий образования химической связи.
Согласно теории химической связи, наибольшей устойчивостью обладают внешние оболочки из двух или восьми электронов (характерные для благородных газов). Это и служит причиной того, что благородные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы же, имеющие на внешней оболочке менее восьми электронов (или иногда менее двух), стремятся приобрести структуру благородных газов. Такая закономерность позволила сформулировать положение, которое является основным принципом образования молекулы: при образовании молекулы, атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводит к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи.
Химическая связь, обусловленная взаимодействием двух электронов по одному от каждого атома с образованием общей электронной пары, называется ковалентной связью. Для ее представления используют электронные формулы, в которых ковалентная связь изображается с помощью точек, обозначающих внешние электроны атома, например:

При соединении двух атомов водорода в молекулу каждый атом приобретает устойчивую двухэлектронную оболочку, подобную завершенной электронной оболочке атома благородного – гелия. Такие же оболочки имеют атомы водорода в молекулах воды. При соединении двух атомов хлора или двух атомов азота наружная оболочка каждого атома дополняется до устойчивой восьмиэлектронной конфигурации атома неона.
Важное свойство ковалентной связи – ее направленность. Так электронные орбитали имеют разную форму и ориентацию в пространстве, их взаимное перекрывание может осуществляться различными способами (рис. 4.7).
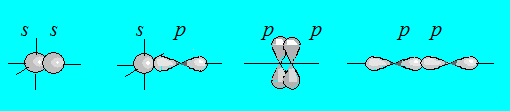
Рис. 4.7. Схема образования химической связи.
Другим типом химической связи является ионная связь. В отличие от молекул, молекулярные ионы представляют собой многоатомные частицы, несущие электрический заряд, и сами по себе не образуют какое-либо вещество, т.к. между ними существует электростатическое отталкивание, которое может быть скомпенсировано лишь одновременным присутствием эквивалентного числа противоположно заряженных ионов.
Химическая связь, осуществляемая в результате взаимного электростатического притяжения противоположно заряженных ионов, называется ионной связью. Впервые предположения об ионной связи были высказаны в 1916 г. немецким ученым Косселем, который полагал, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны. При этом первый атом превращается в положительно заряженный ион, а второй – в отрицательно заряженный ион. Взаимное электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения.
Дальнейшее развитие этих идей привело к созданию современных представлений об ионной связи. Ионные соединения образуют атомы элементов, резко отличных по электроотрицательности. Образование ионной связи можно проследить на примере хлорида натрия NaCl:
Na – e- = Na+
Cl + e- = Cl-
Na+ + Cl- = NaCl
В обычных условиях ионные соединения представляют собой кристаллические вещества с высокой температурой плавления и кипения. Например, температура плавления NaCl составляет +800°C.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...