
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Определение молекулярной массы эквивалента металла.
Значение темы:знание методики расчета, связанной с законом эквивалентов, определением эквивалента, используется при расчетах концентрации растворов, массы и объема веществ, образующихся при реакциях обмена.
Цель:научиться вычислять молярную массу эквивалента вещества и определять ее опытным путем.
Определение молярной массы эквивалента металла методом вытеснения водорода проводится в газометрической установке, изображенной на рисунке 1.
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла
 Рис. 1. Газометрическая измерительная установка.
Рис. 1. Газометрическая измерительная установка.
Методика определения:
В колбу (1) через воронку налейте 10 мл кислоты. Закрепите колбу в горизонтальном положении. На сухое горлышко колбы положите навеску металла (магния или цинка), предварительно записав ее массу – m(Ме) в рабочий журнал. Плотно закройте колбу пробкой, соединенной трубкой (4) с бюреткой (2). Бюретка опущена в цилиндр (3) с водой.
1. Проверяем прибор на герметичность (по постоянству уровня воды в приподнятой на 10-15 см бюретке). Устанавливаем воду в бюретке и цилиндре на одинаковом уровне, записываем в журнале положение уровня до начала опыта (V1).
2. Поворачиваем колбу (1) так, чтобы навеска металла попала в кислоту. Выделяющийся водород вытесняет воду из бюретки (2) в цилиндр (3).
3. После окончания реакции дайте прибору охладиться и приведите воду в бюретке (2) и цилиндре (3) к одинаковому уровню. Записываем положение уровня воды в бюретке (2) после реакции (V2).
4. Записываем уравнение происходящего процесса.
5. Вычисляем теоретическое значение молярной массы эквивалента:
МЭ (Ме)теор. =  где z – валентность метала.
где z – валентность метала.
По полученным данным определяем:
1. Объем вытесненного водорода:  , см3
, см3
2. Приводим объем газа (см3) к нормальным условиям (н.у.), пользуясь объединенным газовым законом:  ,
,
где Р – атмосферное давление по барометру, кПа; Р1 – давление водяных паров, кПа (табл. 1); Т0 – абсолютная температура, равная 273 К; Р0 – давление при н.у., равное 101,3 кПа; Т – комнатная температура, К
Таблица 1
Парциальное давление водяного пара в зависимости
от температуры воздуха
| Температура, 0С | Давление водяного пара, кПа | Температура, 0С | Давление водяного пара, кПа | Температура, 0С | Давление водяного пара, кПа |
| 1,317 | 1,929 | 2,793 | |||
| 1,397 | 2,064 | 2,966 | |||
| 1,490 | 2,195 | 3,153 | |||
| 1,583 | 2,328 | 3,352 | |||
| 1,702 | 2,474 | 3,551 | |||
| 1,809 | 2,633 | 3,764 |
3. Рассчитываем практическое значение молярной массы эквивалента металла, используя закон эквивалентов:
а) по эквивалентному объему:  , где
, где  = 11,2 дм3 = 11200 см3.
= 11,2 дм3 = 11200 см3.
б) по массе водорода:  , где
, где  , г
, г
в) по среднему значению Мэ(Ме), найденного опытным путем:
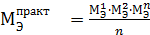 , г/моль
, г/моль
4. Вычисляем погрешность определения:
а) абсолютную ошибку эксперимента:  , г/моль
, г/моль
б) относительную ошибку эксперимента: 
ЛАБОРАТОРНАЯ РАБОТА № 3
Приготовление раствора заданной концентрации.
Значение темы: в практической деятельности провизор использует и готовит растворы различной концентрации, а также производит пересчет одного способа выражения концентрации в другой.
Цель:ознакомиться со способами количественного выражения состава растворов, методиками расчета, приготовления и определения их состава, научиться правильно обращаться с мерной посудой, рефрактометром, ареометром.
Опыт 1.
Приготовьте 250 мл 9,4% раствора хлорида натрия из 7,5% и 22,5% растворов той же соли. По таблице найдите значения относительных плотностей всех трех растворов и рассчитайте их объемы, необходимые для приготовления заданного раствора по правилу «креста».
Отмерив рассчитанные объемы растворов, слейте их и, тщательно перемешав, определите массовую долю полученного раствора рефрактометрическим методом.
Рефрактометр (ознакомьтесь с инструкцией к прибору) используется для измерения показателя преломления луча, проходящего через раствор. Прибор состоит из серии призм, главной из которых является рефрактометрическая (измерительная). Она находится в футляре. Сверху – горизонтально расположенная измерительная плоскость, на которую наносят 3-4 капли исследуемого раствора. Закрывают измерительную призму подвижной призмой, функция которой – пропускать пучок лучей через окошко. Поток лучей попадает на раствор, преломляется, проходит через серию призм и фокусируется на объективе.
Смотрим через окуляр, в поле зрения видим шкалу и две пересекающиеся линии (Рис.2.).
 Рис. 2. Рефрактометрическое определение концентрации раствора.
Рис. 2. Рефрактометрическое определение концентрации раствора.
Для растворов граничная линия (между тенью и светом) смещается. Левым винтом – тумблером выводим границу света – тени на точку пересечения и измеряем по шкале показатель преломления D. Затем по кривой на графике «D-ɷ» определяем концентрацию раствора (ɷ).
D – показатель преломления для дистиллированной воды, равен 1,333.

Опыт 2.
Приготовьте 250 мл раствора заданной концентрации из исходного раствора (вещества) и воды. Определите концентрацию полученного раствора с помощью ареометра. Ареометр – прибор для определения плотности раствора. А между плотностью раствора и концентрацией растворенного вещества существует непосредственная связь.
В цилиндр наливаем приготовленный раствор, осторожно опускаем в него ареометр (рис. 3).
| Рис. 3. Измерение плотности раствора ареометром |
1. Находят разность величин относительных плотностей и концентраций растворов по табличным данным 1,090 – 14%
1,076 – 12%
0,014 – 2%
2. Находят разность между величиной, определенной ареометром, и меньшей табличной 1,083 – 1,076 = 0,007
3. Составляют пропорцию: 0,014 – 2%
0,007 - Х% 
4. Найденное число прибавляют к меньшей величине концентрации, взятой из таблицы: 12% + 1% = 13% - это отвечает концентрации исследуемого раствора.
Проведите расчеты с данными, полученными при испытании вашего раствора.
Таблица 2
Зависимость массовой доли ɷ растворенных веществ от плотности ρ раствора (Т=293 К)
| ɷ, % | ρ, г/см3 | ||||
| H2SO4 | HNO3 | HCl | KOH | NaOH | |
| 1,013 | 1,011 | 1,009 | 1,016 | 1,013 | |
| 1,027 | 1,022 | 1,019 | 1,033 | 1,046 | |
| 1,040 | 1,033 | 1,029 | 1,043 | 1,069 | |
| 1,055 | 1,044 | 1,039 | 1,065 | 1,092 | |
| 1,069 | 1,056 | 1,049 | 1,082 | 1,115 | |
| 1,083 | 1,068 | 1,059 | 1,100 | 1,137 | |
| 1,098 | 1,080 | 1,069 | 1,118 | 1,159 | |
| 1,112 | 1,093 | 1,079 | 1,137 | 1,181 | |
| 1,127 | 1,106 | 1,083 | 1,156 | 1,213 | |
| 1,143 | 1,119 | 1,100 | 1,176 | 1,225 | |
| 1,158 | 1,132 | 1,110 | 1,196 | 1,247 | |
| 1,174 | 1,145 | 1,121 | 1,217 | 1,268 | |
| 1,190 | 1,158 | 1,132 | 1,240 | 1,289 | |
| 1,205 | 1,171 | 1,142 | 1,263 | 1,310 | |
| 1,224 | 1,184 | 1,152 | 1,286 | 1,332 | |
| 1,238 | 1,198 | 1,163 | 1,310 | 1,352 | |
| 1,255 | 1,211 | 1,173 | 1,334 | 1,374 | |
| 1,273 | 1,225 | 1,183 | 1,358 | 1,395 | |
| 1,290 | 1,238 | 1,194 | 1,384 | 1,416 | |
| 1,307 | 1,251 | 1,411 | 1,437 | ||
| 1,324 | 1,264 | 1,437 | 1,458 | ||
| 1,342 | 1,277 | 1,460 | 1,478 | ||
| 1,361 | 1,290 | 1,485 | 1,499 | ||
| 1,380 | 1,303 | 1,511 | 1,519 | ||
| 1,399 | 1,316 | 1,538 | 1,540 | ||
| 1,419 | 1,328 | 1,564 | 1,560 | ||
| 1,439 | 1,340 | 1,590 | 1,580 | ||
| 1,460 | 1,351 | 1,616 | 1,601 | ||
| 1,482 | 1,362 | 1,643 | |||
| 1,503 | 1,373 | 1,662 |
ЛАБОРАТОРНАЯ РАБОТА № 4
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...