
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Опыт 4. Химическое равновесие и его смещение. Влияние изменения концентрации реагирующих веществ на смещение химического равновесия.
а) В пробирку налить 8 капель 0,5Н раствора 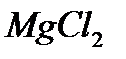 и прибавить по каплям 2Н раствор гидроксида аммония
и прибавить по каплям 2Н раствор гидроксида аммония  до появления осадка. Записать уравнение равновесного процесса и выразить константу равновесия. К образовавшемуся осадку, до его растворения, добавить по каплям 2Н раствор хлорида аммония
до появления осадка. Записать уравнение равновесного процесса и выразить константу равновесия. К образовавшемуся осадку, до его растворения, добавить по каплям 2Н раствор хлорида аммония  . Исходя из принципа Ле-Шателье, объяснить наблюдавшиеся явления.
. Исходя из принципа Ле-Шателье, объяснить наблюдавшиеся явления.
б) В четыре пробирки внесите по 5 капель разбавленных растворов  и
и  . Легким встряхиванием пробирок размешайте растворы и поставьте пробирки в штатив. В растворе имеет место обратимая реакция:
. Легким встряхиванием пробирок размешайте растворы и поставьте пробирки в штатив. В растворе имеет место обратимая реакция:

Раствор  имеет красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации
имеет красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации  , то есть о смещении равновесия в ту или другую стлрону.
, то есть о смещении равновесия в ту или другую стлрону.
В одну из пробирок добавьте 2-3 капли концентрированного раствора  , в третью – несколько кристаллов
, в третью – несколько кристаллов  . Четвертую пробирку с раствором сохраните для сравнения. Растворы во всех пробирках размешайте энергичным встряхиванием и отметьте изменение интенсивности окраски в каждом случае, сравнив с раствором в контрольной пробирке. Результаты внесите в таблицу 7.
. Четвертую пробирку с раствором сохраните для сравнения. Растворы во всех пробирках размешайте энергичным встряхиванием и отметьте изменение интенсивности окраски в каждом случае, сравнив с раствором в контрольной пробирке. Результаты внесите в таблицу 7.
Таблица 7
Результаты опыта
| № пробирки | Что добавлено | Изменение интенсивности окраски | Направление смещения равновесия |
Напишите выражение константы равновесия данного обратимого процесса. Сделайте вывод: в каком направлении смещается равновесие при увеличении концентрации исходных веществ, продуктов реакции? Согласуются ли полученные результаты с принципом Ле-Шателье?
Опыт 5. Влияние температуры на химическое равновесие.
В пробирку налить 1 каплю концентрированного раствора  , 30 капель воды и 1 каплю индикатора – фенолфталеина. Обратить внимание на изменение окраски раствора при его нагревании на спиртовке и последующем охлаждении под струей водопроводной воды.
, 30 капель воды и 1 каплю индикатора – фенолфталеина. Обратить внимание на изменение окраски раствора при его нагревании на спиртовке и последующем охлаждении под струей водопроводной воды.
Дать объяснение наблюдаемым явлениям, исходя из принципа Ле-Шателье, уесть, что гидроксид аммония  - слабое основание, которое в водном растворе диссоциирует:
- слабое основание, которое в водном растворе диссоциирует: 
Количество гидроксид-ионов (  ) в растворе зависит от температуры. С повышением температуры равновесие смещается в сторону обратной реакции, образования
) в растворе зависит от температуры. С повышением температуры равновесие смещается в сторону обратной реакции, образования  и уменьшения концентрации гидроксид-ионов (
и уменьшения концентрации гидроксид-ионов ( 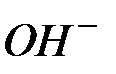 ).
).
ЛАБОРАТОРНАЯ РАБОТА № 6
Гетерогенные равновесия и процессы. Произведение растворимости (ПР), условия образования и растворения осадков.
Значение темы:это логическое продолжение изучения свойств растворов электролитов. Знание условий образования и растворения осадков необходимо при дальнейшем изучении курсов аналитической и фармацевтической химии, при анализе фармацевтических препаратов, условиях их хранения, при изучении курса технологии лекарственных препаратов.
Цель:изучить условия образования и растворения осадков, научиться определять направление смещения ионного равновесия в растворах слабых электролитов.
Опыт 1. Примеры необратимых реакций
а) Получение осадков. Используя растворы карбоната натрия и хлорида кальция получить осадок карбоната кальция. Используя растворы гидроксида натрия и сульфата меди получить осадок гидроксида меди (II). Отметить цвета образующихся осадков. Написать молекулярные и ионно-молекулярные уравнения реакций. В каком направлении протекает реакция? Сохраните осадки для опыта б).
Пользуясь значениями ПР карбоната кальция, сделайте вывод в каком случае образуется осадок карбоната кальция?
б) Образование легколетучих соединений. К осадку карбоната кальция, полученного в опыте а), прилить раствор соляной кислоты. Что происходит? Написать уравнение реакции в молекулярной и ионно-молекулярной форме. В каком направлении идет реакция?
в) Образование комплексных соединений. Внесите в пробирку 4-5 капель раствора AlCl3 , добавить по каплям раствор гидроксида натрия (до начала выпадения осадка). Написать уравнение реакции получения гидроксида алюминия в молекулярной и ионно-молекулярной форме. Добавить в пробирку с осадком еще раствора гидроксида натрия. Что происходит с осадком? Как объяснить растворение осадка гидроксида алюминия в щелочи? Записать соответствующие уравнения реакций.
г) Образования малодиссоциирующего вещества. В пробирку налить несколько капель ацетата калия и добавить такое же количество соляной кислоты. По запаху определить образовавшееся вещество. Написать уравнение реакции в молекулярной и ионно-молекулярной форме. В каком направлении идет реакция?
Сделайте вывод о необратимости реакций в растворах электролитов.
Опыт 2. Условия образования осадков малорастворимых электролитов
В две пробирки внесите по 3-5 капель насыщенного раствора хлорида кальция. В первую пробирку добавьте 3-5 капель 0,5М раствора гидроксида натрия, в другую – 10,25М раствора аммиака.
В каком случае образуется осадок малорастворимого электролита? Запишите уравнения реакций в молекулярной и ионно-молекулярной форме. При каком условии образуется осадок гидроксида кальция:
[Ca2+][OH-]2 < ПР(Ca(OH)2)
[Ca2+][OH-]2 > ПР(Ca(OH)2)?
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...