
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Процессы и оборудование, применяемые для очистки сточных вод
Электрохимические процессы широко применяются для очистки сточных вод и выделения металлов из растворов. Устройства, в которых проводят процессы электрохимического воздействия на водные растворы называют электролизерами. В зависимости от природы процессов в таких аппаратах, их разделяют на электрофлотаторы, электрокоагуляторы, собственно электролизеры и электродиализаторы.
Электрофлотация
Для проведения процесса электрофлотации используют водород и кислород, выделяющиеся при электролизе воды. На катоде происходит восстановление воды с образованием водорода:
2Н2О + 2ē → Н2 + 2НО-,
а на аноде процесс окисления сопровождается выделением кислорода:
2Н2О - 2ē → О2 + 4Н+ .
Электролиз обеспечивает получение высокодисперсной газовой фазы, что позволяет использовать электрофлотаторы для очистки воды от устойчивых коллоидных загрязнителей.
Электрофлотационные установки разделяют по направлению движения воды и флотирующих газов в них на противоточные и прямоточные с горизонтальным или вертикальным расположением электродов.. Многокамерный электрофлотатор состоит обычно из успокоителя, электродных камер и флотоотстойника. Сточная вода поступает в приемную камеру, отделенную от основной части перегородкой. Электродный блок представляет собой набор катодов и анодов. Проходя через электродное пространство, вода насыщается газообразными продуктами реакции, что приводит к всплыванию частиц. Электроды выполняют в виде проволочных сеток из меди или нержавеющей стали. Размер пузырьков газа, зависит от величины краевого угла смачивания и кривизны поверхности электродов, поэтому, изменяя диаметр проволоки, удается регулировать дисперсность газовой фазы. Оптимального распределения по размерам газовых пузырьков, а также газонаполнения достигают варьированием плотности тока на электродах.
В одной из конструкций аноды выполнены в форме трехгранных призм, расположенных в шахматном порядке на дне аппарата. Катоды представляют собой отдельные проволочные сетки, изогнутые под углом и расположенные над анодами параллельно граням.
Очищаемая вода поступает в приемную емкость , откуда переливается во флотационную камеру и насыщается пузырьками газа. Пузырьки флотируют загрязняющие компоненты на поверхность, где частицы скапливаются в виде пены и удаляются по наклонному желобу. Внутри желоба проходит трубопровод с горячей водой. Пенообразная масса в результате нагрева частиц дегазируется и образовавшаяся суспензия, содержащая тонкую фракцию, переливается в нижнюю емкость и удаляется из аппарата. Песковая часть твердой фазы. опускается вниз и выводится через штуцер.
Электрокоагуляция.
Электрокоагуляция – процесс очистки сточных вод путем захвата примесей труднорастворимыми гидроксидами железа, алюминия или магния, образующимися при анодном окислении соответствующего металла. Последние после подщелачивания раствора флотируются выделяющимся на катоде газообразным водородом.
Электрокоагулятор обычно представляет собой корпус, в который помещают электродную систему. Обрабатываемая вода протекает между электродами. В зависимости от характера движения обрабатываемой воды электрокоагуляторы бывают однопоточные и многопоточные, с горизонтальным и вертикальным движением воды.
Электрокоагуляторы снабжают вытяжным вентиляционным устройством для удаления газов, механическими устройствами для удаления флотируемых продуктов с поверхности очищаемой воды и осадка из нижней части аппарата, а также устройствами для очистки поверхности электродов и межэлектродного пространства.
Подключение электродов к источнику питания может быть параллельным или последовательным. Во втором случае ток подводится только к двум крайним электродам. Промежуточные электроды работают как биполярные.
Обычно электрокоагулятор служит только для образования гидроксидов металлов и агрегации частиц. Процесс разделения фаз проводят в других аппаратах: отстойниках, гидроциклонах и др. Есть конструкции, в которых эти процессы совмещены и протекают в одной камере. Процессы, протекающие в электрокоагуляторах на электродах и в объеме раствора, определяются природой материала электродов и примесей, содержащих в воде, а также величиной рН раствора.
При наложении электрического поля металлический анод растворяется, а на катоде выделяется водород. Зависимость силы тока от потенциала, определяемая экспериментально, имеет сложный вид, и в области определенных потенциалов происходит характерное снижение скорости процесса (пассивация электрода). Это явление необходимо учитывать при рассмотрении процессов электрокоагуляции. Для нормального протекания процесса коагуляции необходимо, чтобы образовавшиеся в результате электродной реакции ионы металла подверглись гидролизу.
Электрокоагуляцию применяют преимущественно в системах локальной очистки нейтральных и слабощелочных сточных вод, загрязненных тонкодисперсными и коллоидными примесями, от масел, нефтепродуктов, некоторых полимеров, соединений хрома и других тяжелых металле. Обрабатываемая вода проходит сначала предварительную грубую очистку в механических фильтрах или гидроциклонах Основной процесс электрокоагуляционной очистки происходит в аппарате, который является флотатором-отстойником. Часть скоагулированных примесей флотируется, другая осаждается в нижней части аппарата. Флотируемые продукты из верхней части аппарата, а также осадок из нижней части отводятся в сборник, а осветленная вода после фильтрации поступает в оборот. Нефтепродукты из сборника выводятся на последующую переработку.
Электролитическое извлечение металлов
Использованию электролиза для извлечения металлов осложняется низкой удельной производительностью электролизеров при работе на разбавленных растворах. Поэтому для увеличения интенсивности процессов используют объемные электроды (пластинчатые, объемно-пористые и псевдоожиженные). Подвергаемый обработке раствор пропускают через каналы в теле объемного электрода, потенциал которого поддерживают на уровне, обеспечивающем протекание процесса извлечения с максимально возможной скоростью, т. е. при предельной силе диффузионного тока. Условия электролиза выбирают такими, чтобы было возможно получать металлы в порошкообразной форме. Металл удаляют из нижней части аппарата, где осаждаются частицы, оторвавшиеся от катода под действием сил тяжести.
К объемнопористым относят электроды из гранул металла, частиц или волокон графита. Катодный блок с объемно-пористым электродным материалом состоит из камеры, к боковым перфорированным стенкам которой прижат слой углеграфитового материала, служащего катодом.
Раствор подается через штуцер внутрь блока и, проходя через поры между углеродными нитями в направлении, параллельном протеканию электрического тока, подвергается электролизу. Металл, осажденный на таком электроде, подвергается плавке вместе с материалом наполнителя.
При подведении тока к катоду с фронтальной стороны (обращенной к аноду) по мере продвижения его вглубь электрода потенциал уменьшается. Чем большее значение потенциала задается на фронтальной части электрода, тем на большую глубину будет работать электрод. Однако значение этого потенциала не должно достигать потенциала начала выделения водорода, поскольку это снижает выход по току вследствие блокирования внутренней поверхности электрода и снижению эффективности использования рабочего объема электрода. С помощью объемных электродов удается извлечь медь до остаточной концентрации 0,05 мг/л, ртуть - до 0,005 мг/л, серебро - до 40 мг/л и сурьму - до 5 мг/л.
Псевдоожиженные электроды, представляют собой суспензии электропроводных дисперсных материалов (графита, металла, некоторых оксидов), омывающие расположенные в объеме слоя токосборники. Скорость движения потока такова, что основная масса частиц циркулирует от вершины слоя к основанию, постоянно контактируя с токосборником.
С помощью электролиза можно также выделять металлическую медь из отработанных растворов после операции травления медных плат растворами трехвалентного железа. Для этого содержащий ионы меди и восстановленную форму окислителя (FeCl2), подают в теплообменник , где его охлаждают рассолом, циркулирующим с помощью насоса . Из теплообменных аппаратов через гидрозатворы и дозирующие емкости раствор подается в электролизеры, на катодах которых выделяется металлическая медь, а на анодах происходит окисление двухвалентного железа в трехвалентное.
Металлическая медь выделяется в виде мелкодисперсного порошка, периодически удаляемого с его поверхности. После от очистки осадка катодный блок возвращают обратно в электролизер. Работа пары электролизеров согласована таким образом,что в период удаления осадка в одном из них другой работает в режиме осаждения металла. Установка работает в автоматическом режиме, что обеспечивает выделение меди и поддержание постоянной ее концентрации в растворе.
Выбор материала электродов.
К материалу электродов предъявляются следующие требования: 1) устойчивость в процессе обработки и длительной эксплуатация; 2) нетоксичность электродов и продуктов их разрушения; 3) высокая электропроводность и механическая прочность; 4) доступность и невысокая стоимость.
Аноды, кроме того, должны быть устойчивы в водных растворах при потенциалах выделения кислорода (в кислых растворах > +1,23 В, а в щелочных < +0,41 В). Перечисленным требованиям удовлетворяют некоторые модификации графита. Для защиты от разрушения аноды пропитывают различными материалами, уменьшающими смачиваемость поверхности и препятствующими попаданию электролита в поры. В процессах очистки воды в качестве электродов часто используют магнетит FeO-Fe2O3. В последнее время для очистки воды применяют аноды из титана, на поверхность которого наносят слой высших оксидов рутения или кобальта. Они практически неразрушаемы и могут быть легко регенерированы.
К катодам предъявляют менее жесткие требования. Основной показатель для них - величина перенапряжения выделения водорода η (H2)
| Электрод | Pt | Fe | Ni | Zn | Pb | С | Cu |
| η (H2), В | 0,35 | 0,70 | 0,63 | 1,30 | 1,47 | 1,1-1,3 | 0,8 |
По величине перенапряжения электродные материалы разделяются на две группы: с низким (железо, никель и др.) и высоким (графит, цинк и др.) перенапряжением. Для процессов очистки воды, в которых определяющую роль играет анодный процесс (деструктивные методы), в качестве катодного материала выбирают металлы из первой группы, руководствуясь энергетическими затратами. Для процессов обработки воды, в которых катодная реакция обеспечивает удаление загрязнителей (выделение металлов, перевод вещества в менее токсичное соединение и др.), целесообразно использовать электроды с высоким перенапряжением при выделении водорода, что позволяет облегчить протекание реакций выделения металлов, стоящих перед водородом в ряду напряжений.
Расчет электролизеров.
Цель расчета – определить основные параметры аппарата: а) полезный объем, б) поверхность электродов, в) нагрузку по току и г) расход энергии на обработку воды. Исходными данными являются: а)предполагаемый расход сточной воды, б) общее содержание минеральных солей и загрязняющих компонентов в ней и в) время обработки воды. Объем электролизера определяют из выражения
V=Qt,
где Q — расход сточной воды, м3 /с; t — время обработки, с.
Нагрузку по току(А) находят ориентировочно из выражения
I= q Cо ВТ Q / t,
где q—теоретическое количество электричества, необходимое для обезвреживания 1 эквивалента загрязнителя и определяемое по закону Фарадея; С0 – концентрация ионов загрязнителя, экв/м3 ; ВТ - выход по току, доли единицы.
Общая поверхность электродов
S=V/(2d),
Где V – объем пространства между электродами, м3 ; d - расстояние между электродами, м.
Часто бывают заранее известны величины ВT, а также оптимальные значения плотности тока. В этих случаях размеры электродов могут быть определены из выражения
S = I / j,
где I – общая токовая нагрузка на аппарате; А; j - плотность тока, А/м2.
Поскольку при извлечении металлов процессы чаще всего протекают в диффузионном режиме, т.е. скорость процессов лимитируется доставкой разряжающихся частиц к электроду, поверхность электрода можно независимо определить из уравнения диффузии
Sk = (mv/Km) ln (Сн/Ск),
где mv - объемная скорость движения воды через аппарат, м3с; Km - коэффициент массопередачи, равный отношению D/δ, м.с; Сн - начальная концентрация металлов; Ск - конечная концентрация металлов на выходе из аппарата;
δ - толщина диффузионного слоя, м.
Расход энергии на электрохимическую обработку является основной величиной, определяющей эксплуатационные затраты и конкурентоспособность установок. Расход энергии Wобычно относят к 1 м3 очищаемой воды. Величина W определяется напряжением на электродах, расстоянием между ними, удельным сопротивлением и другими характеристиками обрабатываемой воды:
W = Qэл Uэл,,
где Qэл - количество электричества, затраченное на обработку 1 м3 воды;
Uэл - напряжение на электролизере.
Необходимое для обработки воды количество электричества зависит от содержания загрязнителя и вида электрохимической очистки. В процессах электрохимического окисления его удается оценить, если предположить, что для осуществления анодной деструкции до необходимой степени окисления органических соединений достаточно получить в результате электродной реакции количество кислорода, равное величине ХПК; тогда значение Qэл определяется из выражения (в А-ч/м3)
Qэл = 26,8 .ХПК/(Вт.8.105).
Если известна анодная реакция и в сточных водах присутствует токсичный компонент, например, цианид-ионы
CN- + 2 ОН- → CNО- + 2 H2О + 2ē,
то количество электричества, необходимое для обезвреживания ионов CN-, можно рассчитать из уравнения (в А/ч)
Qэл = 2,06 СоV / Вт ,
где Со - исходная концентрация цианидов в сточных водах, г/м3; V - объем сточных вод в электролизере, м3; 2,06 - электрохимический эквивалент окисления ионов CN-, А.ч/г.
Необходимость предварительного расчета количества электричества, потребляемого для очистки, обусловлена высокой химической активностью и токсичностью окислителей, образующихся в ходе электродных реакций, и стремлением избежать их накопления. В некоторых случаях величина Qэл известна из предварительных исследований.
Напряжение на одной секции аппарата (одна пара электродов) определяется из выражения
U = Ea + Ek + ηa +ηk + ΔEконц +ΔUэл +ΔUд + ΔU1 + ΔU2 ,
где Ea, Ek - обратимые значения потенциалов анода и катода, В; ηa, ηk - перенапряжение на аноде и катоде, В; ΔEконц - величина концентрационной поляризации, В; ΔUэл - падение напряжения в электролите, В; ΔUд - падение напряжения в диафрагме или мембране, В; ΔU1 + ΔU2 - падение напряжения в электродах и контактах, В.
При различных видах обработки вклад каждой составляющей U различен. Для электрофлотаторов и электрокоагуляторов, а также аппаратов электрохимической очистки окислением и восстановлением в общем балансе напряжения будут преобладать значения Ea, Ek, ηa,ηk. Для электродиализаторов основной составляющей баланса является падение напряжения на мембранах и в растворе: ΔUэл, ΔUд.
Теоретическое напряжение разложения ЕТ = Ea + Ek на электролизере можно определить, исходя из соотношения
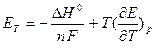 ,
,
где ΔН° - энтальпия реакции разложения; п -число электронов, участвующих в реакции; F - число Фарадея; дЕ/дТ - температурный коэффициент В/К.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...