
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Лабораторная работа № 9. Электрохимическое выделение меди из отработанных растворов гальванического производства
В современной технологии широко применяются методы электрохимической обработки изделий из различных сплавов (нанесение покрытий, травление, полирование и др.). При обработке сплавов на основе меди отработанные растворы содержат значительные количества этого ценного цветного металла. Улавливание меди из таких растворов путем катодного осаждения позволяет решить проблему повторного использования металла и очистки сточных вод.
Цель работы - исследовать процесс катодного осаждения меди из отработанных растворов и определить его основные технологические характеристики.
Теоретические основы.
При пропускании постоянного тока на катоде протекает процесс восстановления ионов меди (φо = +0,34 В), но возможно также восстановление водорода (φо = -0,059 pH)., поскольку применятся кислый раствор На аноде происходит окисление воды (φо= 1,23 - 0,059 рН).
При протекании тока потенциалы электродов отклоняются от равновесных значений. Это явление называется поляризацией. Она имеет несколько причин: изменение концентрации ионов у поверхности для лимитируемых диффузией электродных реакций; изменение химической природы поверхности электрода вследствие образования пленок твердых промежуточных продуктов реакции; образование тормозящего диффузию слоя пузырьков газообразных продуктов электродных реакций. Удельную скорость процесса оценивают по величине плотности тока i, А/дм2. Это основная технологическая характеристика гальванического процесса.
Экспериментальная часть
Оборудование и реактивы
- выпрямитель;
- ячейка;
- мешалка магнитная;
- весы ВЛ-500;
- бюретка на 25 мл;
- градуированная пипетка на 5 мл;
- колбы конические для титрования на 250 мл (6 шт);
- груша;
- раствор ЭДТА 0,1 н;
- индикатор ПАР (0,1 % раствор в воде).
-
При выполнении работы применяется лабораторная установка, схема которой изображена на рисунке.
Порядок работы.
1. Промыть электроды 5% -ным раствором соды, затем дистиллированной водой, промокнуть фильтровальной бумагой, просушить и взвесить с точностью до второго знака после запятой. Записать массу электродов в лабораторный журнал.
2. Налить в ячейку 250 мл исходного медьсодержащего раствора, опустить в него магнитный элемент мешалки и, соблюдая полярность, осторожно навесить катод и анод на контакты крышки, после чего опустить электроды в раствор. Включить вращение мешалки и выпрямитель, установив переключатель в крайнее правое положение (рис.1). Записать время начала опыта и начальную силу тока в цепи.
 |
3. Каждые 10 мин отбирать пипеткой при помощи груши по 1 мл раствора из ячейки и переносить в коническую колбу для титрования под своим номером. Всего отобрать 5 проб. В колбу с нулевым номером отобрать 2 мл исходного раствора.
Рис.1. Схема установки.
1 - магнитная мешалка, 2 - ячейка,
3 - медный катод, 4 - свинцовый анод, 5 -выпрямитель.
4. Через 50 мин после начала опыта записать силу тока в цепи и выключить выпрямитель. Электроды, как и перед опытом, промыть, просушить и взвесить.
5. Методом комплексонометрического титрования определить концентрацию меди в пробах отобранного раствора. Для этого к пробе раствора добавить 100 мл воды, 2 капли индикатора и титровать раствором ЭДТА до перехода окраски от фиолетово-красной к зеленой. Результаты определений и расчетов занести в таблицы, формы которых приведены ниже.
Таблица 1
Данные для расчета выхода по току и плотности тока
| mко, г | mккон, г | mао, г | mакон, г | Iисх, А | Iкон, А | Sкат, дм2 | Sан, дм2 |
Таблица 2
Данные для построения кинетической кривой осаждения меди
| t, мин | V(ЭДТА), мл | C(Cu2+), моль/дм3 | C(Cu2+), г/дм3 | a, % |
6. По результатам работы рассчитать среднюю катодную плотность тока, среднюю анодную плотность тока, среднее теоретическое значение массы осажденной меди, объем выделившегося кислорода при н.у., выход по току для меди. Перечислить возможные причины отклонения от теоретического выхода по току. Построить фрагмент кинетической кривой осаждения меди в координатах: «степень осаждения (a, % ) - продолжительность опыта (t, мин)».
Контрольные вопросы
1. Что такое электролиз?
2. Как рассчитать электрохимический эквивалент вещества?
3. Как выбрать рабочее напряжение для проведения электролиза?
4. Как изменяется потенциал медного электрода при пропускании тока?
5. Какова последовательность разряда на электродах: а) катионов, б) анионов?
6. Изменится ли анодная реакция при добавлении в раствор нитрата свинца? Для каких целей применяют электролиз в машиностроении?
7. Какие металлы можно выделять из растворов методом электролиза?
8. Какие виды электрохимических установок применяют для обезвреживания сточных вод?
9. Как повысить эффективность изученного в данной работе процесса выделения меди?
10. Позволяет ли рассмотренный метод очистить раствор от меди до величины ПДК.?
11. Какими методами можно провести более глубокую очистку сточных вод от тяжелых металлов?
Литература,. использованная в работах 8 и 9
1.Коровин Н.В. и др. Курс обще химии. М. Высшая школа,1990, С. 446 Разделы: VII.2 - VII.6, XVI.3.
2. Кудрявцев Т.Н. Электрохимические покрытия металлами. М., Химия, 1979.
3. Черепанов Ю.П., Самецкий Б.И. Электрохимическая обработка в машиностроении. М., Машиностроение, 1972.
4. Зеликман А.Н., Вольдман Г.М., Беляевская Л.В. Теория гидрометаллургических процессов. - М., Металлургия, 1975, -504 с.
5. Скорчеллетти В.В. Теоретическая электрохимия. Л., Химия, 1974.- 568 с.
6. Скорчеллетти В.В. Теоретические основы коррозии металлов. М., Химия, 1973. – 261 с.
Адсорбционные процессы
Адсорбция – самопроизвольное концентрирование вещества на поверхности раздела фаз. Причина адсорбции в нескомпенсированности межмолекулярных сил вблизи этой поверхности, т.е. наличие адсорбционного силового поля. Тело, создающее такое поле называют адсорбентом, а вещество, молекулы которого могут адсорбироваться – адсорбтивом, а уже адсорбированное вещество называют адсорбатом. Процесс, обратный адсорбции, называют десорбцией.
Адсорбционные силы имеют различную природу. Физической называют адсорбцию под действием ван-дер-ваальсовых сил. В результате хемосорбции образуются поверхностные соединения, имеющие валентные связи с адсорбентом. Этот тип адсорбции сопровождается высокими тепловыми эффектами (сотни кДж/моль), носит активированный характер и является необратимым. Между двумя названными существует множество промежуточных форм процесса адсорбции.
При очень малых степенях заполнения поверхности адсорбция описывается уравнением изотермы Генри
 или
или 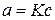 ,
,
где a – количество адсорбированного вещества, K – коэффициент Генри,
р – парциальное давление газообразного адсорбтива, c – концентрация адсорбтива в растворе.
При большой степени заполнения поверхности уравнение Генри не выполняется. В этом случае применяют эмпирическое уравнение Фрёйндлиха
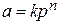 ,
,
где k и n – константы.
Строгая теория адсорбции создана Ленгмюром (1918), исходя из следующих условий:
- поверхность представляет собой набор энергетически равноценных активных центров;
- в процессе адсорбции образуется только один адсорбционный слой;
- взаимодействием адсорбированных молекул между собой можно пренебречь.
В этом случае справедливо уравнение
 ,
,
где аm – предельное количество адсорбированного вещества на данной поверхности (предельная адсорбция) , b – коэффициент адсорбции, р – парциальное давление газа (для растворов - концентрация).
Теория полимолекулярной адсорбции (Брунауэр, Эммет, Теллер) постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое (для них теплота адсорбции - q), является центром для молекулы, образующей второй слой и т.д. При этом считается, что теплота адсорбции во всех слоях, кроме первого, равна теплоте конденсации λ. Эта модель привела к уравнению
 ,
,
где  , аm – общее число дискретных адсорбционных центров, котороеприравнивают к числу молекул в первом адсорбционном слое при плотнейшей упаковке (при р=рs).
, аm – общее число дискретных адсорбционных центров, котороеприравнивают к числу молекул в первом адсорбционном слое при плотнейшей упаковке (при р=рs).
На пористых адсорбентах при сравнительно высоких значениях р/рs возникает капиллярная конденсация, которая приводит к дополнительному полглощению адсорбтивов при температурах ниже критической Капиллярное поглощение связано с образованием в поре вогнутого мениска в результате чего в ней начинается конденсация при р/рs< 1. Согласно уравнению Кельвина
 ,
,
где σ – поверхностное натяжение адсорбата, V – его мольный объем, r – радиус кривизны мениска. Капиллярная конденсация приводит к резкому подъему изотермы адсорбции.
Адсорбция – гетерогенный процесс. Её скорость могут определять диффузия или взаимодействие адсорбтива с поверхностью адсорбента. В первом случае наблюдаются зависимости, характерные для диффузионных процессов. Во втором количество адсорбата θ можно рассчитать по уравнению
θ = θравн [1-exp(-kt)] ,
где k = kадс + kдес – сумма констант скорости адсорбции и десорбции.
При экспериментальном изучении динамики адсорбции через слой адсорбента пропускают раствор с заданными характеристиками (жидкий или газообразный), и исследуют состав выходящего раствора как функцию времени. Появление поглощаемого вещества за слоем называют проскоком, а время до проскока - временем защитного действия. Зависимость концентрации адсорбтива за слоем от времени называют выходной кривой. Эти кривые представляют собой основной экспериментальный материал для суждений о закономерностях динамики адсорбции.
Аппаратурное оформление технологического процесса адсорбции может быть весьма разнообразным. Распространены циклические и периодические установки с неподвижным слоем адсорбента, основной узел которых – один или несколько адсорберов, выполненных в виде полых колонн, заполняемых гранулированным адсорбентом. После проскока адсорбент регенерируют, а очищаемый поток направляют в другой адсорбер. Регенерация адсорбента включает несколько стадий, важнейшая из которых - десорбция. Ее проводят нагреванием, сбросом давления (для газов), вытеснением (например, острым паром) или комбинацией этих методов.
В установках с движущимся слоем адсорбента (в гиперсорберах) последний под действием силы тяжести медленно опускается и выводится из нижней части адсорбера, откуда после десорбции газовым эрлифтом транспортируется в голову колонны. Перерабатываемый газовый непрерывно поток подается в середину адсорбера и движется противотоком адсорбенту. В верхней части протекает адсорбция, а в нижней – десорбция.
В установках с псевдоожиженным («кипящим») слоем адсорбента газовый поток, поступающий снизу, приводит адсорбент во взвешенное состояние. При этом резко увеличивается интенсивность массообмена и сокращается продолжительность адсорбции и десорбции. Широкому распространению этих высокоэффективных установок препятствует недостаточная механическая прочность зерен адсорбента и слабая их устойчивость к истиранию.
Адсорбенты должны иметь высокую адсорбционную емкость, представлять собой дисперсные материалы с большой удельной поверхностью, или с большим объемом пор. Важны их механическая прочность, химическая и термическая устойчивость, регенерируемость, доступность. Наиболее распространены активные угли, ксерогели некоторых оксидов (силикагели, алюмогели), цеолиты; из непористых адсорбентов – технический углерод (сажа) и высокодисперсный оксид кремния (аэросил, «белая сажа»).
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...