
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Лабораторная работа № 10. Утилизация органических соединений методом адсорбции паров на активированном угле. Улавливание паров бензола
Адсорбционные методы наиболее эффективно решают проблему улавливания газов при очистке воздуха в различных технологических процессах. После поглощения возможна рекуперация адсорбированных веществ путем десорбции, например, острым паром, или утилизация. Для улавливания паров органических растворителей используют активные угли марки СКТ (СКТ-1,-2,-3,-4,-5), у которых объем пор достигает 0,98 см3/г, а удельная поверхность - 180 м2/г.
Важнейшей характеристикой адсорбента является его динамическая активность, которую оценивают по поглощению бензола или хлористого этила в стандартизированных условиях.
Экспериментальная часть
Цель работы -исследовать процесс улавливания паров бензола из воздуха, оценить динамическую активность угля по бензолу.
Оборудование и реактивы
- установка для поглощения паров летучих органических жидкостей
- весы лабораторные ВЭЛ-500
- бензол
- индикаторный раствор (1 г сухого NaNO2 на 50 см3 концентрированной H2SO4 "х.ч.")
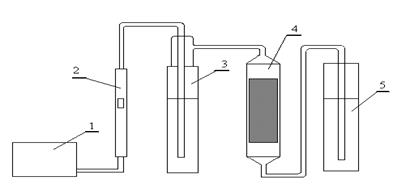
|
Рис. Схема адсорбционной установки.
1- микрокомпрессор, 2- ротаметр, 3- испаритель, 4- адсорбер, 5- сосуд с индикаторной жидкостью.
Порядок работы.
1. В поглотительный сосуд (4) засыпать через воронку 30 г свежего активированного угля, взвешенного на технических весах. 2.
2. Закрыть сосуд пробкой и взвесить с точностью до второго знака (вместе с соединительными трубками и зажимами).
3. В испаритель (3) налить 50 см. куб. бензола.
4. В пробирку (5) налить 5 см 53 0 индикаторной жидкости.
5. Взвешенный сосуд (4) подсоединить к системе согласно рисунку, открыть зажимы на трубках на входе и выходе абсорбера (4).
6. Включить микрокомпрессор (записать время начала опыта), установить поток воздуха на 60 единицах по шкале ротаметра.
7. Каждые 10 мин перекрывать зажимами трубки поглотительного сосуда (4) отсоединять его и взвешивать (на это время выключать микрокомпрессор).
8. Затем продолжить процесс поглощения бензола в течение следующего 10-минутного периода.
9. Провести 5 - 6 таких измерений. Если индикаторная жидкость приобретет желтую окраску, опыт прекратить раньше.
Вся работа проводится в вытяжном шкафу, поскольку пары бензола токсичны и при больших концентрациях взрывоопасны.
По результатам измерений построить график зависимости удельной массы адсорбированного бензола (М, г/г угля) от времени; оценить объем пропущенного через слой угля воздуха и концентрацию в нем паров бензола, учитывая, что 100 единиц на шкале ротаметра соответствует скорости подачи газа 60 дм3/ч, а зависимость его показаний от скорости подачи газа линейна. Рассчитать величину динамической активности испытываемого угля Х (г/ дм3) по формуле
Х =Δm / V ,
где Δm - изменение массы поглотительного сосуда с углем, г, V - объем угля в поглотительном сосуде, дм3 (оценивают по результатам обмера сосуда и высоты слоя угля).
Контрольные вопросы
1. Сущность процесса адсорбции. Изотермы адсорбции.
2. Факторы, влияющие на процесс адсорбции.
3. Области применения адсорбционных процессов.
4. Технологические схемы процессов адсорбционной очистки газов.
5. Аппаратурное оформление процессов адсорбционного улавливания.
6. Регенерация и утилизация сорбентов после их насыщения.
Лабораторная работа № 11. Утилизация содержащихся в сточных водах органических соединений методом адсорбции на активированном угле
Адсорбционная очистка технологических растворов и сточных вод применяется весьма широко, например, при улавливании нефтепродуктов, красителей и т.п.
Цель работы - исследовать процесс адсорбционного улавливания метиленового голубого активированным углем. Определить осветляющую способность активированного угля. Построить изотерму адсорбции.
Изотерма адсорбции отражает равновесное состояние в системе адсорбированное вещество - адсорбент. Построение изотермы необходимо для оценки адсорбционной способности сорбента. Изотерму строят в координатах "А - С", где А - масса (или количество) адсорбированного вещества, приходящегося на 1 г адсорбента; С - равновесная концентрация адсорбируемого вещества. Для случая мономолекулярной адсорбции изотерма описывается уравнением Ленгмюра
A = A kC/(1 + kC) ,
где А - предельная адсорбция, k - константа равновесия (отношение констант скоростей адсорбции и десорбции). Более сложные изотермы могут быть описаны уравнением Фрёйндлиха.
Существует ГОСТ на определение осветляющей способности активированных углей по поглощению метиленового голубого (например, ГОСТ 4453-48 /п.9/).
Экспериментальная часть
Оборудование и реактивы:
- фотоколориметр КФК-2 с кюветами l = 1 см;
- растворы метиленового голубого с концентрацией 0.15% и 0,1 г/дм3;
- колбы конические объемом 100 см3 -10 шт;
- бюретка объемом 25 см3;
- пипетка градуированная, объемом 10 см3;
- колбы мерные на 50 см3 - 6 шт;
- мерный цилиндр на 50 см3;
- воронки для фильтрования 6 шт;
- фильтровальная бумага.
Порядок работы.
1. Построение градуировочного графика для фотометрического определения концентрации метиленового голубого. В мерные колбы на 50 см3 налить соответственно 1, 2, 3, 4 и 5 см3 раствора метиленового голубого с исходной концентрацией 0,1 г/дм3 и разбавить водой до метки. После перемешивания измерить оптическую плотность полученных растворов D при длине волны λ=650 нм (красный светофильтр) и толщине слоя раствора в кювете 1 см.
2. Построение изотермы адсорбции. В конические колбы объемом 100 см3 поместить навески активированного угля массой 0,5 г. В каждую колбу добавить соответственно 15, 20, 25, 30 и 35 см3 раствора метиленового голубого с исходной концентрацией 1,5 г/дм3 и дистиллированной воды до 50 см3 (приливать воду из бюретки). Каждые 2 минуты растворы перемешивать легким покачиванием. Через 20 мин определить остаточную концентрацию метиленового голубого в растворе, находящемся в равновесии с углем. Для этого растворы из конических колб отфильтровать в чистые колбы и определить их оптическую плотность. Условия фотометрирования описаны выше.
Результаты измерений занести в таблицу. По данным таблицы построить график зависимости удельной адсорбции (А, г/г угля) от равновесной концентрации метиленового голубого (С, г/дм3).
3. Определение осветляющей способности угля (по ГОСТ 4453-48). В коническую колбу на 100 см3 внести навеску 0,4 г активированного угля и прилить из бюретки 10 см3 раствора метиленового голубого с концентрацией 1,5 г/дм3. После 5-минутного взбалтывания к обесцвеченному раствору прилить 1 см3 того же раствора и снова перемешать. Если через 5 мин раствор обесцветится, снова прилить 1 см3 раствора метиленового голубого. Раствор прибавлять пока он не перестанет обесцвечиваться. В данном случае речь идет об исчезновении голубой окраски, но из-за наличия в растворе взвеси угля он кажется черным.
Осветляющую способность угля (Е) рассчитывают в % к условно принятой величине осветляющей способности такого угля, 0,1 г которого обесцвечивает 20 см3 0,15%-ного раствора метиленового голубого. Расчет ведут по формуле
Е = ( n / 20 см3) 100% ,
где n - количество см3 раствора метиленового голубого, обесцвеченного 0,1 граммами угля.
Контрольные вопросы
1. Адсорбция. Механизмпроцесса. Адсорбенты и их важнейшие свойства.
2. Адсорбционное равновесие. Изотермы адсорбции.
3. Десорбция (вакуумная, термическая, вытеснительная).
4. Технологические схемы и аппаратурное оформление адсорбционных процессов.
6. Примеры адсорбционной очистки, рекуперации и утилизации.
Использованная литература.
1. Коуль А. Л., Розенфельд Ф. С. Очистка газа. М., Недра, 1968, -394 с.
2. Смола В. И., Кельцев Н. В. Защита атмосферы от двуокиси серы. М., Металлургия, 1976. -256 с.
3. Кельцев Н .В. Основы адсорбционной техники. М., Химия, 1984, 252 с.
4. Бутырин Г. М. Высокопористые углеродные материалы. М., Химия, 1976.
5. Колышкин Д. А.. Михайлова К. К. Активные угли. Справочник. Л., 1974.
6. Кишле Х., Бадер Э. Активные угли и их промышленное применение. Л., Химия. 1984.
7. Родионов А. М., Клушин В. Н., Торочешников Н. С. Техника защиты окружающей среды. М., Химия, 1989 (Гл. 4 и 8).
8. Очистка и рекуперация промышленных выбросов /Максимов В. Ф., Вольф И .В., Винокукрова Т. А. и др./ М., Лесная промышленность,1989 -416 с. (гл. 13).
9. Химическая энциклопедия (в пяти томах). М., Советская Энциклопедия, 1988. Т. 1 (статья «Адсорбция»).
Дистилляция
Дистилляцией называют процесс разделения жидких смесей на отличающиеся по составу фракции путем частичного испарения жидкости и последующей конденсации пара. Метод основан на различии в составах жидкости и образующегося из нее пара. Отогнанная фракция (дистиллят) обогащена относительно более летучим (низкокипящим) компонентом, а неотогнанная жидкость (кубовый остаток) – менее летучим (высококипящим). Если из исходной смеси отгоняется не одна фракция, а несколько, то дистилляцию называют фракционной (дробной). В зависимости от условий процесса различают простую и молекулярную дистилляцию.
Простая дистилляция проводится при таких значениях давления, при которых длина свободного пробега молекул во много раз меньше, чем расстояние между поверхностями испарения жидкости и конденсации пара. Температура процесса при данном давлении определяется условиями фазового равновесия между жидкостью и паром. При необходимости снижения температуры применяют перегонку под вакуумом, а также с водяным паром или инертным газом
Распределение компонентов смеси между жидкостью и паром характеризуется коэффициентом летучести
 ,
,
где xi, и xk , yi и yk – содержания компонентов i и k соответственно в жидкости и в образующемся из нее паре. Состав последнего определяется свойствами и межмолекулярным взаимодействием компонентов.
Дистилляция осуществляется периодически или путем непрерывной подачи исходной смеси и отбора продуктов разделения (дистиллята и кубового остатка). Аппараты, применяемые для дистилляции делят на ёмкостные и пленочные. В емкостных аппаратах при непрерывном режиме дистилляции достигается меньшая степень разделения, чем при периодическом.
В пленочных аппаратах жидкость распределяется по поверхности нагрева в виде пленки. По способу ее образования различают: аппараты с жидкостью, свободно стекающей по обогреваемой поверхности (например, по поверхности труб), а также с восходящим движением жидкости за счет трения на границе между жидкостью и паром, движущимся снизу вверх с большой скоростью; роторные с жидкостью, размазываемой по поверхности обогреваемого корпуса при вращении ротора с подвижными или неподвижными лопастями. Состав жидкости в пленочных аппаратах изменяется по высоте и на выходе из аппарата приближается к равновесному с исходной смесью, имеющей наибольшее содержание низкокипящих компонентов. Иными словами достигается дополнительное по сравнению с простой дистилляцией разделение смеси.

Лабораторная работа № 12. Разделение смеси ацетон-бензол методом дистилляции
Рис. 1. Диаграмма "температура - состав" системы ацетон – бензол
Жидкие смеси многих взаимно растворимых веществ являются отходами различных технологических процессов. Повторное использование индивидуальных компонентов таких отходов возможно только после их разделения, которое обычно проводят методом дистилляции.
Цель работы - исследовать процесс разделения жидкой смеси методом дистилляции, оценить его эффективность.
Зависимость температуры кипения раствора от состава при постоянном давлении представлена на рис. 1.
По диаграмме можно определить состав пара и равновесной с ним жидкости при данной температуре.
Экспериментальная часть
Оборудование и реактивы:
- установка для дистилляции;
- рефрактометр;
- исходный раствор ацетона в бензоле (30, 40 или 50%);
- набор растворов известного состава (см. табл. 1);
- пробирки с пробками 6 шт.
 |
Рис. 2. Схема установки для дистилляции.
1- колбонагреватель, 2- колба для перегонки, 3- термометр,
4-холодильник, 5 аллонж, 6 - приемная колба.
Порядок работы.
1. Собрать лабораторную установку в соответствии со схемой, представ
ленной на рис. 2.
2. В колбу 1 налить 300 мл разделяемой смеси, опустить туда кусочек фарфоровой соломки, закрыть колбу термометром, включить пропускаемую через холодильник воду и включить нагреватель. После появления первых капель конденсата отметить температуру начала перегонки и начать отсчет времени опыта. При слишком бурном кипении уменьшить интенсивность нагревания. Каждые 10 мин отбирать по 1 мл отгоняемой жидкости для анализа и регистрировать температуру. Через 50 мин дистилляцию прекратить (в любом случае не отгонять из колбы 1 больше, чем 70% от исходного объема раствора).
3. По набору стандартных растворов построить градуировочную зависимость для рефрактометрического определения состава раствора ацетона в бензоле, для чего измерить коэффициенты преломления чистых жидкостей и их смесей известного состава. При измерении коэффициента преломления на сухую призму рефрактометра наносят каплю жидкости, закрывают призму и считывают по шкале прибора величину показателя преломления на линии, разделяющей светлое и темное поля, наблюдаемые в окуляр. Результаты заносят в табл.1.
Таблица 1
Данные для построения градуировочного графика
| № стандартного раствора | |||||
| Концентрация ацетона, % | |||||
| Концентрация бензола, % | |||||
| Показатель преломления (n) |
4. Измерить величины коэффициента преломления проб дистиллята и по графику определить их состав. По полученным данным построить участок кривой "температура кипения - состав пара" на диаграмме состояния двухкомпонентной системы (см. рис. 1).
5. Заполнить табл. 2.
Таблица 2
Результаты разделения смеси
| № пробы | τ, мин | t, oС | N | Cацет, % | Cбенз, % |
Контрольные вопросы.
1. Что такое дистилляция? Для каких целей она применяется?
2. Давление пара над чистой жидкостью и раствором. Зависимость давления пара от состава раствора. Закон Рауля.
3. Диаграмма "температура - состав" двухкомпонентного раствора. Равновесные составы жидкости и пара. Правило рычага. Азеотропные смеси.
4. Ректификация. Принцип разделения сложных растворов. Области применения.
Использованная литература.
1. Коган В. Б. Теоретические основы типовых процессов химической технологии. Л., Химия, 1977.
2. Гельперин Н. И. Основные процессы и аппараты химической технологии. Кн. 1 и 2. М., Химия, 1981.
3. Практикум по физической химии /Под ред. С. В. Горбачева/ М.: Высшая школа, 1974, гл.VIII.
Методы разделения фаз в процессах рекуперации и утилизации отходов. Фильтрование
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...