
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ У НАСЫЩЕННОГО АТОМА УГЛЕРОДА
| Факторы | (SN1) | (SN2) |
| Строение субстрата | Реакционная способность падает в ряду: Бензильный, аллильный > третичный > вторичный > первичный | Реакционная способность растет в ряду: Бензильный, аллильный < третичный < вторичный < первичный |
| Вступающая группа | Практически нет влияния | Чем больше нуклеофильность, тем вероятнее протекание реакции |
| Уходящая группа | Чем ниже энергия связи, тем легче протекает реакция | Замещение затрудняется с увеличением нуклеофильности (основности) уходящей группы |
| Стерические факторы | Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра способствует протеканию реакции. | Препятствуют атаке нуклеофильного центра и затрудняют реакцию |
| Влияние растворителя | Реакции способствуют протонные полярные растворители | Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. В целом, лучше протекают с апротонными полярными растворителя. |
| Концентрация нуклеофила | На скорость реакции не влияет | Скорость реакции пропорциональна концентрации нуклеофила |
Реакции элиминирования (Е1,Е2)Е1Е2
Реакции элиминирования являются конкурентно протекающими с реакциями нуклеофильного замещения у насыщенного атома углерода SN1 и SN2. Направление реакции в сторону Е1 или Е2 зависит от ряда факторов:
-структура субстрата;
-структура атакующего нуклеофила;
-основность атакующей частицы;
-природа растворителя.
Мономолекулярное элиминирование Е1.
Схема реакции совпадает со схемой мономолекулярного замещения до момента образования карбониевого катиона, т.е. отсоединения уходящей группы:

Далее протекает либо реакция замещения, либо (в зависимости от среды и атакующей частицы) отщепление протона и образование продукта элиминирования:
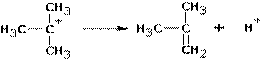
Если существует возможность образования нескольких алкенов, то преимущественно образуются наиболее замещенные алкены. Однако, такая ситуация наблюдается тогда, когда максимально замещенный алкен не имеет пространственных затруднений, как у ниже приведенного (I):

В этом случае предпочтительно образование алкена (II).
Особенностями реакций SN1 и Е1 является тенденция к перегруппировке образовавшегося карбкатиона:

Бимолекулярное элиминирование Е2.
Механизм реакции общих этапов с реакцией SN2 не имеет. Обычно протекает транс- элиминирование по схеме:

Влияние структурных факторов:
- для органических галогенидов с заданным R скорость отщепления меняется в зависимости от уходящей группы (Х) в следующем порядке: J > Br > Cl > F. - при фиксированном Х скорость отщепления следует порядку: третичный R > вторичный R > первичный R. Пространственные препятствия оказывают на реакции Е2 очень слабое влияние по сравнению с реакциями SN2. Отщепление в случае третичных галогенидов происходит очень легко.
Влияние атакующей частицы.
Для проведения Е2 реакций обычно требуются сравнительно сильные основания. В ряду оснований эффективность изменяется параллельно их силе: H2N- > C2H5O- > HO- > CH3COO- . Соответственно, протеканию нуклеофильного замещения способствуют слабоосновные реагенты, подобные иодид- или ацетат-ионам. Отщепление также преобладает над замещением при повышенных температурах. В случае алкилгалогенидов с различными алкильными остатками существует возможность образования двух алкенов:

Для большинства реакций отщепления типа Е2 характерно образование наиболее замещенного алкена типа II. Однако в том случае, когда уходящая группа имеет большой объем или обладает сильными электроноакцепторными свойствами, а также если атакующее основание имеет большой объем, может оказаться более благоприятным образование наименее стабильного (наименее замещенного) алкена.
| Состав продуктов Е2-реакции 2-пентильных производных (см. выше) при использовании этилата калия в этаноле. | уходящая группа | количество продукта отщепления, % |
| 2-метилпентен-1 (I) | 2-метилпентен-2 (II) | |
| -Br | ||
| -J | ||
| -OSO2R | ||
| -S+(CH3)2 | ||
| -N+(CH3)3 |
Большой объем уходящей группы приводит к тому, что основание атакует более доступный атом водорода крайней метильной группы.
| Состав продуктов Е2-реакции трет-амилбром-ида (см. выше) с алкоголятами калия. | основание (алкоголят-ион) | количество продукта отщепления, % |

| 
| |

| ||

| 72,5 | 27,5 |

| 77,5 | 22,5 |

| 88,5 | 11,5 |
В данном случае большой объем атакующего основания приводит к тому, что легче отщепляются (в виде протона) более доступные крайние атомы водорода. Реакции отщепления Е2 происходит наиболее легко в том случае, если молекула может принять такое пространственное расположение, когда уходящие группы Н и Х расположены в транс-положении:
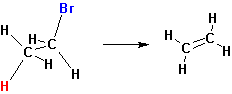
Некоторые реакции отщепления, сходные с пиролизом окисей аминов, протекают по цис- направлению. Уходящая группа в таких случаях одновременно является основанием, отщепляющим протон:

Изменение природы растворителя может приводить к получению разных продуктов. Так, реакция изобутилбромида со спиртовой щелочью приводит к образованию ряда продуктов:
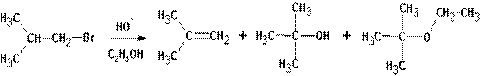
Судя по образовавшимся продуктам, протекают реакции SN1 (наблюдается перегруппировка углеводородного скелета и образование всех возможных продуктов замещения) и конкурирующая с ними Е1. Протекание реакции Е2 маловероятно, но не исключено. Продуктов реакции SN2 не обнаруживается вовсе:

А та же самая реакция в среде пиридина (или третичных аминов) протекает только с элиминированием:
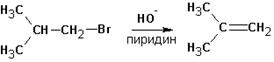
Этому явлению есть одно объяснение. Протекание реакции SN2 затруднено в обоих растворителях из-за стерических препятствий. Способность спирта сольватировать анионы (протонный растворитель) во-первых облегчает протекание реакции SN1, во-вторых- несколько снижает нуклеофильную силу и основность гидроксил-иона. В случае пиридина или третичных аминов (которые совершенно не сольватируют анионы, но зато хорошо связывают протон и катионы и к тому же являются слабыми нуклеофилами) создаются почти исключительные условия для протекания реакций элиминирования и, вероятно, по механизму Е2.
Реакции конденсации
Присоединение карбаниона или другого нуклеофила к карбонильному соединению или другому электрофилу с последующим отщеплением воды носит название реакции конденсации. Более общее определение гласит: реакция конденсации- это реакция, привоящая к изменению углеродного скелета и сопровождающаяся увеличением числа атомов углерода путем образовани новых углерод-углеродных связей. В общем случае участие карбанионов в реакциях конденсации можно записать в виде следующей схемы:
а) образование карбаниона:
X-CH2-Y+B-(илиВ:)=X--CH-Y+BH(илиВН+)
б) реакция карбаниона с карбонильным соединением:
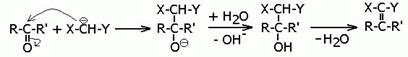
Из этой общей схемы вытекают следующие важные замечания:
1. Общая стехиометрия реакции проста:
X-CH2-Y + R-CO-R' ® RR'C=CXY + H2O
Таким образом, если основание связывается на стадии, определяющей скорость реакции (т.е. его концентрация определяет скорость реакции), оно не расходуется в течение реакции, а регенерируется на последней стадии. Поэтому для проведения реакции совсем не обязательно стехиометрических количеств основания, а достаточно каталитических.
2. Для проведения конденсации можно использовать более слабое основание, чем при алкилировании или ацилировании, поскольку соединение X-CH2-Y не обязательно должно быть полностью переведено в карбанион до введения в реакцию с карбонильным соединением.
3. Так как теоретически все стадии обратимы, то для более полного прохождения реакции полезно удалять воду, образующуюся на последней стадии.
4. Если система содержит более одного источника карбанионов и (или) более одной карбонильной группы, конденсация будет идти главным образом за счет атаки наиболее стабильным анионом самого электрофильного карбонильного углерода.
Реакция Канниццаро
Альдегиды, не имеющие альфа-углеродных атомов водорода при нагревании с сильными основаниями вступают в реакцию окисления-восстановления, когда одна из молекул восстанавливается до спирта за счет окисления второй молекулы до карбоновой кислоты. Такие реакции носят название реакции Канниццаро, и протекают по схеме:

Известны и внутримолекулярные реакции окисления-восстановления:
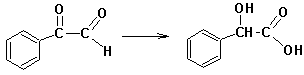
Cвоеобразной разновидностью внутримолекулярного окисления-восстановления является Бензиловая перегруппировка:

Бензоиновая конденсация
Cамоконденсация ароматических альдегидов в присутствии цианидов носит название бензоиновой конденсации:

В бензоиновую конденсацию не вступают ароматические альдегиды, содержащие в кольце сильные электроноакцепторные или электронодонорные заместители. Сильные электроноакцепторы снижают реакционную способность (нуклеофильность) циангидрина, а сильные электронодоноры понижают электрофильность карбонильного углерода второй молекулы бензальдегида, выступающей в качестве "карбонильной компоненты" реакции.
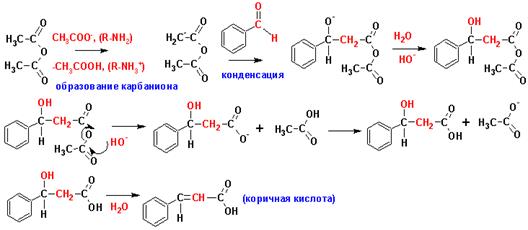
Конденсация Перкина
Конденсация ароматических альдегидов с ангидридами карбоновых кислот, катализируемая солями этих кислот, аминами или основаниями, носит название реакции Перкина:
Кляйзена-Шмидта реакция
Такое название носит реакция конденсации ароматических альдегидов с алифатическими карбонильными соединениями:

Cложноэфирная конденсация
Реакции конденсации сложных эфиров весьма схожи по схеме с конденсацией других карбонильных соединений. Одна молекула сложного эфира является карбонильной компонентой, другая- метиленовой. Простейший пример- самоконденсация этилацетата, приводящая к ацетоуксусному эфиру и катализируемая алкоголятом, соответствующим спирту в сложном эфире:

Для успешного протекания реакции в продукте конденсации должен присутствовать, как минимум, один альфа-углеродный атом водорода. Обладая повышенной кислотностью он легко отщепляется при взаимодействии с алкоголятом с образованием енолят-аниона, смещая равновесие реакции в сторону образования продукта:

Конденсация Дикмана
Внутримолекулярная сложноэфирная конденсация носит название конденсации Дикмана. В эту реакцию вступают эфиры дикарбоновых кислот, реакции протекают, если в результате получаются малонапряженные пяти- и шестичленные циклы:

Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...