
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Например, число черточек, отходящих от символа элемента в структурных формулах, равно валентностиэтого элемента. Посмотрите на приведенные ниже структурные формулы некоторых веществ – из них видно, что водород и хлор одновалентны, кислород двухвалентен, углерод четырехвалентен, а азот трехвалентен.
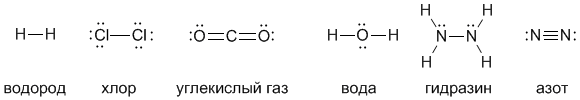
Точками здесь обозначены неподеленные пары электронов, но в структурных формулах их показывают не всегда (в связывании они непосредственно не участвуют, хотя важны с точки зрения правила октета). В структурных формулах каждая черточка – это именно поделенная пара электронов. Поэтому можно дать такое определение валентности:
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Молекулярная формула показывает, сколько атомов каждого элемента входит в состав молекулы вещества.
Степень окисления - условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. Это означает, что более электроотрицательный атом, смещая к себе одну электронную пару, приобретает заряд -1, две электронных пары - заряд -2. Связь между одинаковыми атомами не дает вклада в степень окисления. Таким образом, связь между атомами С-С соответствует нулевой степени их окисления. В связи C-H углероду как более электроотрицательному атому соответствует заряд -1, а в связи C-O заряд углерода (менее электроотрицательного) равен +1. Степень окисления атома в молекуле подсчитывается как алгебраическая сумма зарядов, которые дают все связи данного атома.
Так, в молекуле CH3Cl три связи C-H дают суммарный заряд на атоме C, равный -3, а связь C-Cl - заряд +1. Следовательно, степень окисления атома углерода в этом соединении равна:
- 3+1=-2.
1.Элемент в простом веществе имеет нулевую степень окисления;
2.Все металлы имеют положжительную степень окисления;
3.Бор и кремний в соединениях имеют положительные степени окисления;
4.Водород имеет в соединениях степень окисления (+1).Исключая гидриды( соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H- );
5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F-2 и в перекисях( Н2О2 - степень окисления кислорода (-1);
6.Фтор имеет степень окисления (-1)
Оксиды. Определение, классификация, номенклатура, свойства и способы получения.
Оксидом называется сложное вещество, состоящее из атомов двух элементов, один из которых - кислород.
Поскольку кислород соединяется почти со всеми элементами, существуют оксиды как металлов, так и неметаллов. Оксиды металлов, подобно CuO, Fe2O3, СаО – твердые вещества. Оксиды неметаллов могут быть как твердые (P2O5), так и жидкие (H2O) и газообразные (как SO2 и CO2).
Элементы с переменной валентностью могут образовывать несколько оксидов. Чтобы их отличать, в названии оксида указывают валентность связанного с кислородом элемента. Нам уже встречались такие названия в предыдущем параграфе. Приведем еще примеры:
SO2 – оксид серы (IV), SO3 – оксид серы (VI)
Cr2O3 – оксид хрома (III), CrO3 – оксид хрома (VI)
В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды(например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды:оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Химические свойства
Основные оксиды
1. Основный оксид + cильная кислота → соль + вода

2. Сильноосновный оксид + вода → щелочь

3. Сильноосновный оксид + кислотный оксид → соль


4. Основный оксид + водород → металл + вода

Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
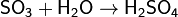
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль

3. Кислотный оксид + основание → соль + вода

Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:


4. Нелетучий оксид + соль1 → соль2 + летучий оксид

5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1

Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:

При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
 (в водном растворе)
(в водном растворе)
 (при сплавлении)
(при сплавлении)
Получение
1. Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
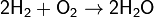
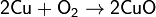
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды:


2. Обжиг или горение бинарных соединений в кислороде:



3. Термическое разложение солей:


4. Термическое разложение оснований или кислот:


5. Окисление низших оксидов в высшие и восстановление высших в низшие:

6. Взаимодействие некоторых металлов с водой при высокой температуре:

7. Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:

8. Взаимодействие металлов с кислотами-оксилителями:

9. При действии водоотнимающих веществ на кислоты и соли:

10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:

| Формула | Название | Формула | Название |
| CO | оксид углерода ( II ) | Fe2O3 | оксид железа (III ) |
| NO | оксид азота ( II ) | CrO3 | оксид хрома (VI ) |
| N2O5 | оксид азота (V ) | Mn2O7 | оксид марганца (VII ) |
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 
|
| нагреванием оснований | Cu (OH)2=CuO+H2O | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 
| |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 
| |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 
|
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...