
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Главная подгруппа III группы: общая характеристика элементов. Бор и его соединения: получение, физические и химические свойства, применение в медицине.
Подгруппа бора — главная подгруппа III группы. По новой классификации ИЮПАК: 13 группа элементов Периодической системы химических элементов Д. И. Менделеева, в которую входят бор B, алюминий Al, галлий Ga, индий In и таллий Tl. Все элементы данной подгруппы, за исключением бора, металлы.
|  |
| |||||
| |||||||
К III группе относятся бор, алюминий, галлий, индии, таллий (главная подгруппа), а также скандий, иттрий, лантан и лантаноиды, актиний и актиноиды (побочная подгруппа).
На внешнем электронном уровне элементов главной подгруппы имеется по три электрона (s2р1). Они легко отдают эти электроны или образуют три неспаренных электрона за счет перехода одного электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по три электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.
Электронное строение валентного слоя актиноидов во многом напоминает электронное строение валентного слоя лантаноидов. Все лантаноиды и актиноиды — типичные металлы.
Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты.
Элементы III группы находят самое разнообразное применение.
Бор был открыт Ж. Гей-Люссаком и Л. Тенаром в 1808 г. Содержание его в земной коре составляет 1,2·10-3 %.
Соединения бора с металлами (б о р и д ы ) обладают высокой твердостью и термостойкостью. Поэтому их используют для получения сверхтвердых и жаропрочных специальных сплавов. Большой термостойкостью обладают карбид и нитрид бора. Последний применяют в качестве высокотемпературной смазки. Кристаллогидрат тетрабората натрия Nа2В4O7·10Н2О (бура) имеет постоянный состав, его растворы применяют в аналитической химии для установления концентрации растворов кислот.
Содержание галлия в земной коре составляет 1,9·10-3 %. Он был предсказан Д. И. Менделеевым (экаалюминий) и открыт французским химиком Р. Э. Лекок де Буабодраном в 1875 г. Свойства галлия почти полностью совпали со свойствами экаалюминия, предсказанными Д, И. Менделеевым на основе периодического закона.
Соединения галлия с элементами VI группы (серой, селеном, теллуром) являются полупроводниками. Жидким галлием наполняют высокотемпературные термометры.
Индий был открыт Т. Рихтером и Ф. Райхом в 1863 г. Содержание его в земной коре составляет 2,5·10-5 %. Добавка индия к сплавам меди увеличивает устойчивость последних к действию морской воды. Присадка этого металла к серебру увеличивает блеск серебра и препятствует его тускнению на воздухе. Индиевые покрытия предохраняют металлы от коррозии. Он входит в состав некоторых сплавов, применяющихся в стоматологии, а также некоторых легкоплавких сплавов (сплав индия, висмута, свинца, олова и кадмия плавится при 47 °С). Соединения индия с различными неметаллами обладают полупроводниковыми свойствами.
Таллий был открыт У. Круксом в 1861 г. Содержание его в земной коре составляет 10-4 %. Сплав таллия (10 %) с оловом (20 %) и свинцом (70 %) обладает очень высокой кислотоупорностью, он выдерживает действие смеси серной, соляной и азотной кислот. Таллий повышает чувствительность фотоэлементов к инфракрасному излучению, исходящему от нагретых предметов. Соединения таллия весьма ядовиты и вызывают выпадение волос.
Галлий, индий и таллий относятся к рассеянным элементам. Содержание их в рудах, как правило, не превышает тысячных долей процент [3].
ХИМИЧЕСКИЕ СВОЙСТВА БОРА. ПРИМЕНЕНИЕ
Твердый, хрупкий, блестяще-чёрный полуметалл.
Химически бор при обычных условиях довольно инертен взаимодействует активно лишь с фтором, причем кристаллический Бор менее активен, чем аморфный.

С повышением температуры активность бора возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700°С Бор горит красноватым пламенем, образуя борный ангидрид B2O3 - бесцветную стекловидную массу.
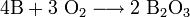
При нагревании выше 900 °С бор с азотом образует нитрид бора BN, при нагревании с углем -карбид бора B4C3, с металлами - бориды.
С водородом бор заметно не реагирует; его гидриды (бороводороды) получают косвенным путем. При температуре красного каления бор взаимодействует с водяным паром:
2B + 3Н2О = B2O3 + 3H2.
Бор реагирует только с горячей азотной, серной кислотой и в царской водкой, с образованием борной кислоты H3BO3.
Медленно растворяется в концентрированных растворах щелочей с образованием боратов.
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:


Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
Применение.
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Соединения бора.
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2-) Технический продукт содержит до 10,4% «активного кислорода», на их основе производят отбеливатели, «не содержащие хлор» («персиль», «персоль» и др.).
Отдельно также стоит указать на то что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме нитрида углерода, алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (H3BO3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде, применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путем изменения ее концентрации в теплоносителе - так называемое «борное регулирование».
Бороводороды и борорганические соединения
Ряд органических производных бора (бороводороды) являются чрезвычайно эффективными ракетными топливами (диборан(B2H4), пентаборан, тетраборан и др.), а некоторые полимерные соединения с водородом и углеродом являются чрезвычайно стойкими к химическим воздействиям и высоким температурам, например широко известный пластик Карборан-22.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)•10 – 4% бора, в костной ткани (1,1—3,3)•10 – 4%, в крови— 0,13мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза— 4г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...