
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Объяснение закономерностей линейчатого спектра атома водорода.
Вытекающая из теории Бора дискретная структура энергетических уровней электрона в атоме позволяет объяснить закономерности в спектре излучения атома водорода. Из опыта известно, что спектр теплового излучения невзаимодействующих атомов имеет дискретный характер в виде совокупности отдельных спектральных линий, которые определенным образом упорядочены в некоторые группы, называемые сериями. Такая сериальная упорядоченность спектра излучения атома водорода описывается обобщенной формулой Бальмера:
 , где
, где  и
и  - постоянные Ридберга:
- постоянные Ридберга:  ,
,
n - номер спектральной серии; n = 1, 2, 3 …
m - номер спектральной линии в серии; m = n + 1, m + 2 …
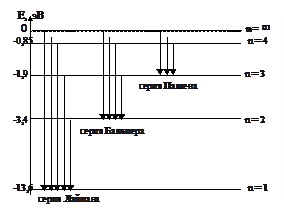
При n = 1; n =  (1 – 1/m2), где m = 2, 3, 4 … - серия Лаймана – лежит в ультрафиолетовом диапазоне.
(1 – 1/m2), где m = 2, 3, 4 … - серия Лаймана – лежит в ультрафиолетовом диапазоне.
n = 2; n =  (1/22 – 1/m2), где m = 3, 4, 5… - серия Бальмера – первые четыре ее линии лежат в
(1/22 – 1/m2), где m = 3, 4, 5… - серия Бальмера – первые четыре ее линии лежат в
видимой области спектра.
 n = 3; n =
n = 3; n =  (1/32 – 1/m2), где m = 4, 5, 6 … - серия Пашена – лежит в инфракрасной области.
(1/32 – 1/m2), где m = 4, 5, 6 … - серия Пашена – лежит в инфракрасной области.
Наглядное представление механизма образования сериально упорядоченного линейчатого спектра атома водорода дано на схеме.
Теория Бора позволяет просто получить и саму обобщенную формулу Бальмера. Выразим из правила частот Бора  частоту n излучения:
частоту n излучения:
 и, подставив в нее выражение для энергии:
и, подставив в нее выражение для энергии:  получим:
получим:

Сравнивая с формулой Бальмера, видим, что постоянная Ридберга  образуется набором фундаментальных физических констант:
образуется набором фундаментальных физических констант:  при Z = 1. Подставляя их значения, получим для
при Z = 1. Подставляя их значения, получим для  значение
значение  , совпадающее с известным из опыта.
, совпадающее с известным из опыта.
Формулу Бальмера часто записывают не для частоты n, а для обратной длины волны 1/l.
Из n = с/l Þ 1/l = n/с = (  /с)(1/n2 – 1/m2) = R(1/n2 – 1/m2), где R =
/с)(1/n2 – 1/m2) = R(1/n2 – 1/m2), где R =  /с =
/с =  .
.
Спектральная линия с наибольшей длиной волны в данной серии называется ее головной линией, а с наименьшей длиной волны – границей серии.
Формула Бальмера оказывается применимой для так называемых водородоподобных атомов. К ним относят ионизованные атомы, имеющие один электрон, например, однократно ионизованный атом гелия Не+ (Z = 2) и двухкратно ионизованный атом лития Li++ (Z = 3).
Ограниченность теории Бора.
Теория Бора была первым серьезным шагом на пути внедрения квантовых идей в физику вещественного состояния материи. Она позволила вывести характер спектра излучения простейшего атома – водорода, но была не в состоянии предсказать распределение интенсивностей в этом спектре, а также рассчитать спектр более сложных, чем водород атомов. Такая ограниченность теории Бора объяснялась ей внутренней непоследовательностью, паллиативностью (половинчатостью). Здесь был сделан лишь один, первый “квантовый шаг”, который вскрыл плодотворность квантовой гипотезы и необходимость ее более полного воплощения в теории. Оно было последовательно осуществлено в рамках новой фундаментальной физической теории – квантовой механики.
В квантовой механике был найден такой формально - математический аппарат, из которого квантованность (дискретный спектр) мер движения частицы получалась как следствие определенных условий движения и взаимодействия, а не вводилась “вручную”, постулативно, как это вначале было осуществлено Н. Бором.
Развитие теории Бора.
Плодотворная идея квантования движения частиц и мер этого движения применительно к электрону в атому водорода вводилась в теории Бора в очень ограниченном виде. Единственное квантовое число n определяло радиус rn круговой орбиты электрона в атоме, а вместе с ним сразу и момент импульса электрона: 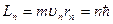 и энергию:
и энергию:  . Дальнейшее обобщение теории атома, движения электрона в нем, было проведено Зоммерфельдом. Он предположил, что орбиты могут быть в общем случае эллиптическими и по-разному ориентироваться в пространстве. Если у Бора круговая орбита в заданной плоскости расположения (плоский случай) имела всего одну степень свободы – ее радиус, то эллипс в пространстве имеет 3 степени свободы: большую и малую полуоси и угол наклона плоскости орбиты к некоторому заданному направлению. Поэтому в общем случае пространственные эллиптические орбиты должны отбираться по трем параметрам. Правило отбора таких орбит носят название правил Бора - Зоммерфельда. Их аналитический вид – следующий:
. Дальнейшее обобщение теории атома, движения электрона в нем, было проведено Зоммерфельдом. Он предположил, что орбиты могут быть в общем случае эллиптическими и по-разному ориентироваться в пространстве. Если у Бора круговая орбита в заданной плоскости расположения (плоский случай) имела всего одну степень свободы – ее радиус, то эллипс в пространстве имеет 3 степени свободы: большую и малую полуоси и угол наклона плоскости орбиты к некоторому заданному направлению. Поэтому в общем случае пространственные эллиптические орбиты должны отбираться по трем параметрам. Правило отбора таких орбит носят название правил Бора - Зоммерфельда. Их аналитический вид – следующий:
 , где pi и qi – обобщенные импульс и координата электрона, вращающегося вокруг ядра в атоме, i = 1, 2, 3,… N; N – число степеней свободы (для эллипса в пространстве N = 3). Величина S, представляющая собой произведение импульса на координату, называется в механике действием. Эта величина оказывается дискретной, то есть существует наименьшая порция этой величины, выражаемая постоянной Планка
, где pi и qi – обобщенные импульс и координата электрона, вращающегося вокруг ядра в атоме, i = 1, 2, 3,… N; N – число степеней свободы (для эллипса в пространстве N = 3). Величина S, представляющая собой произведение импульса на координату, называется в механике действием. Эта величина оказывается дискретной, то есть существует наименьшая порция этой величины, выражаемая постоянной Планка 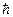 .
.
Из обобщенных правил квантования орбит электрона в атоме вытекает наличие трех квантовых чисел n, l, ml, определяющих форму эллиптической орбиты и ее ориентацию в пространстве. Могут быть разные варианты этих трех квантовых чисел. Обычно, n = 1, 2, 3,… - главное квантовое число, определяющее в наглядной полуклассической модели большую полуось эллиптической орбиты, а вместе с ней и полную энергию электрона на соответствующей орбите:  .
.
l = 0, 1, 2, … (n - 1) – орбитальное (или азимутальное, или побочное) квантовое число, определяет форму (сжатость) эллипса, т. е. его малую полуось. Для одного значения n может быть n разных значений числа l, которое определяет собой момент импульса L электрона по формуле:  .
.
Состояния с n = 0, n = 1, n = 2… принято обозначать, соответственно, s, р, d - состояниями.
ml = 0, ± 1, ± 2, ± 3,…, ± 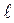 - итого 2l + 1 значений числа ml, называемого магнитным и определяющего ориентацию эллиптической орбиты в пространстве или, иначе – проекцию Lz – момента импульса L на некоторое выделенное направление z. Это квантование называется пространственным. В траекторно - орбитальной модели Бора - Зоммерфельда оно выделяет определенные углы наклона a орбиты к заданному направлению z. Обычно таким направлением является направление внешнего магнитного поля. Вращающийся вокруг ядра в атоме электрон представляет собой виток с током, т. е. магнитный диполь, характеризуемый магнитным моментом
- итого 2l + 1 значений числа ml, называемого магнитным и определяющего ориентацию эллиптической орбиты в пространстве или, иначе – проекцию Lz – момента импульса L на некоторое выделенное направление z. Это квантование называется пространственным. В траекторно - орбитальной модели Бора - Зоммерфельда оно выделяет определенные углы наклона a орбиты к заданному направлению z. Обычно таким направлением является направление внешнего магнитного поля. Вращающийся вокруг ядра в атоме электрон представляет собой виток с током, т. е. магнитный диполь, характеризуемый магнитным моментом  = I×S
= I×S  ,
,  где
где  - вектор единичной нормали к плоскости орбиты электрона. Значение рм для электрона в атоме равно:
- вектор единичной нормали к плоскости орбиты электрона. Значение рм для электрона в атоме равно:
рм = IS = qеn×pR2 = (qеu/2pr)×pr2 = qеur/2 = (qе/2mе)×mеur = (qе/2mе)×L,
где L = mеur - момент импульса электрона в атоме.
Величина, равная отношению магнитного и механического моментов g = рм/L называется гиромагнитным отношением, и для электрона в атоме она равна: gе = qе/2mе. Подставляя в выражение для рм квантовое значение механического момента  , получим: рм = (qе/2mе)×
, получим: рм = (qе/2mе)×  = mБ
= mБ  , где mБ = qе
, где mБ = qе 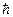 /2mе – магнетон Бора, своего рода квант магнитного момента электрона в атоме.
/2mе – магнетон Бора, своего рода квант магнитного момента электрона в атоме.
Взаимодействие электрона с магнитным полем определяется ориентацией его магнитного момента  относительно вектора напряженности
относительно вектора напряженности  магнитного поля. Эта ориентация, а с нею
магнитного поля. Эта ориентация, а с нею
и наклон орбиты электрона к вектору  (и к оси z), не могут быть любыми, произвольными.
(и к оси z), не могут быть любыми, произвольными.
 Итак, магнитное квантовое число ml определяет дискретные, квантованные значения проекции Lz момента импульса на некоторое выделенное (обычно внешним магнитным полем) направление z: Lz = ml
Итак, магнитное квантовое число ml определяет дискретные, квантованные значения проекции Lz момента импульса на некоторое выделенное (обычно внешним магнитным полем) направление z: Lz = ml 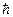 . На рисунке представлена ситуация пространственного квантования для d – состояния электрона в атоме, то есть для l = 2.
. На рисунке представлена ситуация пространственного квантования для d – состояния электрона в атоме, то есть для l = 2.
Одному значению главного квантового числа n, определяющего
собой значение энергии частицы, соответствует n значений орбитального (побочного) квантового числа l, определяющего значение момента импульса частицы с заданной энергией. Для каждого значения l может быть 2l + 1 значений ml - магнитно-квантового числа определяющего собой значения проекции момента импульса на некоторое направление. Такие состояния частицы, которые обладают одинаковой энергией, но описываются различным набором квантовых чисел, называются вырожденными. По орбитальному числу кратность вырождения равна n, по магнитному 2l + 1, а по тому и другому – n2. Вырождение состояний может сниматься (устраняться). Так, при помещении атома во внешнее магнитное поле, энергия электрона будет зависеть не только от n, но и от l, т. е. от ориентации орбиты (магнитного момента) вращающегося электрона относительно направления вектора  - напряженности магнитного поля.
- напряженности магнитного поля.
В 1925 г. Гаудсмитом и Уленбеком было предположено, что состояние электрона в атоме
помимо трех, “внешних” квантовых чисел, характеризуется еще и четвертым – “внутренним” квантовым числом s. Это число, называемое спиновым (spin – с английского – веретено), определяет дополнительный к орбитальному, собственный, внутренний момент импульса электрона, уподобляя его как бы вращающемуся волчку. Но такая механическая аналогия вступает в противоречие с постулатом специальной теории относительности о предельности скорости света, и потому сейчас отвергается. Значение собственного (спинового) момента импульса определяется как:  ; s = 1/2 – спиновое квантовое число, отражающее четвертую, внутреннюю степень свободы микрочастицы.
; s = 1/2 – спиновое квантовое число, отражающее четвертую, внутреннюю степень свободы микрочастицы.
По аналогии с пространственным квантованием орбитального механического момента L, проекция спинового момента LS на некоторое выделенное направление z также квантуется, то есть может принимать лишь дискретные значения. Для спинового момента импульса таких значений его проекции всегда два:  , где
, где 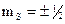 , т. е.
, т. е.  . Это соответствует ориентации спинового момента по и против направления Z внешнего поля.
. Это соответствует ориентации спинового момента по и против направления Z внешнего поля.
В теории Бора - Зоммерфельда состояние электрона в атоме полностью задается, определяется тремя квантовыми числами. Такой подход существенно расширил предсказательные возможности теории по сравнению с первоначальной теорией Бора с одним-единственным квантовым числом. Однако слабым местом в подходе Бора – Зоммерфельда была искусственность введения в теорию квантовых чисел. Эта искусственность была снята в более общей теории движения микрочастиц - квантовой механике. В ней устраняется понятие орбит (траекторий).
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...