
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Атомного ядра и элементарных частиц»
Приборостроения и информатики
Беланов А. С.
Физика
Часть IV
«Молекулярная физика и термодинамика»
«Элементы физики твердого тела, физики
Атомного ядра и элементарных частиц»
Методическое пособие
Москва, 2003
УДК 53
Утверждено Ученым советом МГАПИ
28.10.2002г., протокол №10 в качестве учебного пособия
Рецензент – доцент, к.ф.-м.н. Попова Т. В.
Учебное пособие предназначено для студентов МГАПИ,
изучающих физику в течении 4-х семестров
Издательство МГАПИ
Физика, часть IV
В заключительной, четвертой части курса физики будет изучаться молекулярная физика и термодинамика, физика твердого тела и физика атомного ядра и элементарных частиц.
I. Молекулярная физика и термодинамика
Молекулярная физика и термодинамика изучают один и тот же круг явлений, а именно макроскопическиепроцессы в телах, т.е. такие явления, которые связаны с колоссальным количеством содержащихся в телах атомов и молекул. Но эти разделы физики, взаимно дополняя друг друга, отличаются различными подходами к изучаемым явлениям.
Последующее изучение молекулярной физики и термодинамики продемонстрирует эти подходы.
Лекция 1,2. Молекулярно-кинетическая теория
Уравнение состояния идеального газа
Простейшим объектом, для которого может быть получено уравнение состояния, является идеальный газ.
Идеальным называется газ, молекулы которого имеют пренебрежимо малый собственный объем и не взаимодействуют друг с другом на расстоянии.
Оказывается при нормальных условиях, т.е. давлении Р0=1.013×105Па (что эквивалентно 760 мм ртутного столба или одной физической атмосфере) и температуре Т0=273.15 К (t=0° C) многие газы (Н2, О2, N2, воздух и др.) можно считать с хорошим приближением идеальными. В самом деле, учитывая, что эффективные диаметры d молекул различных газов имеют величины порядка 10-10 м и при нормальных условиях концентрация молекул n=N/V  1025 м-3, то среднее расстояние между молекулами <r>
1025 м-3, то среднее расстояние между молекулами <r> 
 »10-8 м, т.е. столь велики по сравнению с d=10-10 м,что силами притяжения можно пренебречь. Суммарный собственный объем всех N
»10-8 м, т.е. столь велики по сравнению с d=10-10 м,что силами притяжения можно пренебречь. Суммарный собственный объем всех N  1025 молекул, содержащихся в 1 м3, Npd3/6≈10-5 м3 << 1 м3. Следовательно, собственным объемом молекул газа тоже можно пренебречь.
1025 молекул, содержащихся в 1 м3, Npd3/6≈10-5 м3 << 1 м3. Следовательно, собственным объемом молекул газа тоже можно пренебречь.
Таким образом, многие газы можно считать с хорошим приближением идеальными.
Опытным путем было установлено, что при обычных условиях параметры состояния газов подчиняются уравнению Клапейрона
РV/T=B=const. (1)
Оказалось также, что чем разреженнее газ, тем точнее выполняется это уравнение. Идеальный газ строго подчиняется уравнению (1), которое, следовательно, является уравнением состояния идеального газа.
Согласно закону Авогадро, при нормальных условиях, т.е. при температуре t=0° C (Т0=273.15 К) и давлении одна физическая атмосфера (Р0=1.013×105Па) объем моля любого газа равен V0=22.4 л/моль=22.4×10-3 м3/моль.(Напомним, что единицей количествавещества в СИ является моль. Один моль любого газа содержит одно и то же число молекул NA=6.02×10 23 моль-1, называемое постоянной Авогадро. Массу моля обозначают буквой М). Если m0 - масса одной молекулы, то масса моля или молярная масса
М=m0NA. (2)
Масса моля вещества, выраженного в граммах, численно равна молекулярной массе этого вещества. Например, для кислорода О2 M=32∙10-3 кг/моль, для азота N2 M=28∙10-3 кг/моль. Подставляя эти значения в (1) и обозначая константу В для одного моля буквой R, находим
R= Р0V0/T0=1.013×105×22.4×10-3/273.15=8.31 Дж/моль×К. (3)
Константу R называют универсальной газовой постоянной.
Тогда средняя длина свободного пробега молекул
<l>=<v>Dt/<z>=1/(  pd2n), (37)
pd2n), (37)
т.е. обратно пропорциональна концентрации молекул (или давлению P т. к., Р=nkT). Можно показать, что при нормальных условиях < l > ≈ 10-7 м и число столкновений за 1 секунду < z> /Dt≈1010 c-1.
Лекция 3. Явления переноса
До сих пор мы рассматривали исключительно равновесные системы, характеризующиеся при постоянных внешних условиях неизменностью параметров (Р, V, T, ) во времени и отсутствием в системе потоков вещества, энергии, импульса.
Однако, беспорядочность теплового движения молекул газа, непрерывные столкновения между ними приводят к постоянному перемешиванию частиц и изменению их скоростей и энергий. Если в газе существует пространственная неоднородность плотности, температуры, скорости упорядоченного перемещения отдельных слоев, то происходит самопроизвольное выравнивание этих неоднородностей. В газе возникают потоки вещества, энергии, импульса упорядоченного движения молекул.
Эти потоки, характерные для неравновесных состояний газа, являются физической основой особых процессов, объединенных общим названием ”явления переноса ”. К этим явлениям относятся диффузия, теплопроводность и внутреннее трение. Для простоты ограничимся одномерными явлениями переноса. Систему отсчета выберем так, чтобы ось х была ориентирована в направлении переноса
Диффузия

|
Это перенос массы из мест с большей плотностью r к местам с меньшей плотностью.
Фик (1855 г) установил, что перенесенная масса dm через расположенную перпендикулярно направлению переноса вещества площадку dS^за время dt
dm= - D(dr/dx) dS^dt,(1)
где dr/dx характеризует скорость изменения плотности rна единицу длиныx,
D – коэффициент диффузии.
Можно показать, что для газов  . (2)
. (2)
Знак минус в (1) указывает, что перенос массы при диффузии происходит в направлении убывании плотности, т. е. вдоль оси ох, если r2>r1 (dr/dx<0).

|
Теплопроводность
Это перенос теплоты (внутренней энергии) от более нагретых мест к менее нагретым. Фурье (1822 г.) установил, что количество теплоты  , которое переносится вследствие теплопроводности через площадку dS^за время
, которое переносится вследствие теплопроводности через площадку dS^за время 
dQ= -c(dT/dx) dS^dt, (3)
где  характеризует скорость изменения температуры Т на единицу длинны х,
характеризует скорость изменения температуры Т на единицу длинны х,  (греч. хи) – коэффициент теплопроводности. Можно показать, что для газов
(греч. хи) – коэффициент теплопроводности. Можно показать, что для газов
 (4)
(4)
где сV - удельная теплоемкость при постоянном объеме газа.
Знак минус в (3) указывает, что при теплопроводности перенос внутренней энергии происходит в направлении убывания температуры, т. е. вдоль оси ОХ, если 
 .
.
Внутреннее трение (вязкость)
Оно возникает между слоями жидкости или газа, движущимися упорядоченно с различными скоростями u. Из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, а движущегося медленнее – увеличивается, что приводит к торможению слоя, движущегося быстрее и ускорению слоя, движущегося медленнее.

|
Согласно закону Ньютона (1687 г) сила внутреннего трения между слоями газа (жидкости)  , (5)
, (5)
где (du/dx) характеризует быстроту изменения скорости u на единицу длины x , S – площадь, на которую действует сила (площадка S перпендикулярна х),  – коэффициент внутреннего трения (динамическая вязкость)
– коэффициент внутреннего трения (динамическая вязкость)
Можно показать, что 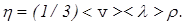 (6)
(6)
Знак минус в (5) указывает, что импульс переносится в направлении убывания скорости слоев u.
Анализ формул (2), (4), (6) показывает, что
 <l>/(hcV)=1. (7)
<l>/(hcV)=1. (7)
Используя эти формулы, можно по найденным из опыта одним величинам, определить другие.
Работа и теплота
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия закрытой системы (т.е. системы, которая не обменивается веществом с внешней средой; в 4,5 лекциях мы изучаем только закрытые системы) может изменяться качественно различными способами:
1. Путем совершения работы внешними телами над системой, например, при сжатии газа температура его повышается и, следовательно, изменяется (увеличивается) его внутренняя энергия.
2. Путем теплообмена, т.е. процесса обмена внутренними энергиями при контакте тел с различными температурами. Энергию, передаваемую от одних тел к другим в процессе теплообмена, называют теплотой.
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии. Применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Теплоемкость
Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
 , Дж/(кгК). (9)
, Дж/(кгК). (9)
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
 , Дж/(мольК). (10)
, Дж/(мольК). (10)
где n=m/M – количество молей вещества.
Из (9) и (10) следует, что С = сМ. (11)
Применение ПНТ к изопроцессам
Изохорический процесс

| Для него V=const. Диаграмма этого процесса (изохора) изображена на рис.3. Процесс 1-2 соответствует нагреванию, а процесс 2-1 – охлаждению газа. При изохорическом процессе газ не совершает работы:  =0 и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии, т.е. dQ=dU.
Согласно формуле (3) для произвольной массы газа =0 и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии, т.е. dQ=dU.
Согласно формуле (3) для произвольной массы газа  и поэтому и поэтому  , (12)
и молярная теплоемкость при постоянном объеме , (12)
и молярная теплоемкость при постоянном объеме
|
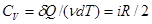 . (13)
. (13)
Таким образом,  . (14)
. (14)
Изобарический процесс

| Для него P=const. Диаграмма этого процесса (изобара) изображена на рис.4. Практически он осуществляется, например, при нагревании (процесс 1-2) или охлаждении (процесс 2-1) газа, находящегося в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление. Учитывая, что для произвольной массы газа U=(i/2)nRT, |
PV=nRT, запишем ПНТ в дифференциальной форме для изобарического процесса:
 . (15)
. (15)
Молярная теплоемкость при постоянном давлении
 . (16)
. (16)
Выражение  (17)
(17)
называется уравнением Майера; оно показывает, что CP всегда больше CV на величину универсальной газовой постоянной R. Это объясняется тем, что для нагревания газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа.
Отсюда следует, физический смысл универсальной газовой постоянной R: она численно равна работе, совершаемой одним молем идеального газа при его изобарическом нагревании на 1 К.
С учетом (16) первое начало термодинамики для изобарического процесса имеет вид  , (18)
, (18)
кроме того,  ,
,  .
.
Изотермический процесс
Для него Т-const. Например, процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ происходят при постоянной температуре, если внешнее давление постоянно.

| Для идеального газа при Т=const выполняется закон Бойля-Мариотта PV=const. Диаграмма изотермического процесса (изотерма) изображена на рис.5. Процесс 1-2 соответствует нагреванию газа, а процесс 2-1 – охлаждению его.
Внутренняя энергия идеального газа в изотермическом процессе не изменяется, т.е.  =0, так как Т=const и dT=0. Таким образом из ПНТ ( =0, так как Т=const и dT=0. Таким образом из ПНТ (  ) следует, что ) следует, что  , т.е. вся теплота, сообщаемая газу, расходуется на , т.е. вся теплота, сообщаемая газу, расходуется на
|
совершение им работы против внешних сил:
 , (19)
, (19)
где n=m/M – число молей.
Процесс 1-2 (см.рис.5) соответствует изотермическому расширению газа, в этом случае Q12>0 и A12>0. Обратный процесс 2-1 соответствует изотермическому сжатию газа, для него Q12<0 и A12<0.
Адиабатический процесс
Это процесс, при котором отсутствует теплообмен (  ) между системой и окружающей средой. К адиабатическим можно отнести все быстропротекающие процессы.
) между системой и окружающей средой. К адиабатическим можно отнести все быстропротекающие процессы.
Из ПНТ (  ) для адиабатического процесса следует, что
) для адиабатического процесса следует, что
 , (20)
, (20)
т.е. внешняя работа совершается за счет уменьшения внутренней энергии системы. Учитывая, что  , найдем работу адиабатического расширения газа от объема V1 до V2 ( при этом температура газа уменьшается от Т1 до Т2):
, найдем работу адиабатического расширения газа от объема V1 до V2 ( при этом температура газа уменьшается от Т1 до Т2):

 . (21)
. (21)
Можно показать, что для адиабатического процесса
 . (22)
. (22)
Это уравнение называют уравнением адиабаты, g=СP/CV=(i+2)/i - показатель адиабаты, i – число степеней свободы молекулы газа.
|
изотерма, уравнение которой PV=const. Процесс 3-1-2 соответствует адиабатическому расширению газа. В этом случае  , dU<0. Обратный процесс 2-1-3 соответствует адиабатическому сжатию газа. В этом случае
, dU<0. Обратный процесс 2-1-3 соответствует адиабатическому сжатию газа. В этом случае  , dU>0.
, dU>0.
Круговые процессы (циклы)
Процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние называется круговым процессом или циклом. На диаграмме процессов цикл изображается замкнутой кривой (рис.7).

| Цикл можно разбить на процесс расширения 1-2 и сжатия 2-1. Работа расширения, которая определяется площадью фигуры 1а2V2V11, положительна, т.к. dV>0. Работа сжатия, которая определяется площадью фигуры 2b1V1V22, отрицательна, т.к. dV<0. Следовательно, работа, совершаемая газом за цикл определяется площадью, |
охватываемой замкнутой кривой.
Если за цикл совершается положительная работа  (цикл протекает по ходу часовой стрелки), то он называется прямым (рис.7,а). Если за цикл совершается отрицательная работа
(цикл протекает по ходу часовой стрелки), то он называется прямым (рис.7,а). Если за цикл совершается отрицательная работа  (цикл протекает против хода часовой стрелки), то он называется обратным (рис.7,б). В случае обратного цикла внешние тела совершают над газом положительную работу – работу по сжатию газа А¢. Газ в этом случае совершает отрицательную работу А=-А¢.
(цикл протекает против хода часовой стрелки), то он называется обратным (рис.7,б). В случае обратного цикла внешние тела совершают над газом положительную работу – работу по сжатию газа А¢. Газ в этом случае совершает отрицательную работу А=-А¢.
Прямой цикл используется в тепловых двигателях – периодически действующих двигателях, совершающих работу за счет получения извне теплоты.
Обратный цикл используется в холодильных машинах – периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа DU равно нулю. Поэтому ПНТ (4) для кругового процесса: Q=DU+A=А, т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако, в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому A=Q1-Q2, где Q1- количество теплоты, полученное системой, Q2- количетво теплоты, отданное системой. Коэффициент полезного действия для кругового процесса
h=А/Q=( Q1-Q2)/ Q1= 1- Q2/Q1 . (23)
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении и при этом система возвращается в исходное состояние и в окружающей среде и в этой системе не происходит никаких изменений. Например, незатухающие колебания. Заметим, что равновесные процессы называют также обратимыми.
Всякий процесс, не удовлетворяющий этим условиям, называется необратимым.(Заметим, что все процессы, сопровождающиеся трением, являются необратимыми).
Цикл Карно
В 1824 г. французский физик и инженер Н. Карно (1796-1832) опубликовал единственную работу, в которой теоретически проанализировал обратимый наиболее экономичный цикл, состоящий из двух изотерм и двух адиабат. Его называют циклом Карно, в котором в качестве рабочего тела используют идеальный газ, заключенный в сосуд с подвижным поршнем.
Цикл Карно изображен на рис.8, где изотермическое расширение и сжатие заданы соответственно кривыми 1-2 и 3-4, адиабатическое расширение и сжатие – кривыми 2-3 и 4-1.
    
| Согласно (23) КПД цикла Карно h=А/Q=( Q1-Q2)/ Q1= 1- Q2/Q1, где Q1- количество теплоты, полученное газом от нагревателя, температура которого Т1, Q2- количетво теплоты, отданное газом холодильнику, температура которого Т2. Карно показал, что для такого цикла h=(Q1-Q2)/Q1=(Т1-Т2)/Т1=1-Т2/Т1, (24) т.е. КПД определяется только температурами нагревателя и холодильника. Карно предположил, что этот результат справедлив для любых термодинамических систем. |
Обратный цикл Карно положен в основу действия тепловых насосов. Тепловые насосы должны как можно больше тепловой энергии отдавать горячему телу, например системе отопления. Большая часть этой энергии отбирается от окружающей среды с низкой температурой и меньшая часть – получается за счет механической работы, производимой, например компрессором.
Энтропия
4.10.1. Энтропия в термодинамике
При изучении ПНТ (  ) отмечалось , что dU является полным дифференциалом (из математики известно, что дифференциал dU называется полным, если интеграл
) отмечалось , что dU является полным дифференциалом (из математики известно, что дифференциал dU называется полным, если интеграл  не зависит от пути интегрирования и, в частности, интеграл по замкнутому пути или контуру L
не зависит от пути интегрирования и, в частности, интеграл по замкнутому пути или контуру L  =0), а dQ и dА не являются полными дифференциалами.
=0), а dQ и dА не являются полными дифференциалами.
Из математики также известно, что величина, на которую надо умножать некоторое выражение, чтобы оно стало полным дифференциалом, называется интегрирующим множителем. В термодинамике доказывается, что для обратимого процесса таким интегрирующим множителем является 1/Т и тогда dQ/Т будет являться полным дифференциалом некоторой пока неизвестной нам функции состояния S системы, т.е. dQ/Т=dS. (25)
Определенную таким образом функцию состояния S термодинамической системы называют энтропией, измеряется она в Дж/К. Из (25) видно, что dS и dQ имеют один и тот же знак. Это позволяет по характеру изменения энтропии судить о направлении процесса теплообмена. Понятие энтропии было введено в 1865 г. Клаузиусом.
ПНТ (8) для идеального газа произвольной массы m с учетом формул U=(i/2)nRT=nCVT, CV=(i/2)R, PV=nRT (n=m/M – число молей) принимает вид  и полный дифференциал энтропии
и полный дифференциал энтропии
dS=dQ/Т=n(CVdT/T+RdV/V) =n(CVdlnT+RdlnV) (26)
Так как для постоянной массы идеального газа PV/T=const, то
lnP+lnV-lnT=const, а dlnP+dlnV-dlnT=0 и выражение (26) можно переписать в двух эквивалентных ему формах
dS=n[(CV+R)dlnT-RdlnP]=n[CP(dT/T)-R(dP/P)], (27)
dS=n[(CV+R)dlnV+CVdlnP]=n[CP(dV/V)+CV(dP/P)]. (28)
Если система переходит из состояния 1, характеризующегося параметрами P1, V1, T1, в состояние 2, характеризующееся параметрами P2, V2, T2, то изменение энтропии согласно (26) – (28) DS=S2-S1=  =n[CVln(T2/T1) +Rln(V2/V1)]=
=n[CVln(T2/T1) +Rln(V2/V1)]=
= n[CPln(T2/T1) -Rln(P2/P1)]= n[CPln(V2/V1)+ CVln(P2/P1)] . (29)
В частности, если процесс круговой, то P2=P1, V2=V1, T2=T1, из (29) следует, что
 , (30)
, (30)
т.е. действительно dS=dQ/T является полным дифференциалом функции состояния S – энтропии.
Так как для адиабатического процесса dQ=TdS=0, то, следовательно, dS=0 и S=const. Таким образом, обратимый адиабатический процесс представляется собой изоэнтропийный процесс.
Формулы (26)-(29) позволяют построить термодинамические диаграммы T-S, см. рис.9. Пусть точка О изображает начальное состояние идеального газа, тогда
 прямая 1-1¢ соответствует изотермическому процессу (0-1 – расширение и уменьшение давления, 0-1¢ - сжатие и увеличение давления). Прямая 2-2¢ соответствует адиабатическому (изоэнтропийному) процессу (0-2 – сжатие и увеличение давления и температуры, 1-2¢ - расширение и уменьшение давления и температуры). Изохорный процесс изображен линией 3-3¢ (0-3 – нагревание и увеличение давления, 0-3¢ - охлаждение и уменьшение давления).
прямая 1-1¢ соответствует изотермическому процессу (0-1 – расширение и уменьшение давления, 0-1¢ - сжатие и увеличение давления). Прямая 2-2¢ соответствует адиабатическому (изоэнтропийному) процессу (0-2 – сжатие и увеличение давления и температуры, 1-2¢ - расширение и уменьшение давления и температуры). Изохорный процесс изображен линией 3-3¢ (0-3 – нагревание и увеличение давления, 0-3¢ - охлаждение и уменьшение давления).
Изобарический процесс изображен линией 4-4¢ , идущей положе изохоры 3-3¢ (0-4 – нагревание и расширение, 0-4¢ – охлаждение и сжатие).
Итак, энтропию S можно рассматривать как точно такой же параметр, как и три другие параметра P, V, T. Подобно тому как уравнение состояния идеального газа PV=nRT позволяет выразить, например Т, через другие параметры P и V, так и выражение (29) дает возможность выразить S через другие параметры системы P, V и Т.
4.10.2. Энтропия с кинетической точки зрения. Третье начало термодинамики
Энтропия, введенная здесь термодинамически, успешно используется при вычислениях в термодинамике.
Однако, существует и другое толкование энтропии. С кинетической точки зрения энтропию лучше всего определить как меру неупорядоченности системы. Когда мы охлаждаем систему (например, газ) при постоянном объеме, мы непрерывно извлекаем из нее тепло и, следовательно, энтропию [см.формулу (25) и ее комментарий], т.е. dQ<0 и dS<0. При этом тепловое движение, которое создает неупорядоченность, становится все менее интенсивным и упорядоченность системы повышается. Когда газ конденсируется в жидкость, молекулы занимают более определенные положения друг относительно друга, в отличие от их положения в газовой фазе. Причем скачкообразное уменьшение беспорядка соответствует скачкообразному уменьшению энтропии. При дальнейшем понижении температуры жидкости тепловое движение, которое создает неупорядоченность, становится все менее интенсивным, и происходит дальнейшее уменьшение энтропии.
Когда жидкость отвердевает, молекулы в кристалле занимают вполне определенные положения одна относительно другой, так что неупорядоченность скачком уменьшается. Соответственно при отвердевании выделяется тепло и энтропия также убывает скачком. При абсолютном нуле тепловое движение полностью прекращается, следовательно, неупорядоченность будет также равна нулю. В связи с этим энтропию всех веществ при T=0 принимают равной нулю.
Утверждение: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина, т.е.  называют третьим началом термодинамики или теоремой Нернста-Планка (1906 г, 1910 г).
называют третьим началом термодинамики или теоремой Нернста-Планка (1906 г, 1910 г).
Представление об энтропии как мере неупорядоченности системы хорошо описывает ее зависимость не только от температуры, но и от объема и других параметров системы.
4.10.3. Энтропия в равновесной статистической физике
Более глубокий смысл энтропии вскрывается в статистической физике: энтропия связывается с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы или число микросостояний, осуществляющих данное макросостояние. По определению W³1 , т.е. термодинамическая вероятность не есть верояность Р в математическом смысле (Р£1).
Например, макросостояние моля кислорода, соответствующее Р=1 физической атмосфере и Т=300К, может быть осуществлено числом микросостояний W=  . Представить себе это число совершенно невозможно.
. Представить себе это число совершенно невозможно.
Больцман в 1872 г. показал, что энтропия системы и термодинамическая вероятность связаны между собой следующей формулой
S=klnW, (31)
где k – постоянная Больцмана. Для выше приведенного примера S=200 Дж/К.
Уравнение Ван-дер-Ваальса (ВдВ)
В научной литературе существуют более 150 отличающихся друг от друга уравнений состояния реального газа. Среди них нет ни одного действительно верного и универсального.
Остановимся на уравнении ВдВ (1873 г). Он внес в уравнение Клапейрона-Менделеева PV=RT две поправки.
Первая поправка связана с действием сил отталкивания между молекулами. Она учитывает собственный объем молекулы V0 и поэтому объем сосуда V заменяют свободным объемом V-b, где b=4V0NA. В итоге получаем уравнение Клаузиуса для одного моля
P=RT/(V-b). (1)
Вторая поправка связана с действием сил притяжения между молекулами: в тонком поверхностном слое вблизи стенки сосуда на молекулу, подлетающую к стенке, действует сила притяжения со стороны остальных молекул газа, что приводит к уменьшению силы удара молекулы о стенку сосуда, а, следовательно, и давления на величину DP~  , в результате имеем P=RT/(V-b) – a/
, в результате имеем P=RT/(V-b) – a/  или
или
(P+ a/  )(V-b)=RT, (2)
)(V-b)=RT, (2)
которое называют уравнением ВдВ для одного моля газа. В этом уравнении а и b – постоянные, зависящие только от вида газа.
Для произвольной массы газа уравнение ВдВ имеет вид
(P+  a/
a/  )(V-nb)= nRT, (3)
)(V-nb)= nRT, (3)
где n=m/M – число молей газа, m – масса газа, M – масса моля.
Изотермы Ван-дер-Ваальса
Для фиксированных значений Р и Т уравнение (2) есть уравнение третьей степени относительно объема газа V и, следовательно, оно может иметь либо три вещественных корня (V1, V2, V3), либо один вещественных корень (V1) и два комплексно-сопряженных корня (комплексно-сопряженные корни отбрасываем). Поэтому на диаграмме PV (см.рис.2) прямая, параллельная оси V может пересекать изотерму ВдВ либо в трех точках В, D, F, либо в одной K или L. Построение по точкам изотерм ВдВ для трех характерных температур приводит к кривым, изображенным на рис.2. Сначала проведем анализ нижней изотермы ABCDEFG.
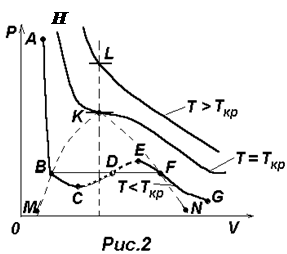 Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Левая, круто спадающая часть ее АВ соответствует жидкому состоянию, правая пологая часть FG – газообразному. Переход из жидкого состояния в газообразное и обратно при обычных условиях происходит не вдоль участка ВСDEF, а вдоль изобары BF, которая одновременно является и реальной изотермой. Такой изобаре-изотерме BF соответствуют двухфазные состояния вещества – жидкость + газ (пар). Чем ближе к точке В, тем больше жидкости, и чем ближе к точке F–тем больше в системе пара (газа). Заметим, что пар и газ – это одно и то же. Когда говорят о паре какой-либо жидкости, то этим желают подчеркнуть, что речь идет о газе, полученном испарением этой жидкости.
Ветви ВС и EF изображают метастабильные состояния вещества (т.е. относительно устойчивые состояния): перегретую жидкость и пересыщенный пар и могут быть осуществлены при определенных условиях. Участок СДЕ ни при каких условиях осуществлен быть не может.
 С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
С ростом температуры область горбов и впадин на изотерме ВдВ уменьшается и при температуре ТКР – критической температуре – превращается в точку перегиба К с горизонтальной касательной. В точке К исчезают различия между жидкой и газообразной фазой (однородная среда).
При Т>ТКР газ никаким сжатием нельзя перевести в жидкость.
Возвращаясь к анализу изотерм ВдВ, изображенных на рис.2, делаем заключение, что область, ограниченная сверху изотермой НК и справа линией КВМсоответствует жидкой фазе. Область, ограниченная сверху кривой МВКFN, соответствует жидкой и газообразной фазе (жидкость + пар) и область, расположенная правее линии НКFN, соответствует газообразной фазе.
При Т>>ТКР и относительно малых давлениях реальные газы ведут себя как идеальные газы.
Внутренняя энергия моля реального газа
U=CVТ –a/V, (4)
т.е. меньше энергии идеального газа U=CVТ. Для произвольной массы реального газа
U=n(CVТ –a/V). (5)
Фазы и фазовые переходы
Фазой называется совокупность частей системы одинаковых по всем физическим, химическим свойствам и структурному составу. Например, существует твердая, жидкая и газообразная фазы (называемые агрегатными состояниями).
Фазовый переход (фазовое превращение), в широком смысле – переход вещества из одной фазы в другую при изменении внешних условий (Т, Р, магнитных и электрических полей и т.д.); в узком смысле – скачкообразное изменение физических свойств при непрерывном изменении внешних параметров. Будем далее рассматривать фазовые переходы в узком смысле.
Различают фазовые переходы I рода и II рода. Фазовый переход I рода – широко распространенное в природе явление. К ним относятся: испарение и конденсация, плавление и затвердевание, сублимация или возгонка (переход вещества из кристаллического состояния непосредственно, без плавления, в газообразное, например, сухой лед) и конденсация в твердую фазу и др. Фазовые переходы I рода сопровождаются выделением или поглощением теплоты (теплоты фазового перехода q), при этом скачком изменяются плотность, концентрация компонентов, молярный объем и т.д.
Фазовый переход II рода не сопровождается выделением или поглощением теплоты, плотность изменяется непрерывно, а скачком изменяется, например, молярная теплоемкость, удельная электрическая проводимость, вязкость и др. Примерами фазовых переходов II рода могут служить переход магнитного вещества из ферромагнитного состояния (m>>1) в парамагнитное (m»1) при нагреве до определенной температуры, называемой точкой Кюри; переход некоторых металлов и сплавов при низких температурах из нормального состояния в сверхпроводящее и др.
Элементы квантовой статистики
Дуализм (двойственность) волн и частиц относится к числу фундаментальных концепций современной физики. В кристаллах имеется много полей, которые проявляют оба эти аспекта - и волновой, и корпускулярный. Кванты энергий таких полей получили собственные названия. Подобно тому как фотон описывает корпускулярные свойства электромагнитного поля, термины фонон, магнон, плазмон, полярон и экситон описывают некоторые квантовые поля в кристалле. Фононы, магноны, плазмоны, поляроны и экситоны ведут себя почти как частицы и называются квазичастицы. В отличие от реальных частиц, которые существуют как в среде, так и в вакууме, квазичастицы существуют лишь только в среде. Итак, твёрдые тела состоят из огромного числа как частиц (молекул, атомов, ядер атомов, протонов, нейтронов, электронов и т. д.), так и квазичастиц. Кроме того в твёрдых телах распространяются электромагнитные поля в виде огромного числа частиц - фотонов.
Поведение этих частиц и квазичастиц описывается с использованием статистических методов, аналогично тому, как описывалось поведение молекул идеального газа в лекциях 1,2.
Напоминаем, что задача статистики - указать распределение частиц по энергии Е, импульса Р .... Зная функцию распределения f(Е) и f(Р)..., можно вычислить средние физические величины, характеризующие состояние системы в целом. В зависимости от условий частицы системы подчиняются законам либо классической физики (лекции 1,2), либо квантовой физики. Соответственно различаются классическая и квантовая статистики. У классических частиц параметры изменяются непрерывно. Поэтому в классической статистике f(x)dx указывает число частиц (или долю частиц), параметр х которых лежит в интервале от х до х+dx. В классической статистике тождественные, т. е. одинаковые по своим физическим свойствам, частицы различимы по нахождению в пространстве, импульсам... Квантовые статистики отличаются от классических из-за того, что в них частицы подчиняются квантовым законам: параметры частиц квантуются, т. е. принимают только дискретные значения и квантовые закономерности имеют всегда вероятный характер. В квантовой физике существует важное положение о принципиальной неразличимости тождественных частиц.
Примесные полупроводники
9.6.1. Донорная примесь, полупроводники n-типа
Введение в полупроводник примесей сильно влияет на его электрические свойства. Рассмотрим, например, что произойдет, если в решетке германия (Ge - четыре
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...