
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Подписано в печать 06.10.2009. Формат 60х90 1/16.
Методические указания
к выполнению лабораторных работ по химии
для студентов всех специальностей очной формы обучения
Составители: Л. М. Васильченко
Г. Б. Сеницкая
А. В. Халикова
В. М. Яковлев
Н. В. Сотова
Самара
| |
УДК 546
Методические указания к выполнению лабораторных работ по химии для студентов всех специальностей очной формы обучения. – Самара : СамГУПС, 2009. – 46 с.
Утверждены на заседании кафедры ОИХ, протокол № 9 от 09.04.2009 г.
Печатаются по решению редакционно-издательского совета университета.
Методические указания содержат описания лабораторных работ по курсу общей химии для студентов очной формы обучения всех специальностей. Лабораторные работы содержат необходимые теоретические сведения и формулы для выполнения расчетных заданий, а также правила техники безопасности для каждой конкретной работы.
Составители: Васильченко Лидия Михайловна
Сеницкая Галина Борисовна
Халикова Алла Викторовна
Яковлев Виктор Михайлович
Сотова Наталья Васильевна
Рецензенты: к.х.н., доцент СамГУ Е. А. Колосова;
к. ф.-м.н., доцент СамГУПС Х. Д. Ламажапов
Редактор И.М.Егорова
Компьютерная верстка Е. А. Ковалева
Подписано в печать 06.10.2009. Формат 60х90 1/16.
Усл. печ. л. 2,9 Тираж 250 экз. Заказ № 183.
| |
Введение
Настоящие указания, написанные коллективом кафедры общей и инженерной химии, представляют собой сборник лабораторных работ по общей химии, составленный в соответствии с Государственным образовательным стандартом высшего профессионального образования от 14 апреля 2000 года. Методические указания содержат описания лабораторных работ. Каждая работа включает теоретическую и практическую часть. Теоретическая часть содержит в сжатой форме основные сведения и расчетные формулы по теме лабораторной работы и предназначена для того, чтобы студенты сделали нужные выводы об изучаемых химических явлениях и процессах.
Практическая часть содержит описание опытов, проводимых полумикрометодом.
Студенты приступают к работе после предварительного обсуждения с преподавателем практического хода работы и содержания выводов, которые надлежит сделать после выполнения данной работы.
Лабораторная работа №1
ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА И ЭКВИВАЛЕНТНОЙ МАССЫ МЕТАЛЛА
ПО ВОДОРОДУ
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами. Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль ─ это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02·1023). Например: 3·1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль.
Эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВr, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
 , (1)
, (1)
где m (V) ─ массы (объемы) реагирующих веществ;
Э (Vэкв.) ─ эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
 ,
,
где 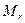 ─ мольная масса атома элемента,
─ мольная масса атома элемента,
В ─ валентность элемента.
Так например, эквивалентные массы водорода и кислорода соответственно равны:

Эквивалентный объем газа можно вычислить по формуле:
 .
.
Так например, эквивалентные объемы водорода и кислорода соответственно равны:
 .
.
Эквивалентные массы сложных веществ можно вычислить по формулам:
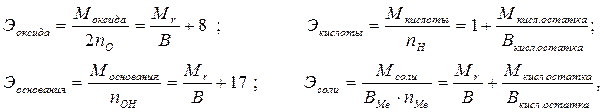 (2)
(2)
где nO, nOH, nH, nMe – число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли;
В – валентность;
8 – эквивалентная масса кислорода;
1 – эквивалентная масса водорода;
17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:
 (3)
(3)
затем по формуле (1) определяют эквивалентную массу.
Прибор для определения эквивалента металла состоит из бюретки 1, соединенной резиновыми трубками, снабженными зажимом 4, с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.

Рис.1.1. Прибор для определения эквивалента металла
Практическая часть
Реактивы и посуда
Прибор для определения эквивалента металла (рис.1.1), барометр, термометр, мерный цилиндр емкостью 10 мл, воронка, 10%-ный раствор соляной кислоты, металлический магний.
1. В одно колено пробирки 3 внесите магний, а в другое колено пробирки через воронку налейте около 12 мл 10%-ного раствора соляной кислоты. Наденьте двухколенную пробирку на пробку, соединенную резиновой трубкой с бюреткой.
2. Необходимым условием протекания опыта является герметичность всей системы, поэтому проверьте прибор на герметичность. Для этого воронку 2 опустите или поднимите на 25─30 см и держите на одном уровне 1─2 минуты. Если уровень воды в бюретке 1 не изменится за это время, то прибор герметичен. Если же уровень воды в бюретке будет снижаться или подниматься до уровня воды в воронке, то вращательными движениями добейтесь плотного прилегания всех пробок и снова проверьте герметичность прибора.
3. Убедившись в герметичности прибора, отметьте уровень воды в бюретке 1, а затем постепенно (первая порция кислоты должна быть небольшой во избежание бурного выделения газа) наклоните двухколенную пробирку так, чтобы кислота перелилась в колено с магнием.
4. По окончании реакции подождите 1 минуту, пока газ примет температуру помещения, и измерьте объем водорода, вытесненного магнием. Для этого установите воронку на такой высоте, чтобы вода в воронке и бюретке была на одном уровне, то есть газ находился при атмосферном давлении. Деление бюретки, против которого установится уровень воды, будет соответствовать объему выделившегося водорода при условиях проведения опыта. ( Если в начале опыта уровень воды находился не на нулевой отметке, то из конечного показания уровня воды надо вычесть число, соответствующее начальному уровню воды). В таблицу 1.1 запишите значения указанных в ней величин.
Таблица 1.1. Параметры для расчета эквивалента металла
| m, г | P, Па | Т, К | V , мл | Р0, Па | Т0, К | V0, мл | h, Па |
Р0 – давление при нормальных условиях, равное 101325Па;
Т0 – температура при нормальных условиях, равная 273 К.
Определите давление Р по барометру и температуру Т по термометру. Давление насыщенного водяного пара h, соответствующее температуре опыта Т, выпишите из табл. 1.2.
Таблица 1.2. Давление насыщенного водяного пара при различных температурах
| Т, К | ||||||||
| h, Па |
Расчет
Напишите уравнение реакции магния с соляной кислотой.
Измеренный объем водорода V приведите к нормальным условиям по уравнению (3):
 .
.
Из математического выражения (1) закона эквивалентов определите эквивалентную массу магния:
 .
.
Определите теоретическое значение эквивалентной массы магния по формуле:
 ,
,
где 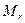 ─ мольная масса металла;
─ мольная масса металла;
В ─ валентность металла.
Сравните полученное практическое значение эквивалентной массы Э магния с теоретическим значением Эт.
Рассчитайте процент относительной ошибки опыта по формуле:
 .
.
Теоретическая часть
Все химические реакции сопровождаются выделением или поглощением энергии, чаще всего в виде тепла. Количество последней может быть измерено и выражено в единицах энергии (Дж, кал и т. д.).
Разница первоначального и конечного уровней энергии системы представляет собой энергетический эффект, или изменение энтальпии реакции, который обозначается ΔНr.
При экзотермических реакциях система с большим запасом энергии переходит в состояние с меньшим запасом энергии. Такие реакции сопровождаются выделением тепла, и их тепловой эффект считается отрицательным (ΔНr <0).
При эндотермических реакциях, наоборот, система с меньшим запасом энергии переходит в состояние с более высоким запасом энергии. Такие реакции сопровождаются поглощением тепла, и их тепловой эффект принято считать положительным (ΔНr >0).
Для термохимических расчетов большое значение имеют величины энтальпий образования веществ. Под энтальпией образования вещества понимается изменение энтальпии реакции образования одного моля сложного вещества из простых веществ, например:

 +90,4 кДж/моль.
+90,4 кДж/моль.
Верхний и нижний индексы при ΔН указывают на то, что энтальпия образования приведена к стандартным условиям (давление 101325 Па, или 1 атм и температура 298 К, или 25 0С).
Значения энтальпий образования веществ приведены в таблицах термодинамических потенциалов.
Термохимические расчеты основаны на использовании закона Гесса и вытекающих из него следствий:
1. Тепловой эффект химического процесса равен сумме тепловых эффектов всех промежуточных стадий процесса.
Например, процесс получения двуокиси углерода из угля и кислорода может быть проведен в одну стадию:
С(т) + О2(г) = СО2(г) ; ΔНr = ─ 94 ккал.
Но этот же процесс можно провести в две стадии:
С(т) + 1/2 О2(г) = СО(г) ; ΔНr = ─ 26,4 ккал.
CO(г) + 1/2O2(г) = CO2(г); ΔНr = ─ 67,6 ккал.
Согласно закону Гесса, сумма тепловых эффектов двух последних реакций должна равняться тепловому эффекту первой реакции, что и наблюдается в действительности: {─ 26,4 ─ 67,6 = ─ 94 (ккал)}.
2. Тепловой эффект химической реакции равен разности теплот образования конечных и исходных участников реакции, умноженных на их стехиометрические коэффициенты (т. e. коэффициенты перед формулами данных веществ в уравнении реакции).
Например, реакция горения пропана протекает по схеме:
С3Н8(г) + 5Ог(г) = 3СО2(г) + 4Н2О(г).
Теплоты образования  ;
;  и
и  соответственно равны ─103,8; ─393,6 и ─241,9 кДж/моль.
соответственно равны ─103,8; ─393,6 и ─241,9 кДж/моль.
Тепловой эффект реакции горения С3Н8(г) рассчитывается по формуле:

Практическая часть
Методика проведения опытов
Для определения тепловых эффектов процессов, протекающих в водных растворах, используют простейший калориметр, приведенный на рис. 2.1.
| |

Рис.2.1. Схема калориметра:
1─внешний стакан калориметра; 2 ─ внутренний стакан калориметра;
3 ─ теплоизолирующая прокладка; 4 ─ термометр;5 ─ мешалка
Так как слой воздуха, находящийся между стенками внешнего и внутреннего стаканов калориметра, является хорошим теплоизолятором, то все тепло, выделяющееся (или поглощающееся) в результате протекания реакции, идет на нагревание (или охлаждение) реакционной смеси и внутреннего стакана калориметра. Экспериментально определяется изменение температуры реакционной смеси, сопровождающее данный процесс. Для этого во внутренний стакан калориметра отмеривают с помощью мерного цилиндра 25–30 мл воды и измеряют начальную температуру tнач. с помощью термометра, который помещают непосредственно в жидкость, следя, чтобы он не касался дна и стенок внутреннего стакана (см. рис.2.1).
Не вынимая термометра из жидкости, во внутренний стакан засыпают сухую соль. Раствор перемешивают мешалкой до полного растворения, следя одновременно за показаниями термометра. Температура в ходе процесса может повышаться или понижаться. Конечную температуру tкон. фиксируют в тот момент, когда столбик термометра останавливается.
Все данные, необходимые для расчетов, сводят в таблицу (форма таблицы дана в описании опытов).
Тепловой эффект процесса, протекающего в калориметре, рассчитывается по формуле:
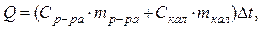
где Ср-ра ─ удельная теплоемкость раствора, находящегося во внутреннем стакане калориметра, которую можно принять равной удельной теплоемкости воды
 = 4,18 Дж/г·град;
= 4,18 Дж/г·град;
тр-ра ─ масса раствора во внутреннем стакане калориметра, г;
Скал ─ удельная теплоемкость внутреннего стакана калориметра, Дж/г∙град;
ткал ─ масса калориметра, г;
Δt ─ изменение температуры в ходе опыта, оС.
Учитывая, что удельная теплоемкость стекла, из которого сделан внутренний стакан калориметра, мала, вторым слагаемым можно пренебречь, тогда формула для расчета теплового эффекта примет вид:

Опыт №1. Определение мольной теплоты растворения соли
Опыт проводят согласно описанию с выданной преподавателем навеской соли. Химическая формула соли и ее масса указаны на обертке навески. Данные, необходимые для расчета, сводят в таблицу 2.1.
Таблица 2.1. Параметры для расчета мольной теплоты растворения соли
| Химическая формула соли |  г
г
|  г
г
| 
| 
| 
|  г/моль
г/моль
|  Дж/г·град
Дж/г·град
|  кДж/моль
кДж/моль
|
| 1. | 4,18 | |||||||
| 2. | 4,18 |
Мольную теплоту растворения, то есть теплоту, выделяющуюся или поглощающуюся при растворении в воде 1 моля соли, рассчитывают по формуле:
 .
.
Пользуясь приведенной в конце работы таблицей, в которой даны теоретические значения мольных теплот растворения некоторых солей, рассчитайте относительную погрешность определения:
 .
.
Опыт №2. Определение мольной теплоты гидратации соли
Гидратацией называют процесс присоединения к соли определенного количества молекул воды с образованием кристаллогидрата данной соли, например:
Na2СO3 + l0H2O = Na2CO3 · 10Н2О.
Для определения мольной теплоты гидратации в воде растворяют сначала навеску
безводной соли:
Na2СO3 + пH2O = Na2CO3 · пН2О; ΔН растворения безводной .соли
а затем навеску кристаллогидрата данной соли:
Na2CO3 · 10Н2О + (п ─ 10)H2O = Na2CO3 · пН2О; ΔН растворения кристаллогидрата
Оба процесса проводят согласно описанию, приведенному в практической части, и данные вносят в таблицу 2.1.
Пользуясь формулой для расчета мольной теплоты растворения, приведенной в 1-м опыте, рассчитывают ΔН растворения безводной соли и кристаллогидрата.
Теплоту гидратации вычисляют, пользуясь законом Гесса:
ΔН растворения безводной соли = ΔН гидратации + ΔН растворения кристаллогидрата
Относительную погрешность определения рассчитывают исходя из данных табл.2.2.
Таблица 2.2. Мольные теплоты растворения и гидратации
Выводы
В выводах каждого опыта должно быть указано, какой тип реакций (экзо- или эндотермическая) наблюдается для данной соли и на основании чего можно сделать такое заключение.
Лабораторная работа №3
Теоретическая часть
Скорость химической реакции измеряется изменением концентраций реагирующих веществ в единицу времени. Под концентрацией вещества понимают количество его в единице объема. Концентрацию обычно выражают числом молей вещества, содержащихся в одном литре.
Скорость реакции зависит от природы реагирующих веществ и от условий ее протекания. Главными факторами, влияющими на скорость реакции, являются концентрации реагирующих веществ и температура.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Эта зависимость носит название закона действия масс.
Например, для реакции синтеза аммиака, протекающей по уравнению:
N2 + 3Н2  2NH3 ; ΔНr = ─ 92,6 кДж,
2NH3 ; ΔНr = ─ 92,6 кДж,
зависимость скорости реакции от концентраций реагирующих веществ имеет следующий вид:
 ,
,
где  ─ константа скорости данной реакции
─ константа скорости данной реакции
Закон действия масс строго применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют также твердые вещества, концентрация которых постоянна, то данная концентрация не включается в зависимость v = f(c).
Зависимость скорости реакции от температуры выражается экспериментальным правилом Вант - Гоффа, согласно которому с повышением температуры на каждые 10° скорость реакции увеличится в 2 – 4 раза:

где v2 и v1 ─скорости реакции соответственно при температурах Т2 и Т1;
γ ─ температурный коэффициент реакции, γ = 2 ... 4.
С течением времени скорость реакции уменьшается, так как по мере взаимодействия веществ уменьшаются их концентрации. Но если реакция обратима и протекает в замкнутом пространстве, то одновременно с уменьшением скорости прямой реакции vпр. увеличивается скорость обратной реакции vобр. вследствие накопления продуктов прямой реакции. Когда обе скорости становятся одинаковыми, наступает состояние равновесия, и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается.
Соотношение между концентрациями исходных веществ и продуктов в состоянии равновесия является постоянным для реакции. Так, для реакции синтеза аммиака выражение для константы равновесия имеет вид:
 .
.
Состояние химического равновесия в основном зависит от 3-х факторов:
а) концентраций участников реакции,
б) температуры,
в) давления (если в реакции участвуют газообразные вещества).
При изменении хотя бы одной из указанных величин равновесие нарушается, и концентрации всех участвующих в реакции веществ начинают изменяться до тех пор, пока при измененных условиях скорости прямой и обратной реакций снова не сравняются. Этот процесс называется смещением или сдвигом равновесия.
Направление, в котором смещается равновесие, определяется принципом Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в направлении, противодействующем данному воздействию.
Так, равновесие процесса синтеза аммиака можно сдвинуть в прямом направлении (вправо), если:
а) увеличить концентрации N2 или Н2 или уменьшить концентрацию NH3;
б) уменьшить температуру;
в) увеличить давление в системе.
Практическая часть
Опыт № 1. Влияние концентраций реагирующих веществ на скорость реакции
В пронумерованные пробирки налить тиосульфат натрия Nа2S2O3 и воду в соответствии с заданием (табл. 3.1). Затем в 1-ю пробирку добавить указанное в задании количество капель серной кислоты H2SO4 и отметить время, прошедшее с момента прикапывания H2SO4 до появления первых признаков выпадающей в осадок серы (помутнение реакционной смеси):
Na2S2O3 + H2SO4 = S + SO2 + Na2SO4 + Н2О.
Для того чтобы не пропустить момент появления мути, необходимо рядом с пробиркой, в которой находится реакционная смесь, поместить контрольную пробирку с дистиллированной водой.
Таблица 3.1. Список заданий к опыту №1 (количества реактивов даны в каплях)
| Название реактива | № пробирки | Номера заданий | |||||||
| Na2S2O3 | |||||||||
| Н2О | |||||||||
| h2so4 |
Аналогично провести опыты с растворами в остальных пробирках. Полученные данные записать в таблицу 3.2.
По данным таблицы построить график зависимости реакции v от концентрации С и сделать вывод о характере данной зависимости.
Теоретическая часть
Растворы представляют собой однородную систему, состоящую из двух или больше компонентов, один из которых является растворенным веществом, а другой, как правило, взятый в большем количестве, растворителем.
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном весовом количестве или определенном объеме раствора или растворителя.
Способы выражения концентраций
1. Молярность СМ─ это число молей растворенного вещества в 1 л раствора:

где ν ─ количество молей растворенного вещества;
m1 ─ масса растворенного вещества, г;
М1 ─ молярная масса растворенного вещества, г/моль;
V ─ объем раствора, мл.
2. Нормальность Сн (или N) ─ число молей эквивалентов растворенного вещества в 1 л раствора:

где νэкв ─ количество молей эквивалентов растворенного вещества;
Э ─ эквивалентная масса растворенного вещества, г/моль.
Согласно закону эквивалентов равные объемы одинаковой концентрации содержат одинаковое число молей эквивалентов растворенного вещества, поэтому при одинаковой нормальности объемы растворов реагирующих веществ равны. Если же эти нормальности неодинаковы, то объемы растворов обратно пропорциональны их нормальностям:
 .
.
Основанный на этом метод определения концентрации растворов называется объемным анализом и сводится к измерению объемов растворов реагирующих веществ, концентрация одного из которых известна. Такое измерение производится постепенным прибавлением одного раствора к другому, до окончания реакции, которое определяется с помощью индикатора. Этот процесс называется титрованием.
3. Моляльность Ст─число молей растворенного вещества в 1000 г растворителя:

где m1 ─ масса растворенного вещества, г;
m2 ─ масса растворителя, г.
4. Мольная доля χ1─отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора:

где ν1, ν2 ─ число молей растворенного вещества и растворителя;
М2 ─ молярная масса растворителя,г/моль.
5. Титр Т ─ количество граммов растворенного вещества в 1 см3 раствора:
 .
.
6. Процентная концентрация или массовая доля ω ─ количество граммов растворенного вещества в 100 г раствора:


где ρ ─ плотность раствора, г/см3.
Приготовление растворов необходимой концентрации часто производится путем разбавления концентрированных растворов. Нужные весовые количества исходных жидкостей легко находятся при помощи так называемого «правила креста». Так, например, используемая в качестве электролита для аккумуляторов 25%-ная серная кислота готовится из концентрированной 96%-ной кислоты и воды 0%:

 96 25 25 ─ 0 = 25
96 25 25 ─ 0 = 25

 25
25
0 71 96 ─ 25 = 71
В соответствии со схемой для приготовления 25%-ной серной кислоты нужно взять 25 весовых частей 96%-ной серной кислоты и 71 весовую часть воды.
Практическая часть
0пыт № 1.Определение концентрации раствора кислоты
Описание прибора
Измерительным прибором, применяемым в объемном анализе, является бюретка, которая служит для точного определения объемов жидкостей. Бюретка заполняется раствором несколько выше нулевого деления. Открыв кран или зажим, сливают избыток раствора, доводя его уровень до нулевого деления. При наблюдении положения жидкости в бюретке глаз наблюдателя, должен находиться точно на уровне нижнего края мениска (вогнутая поверхность жидкости).
Для приготовления растворов нормальной и молярной концентрации используют мерную колбочку, в которую загружают определенное количество вещества и доливают воду до метки, содержимое колбы встряхивают.
Ход работы
В чистую коническую колбочку налить указанное количество миллилитров кислоты неизвестной концентрации, отмеренное с помощью цилиндра, и добавить 3─ 5 капель индикатора ─ фенолфталеина. Поставить колбочку под бюретку с раствором щелочи известной концентрации на чистый лист белой бумаги. Приливать в колбочку из бюретки небольшими порциями (приблизительно по 1 мл) раствор щелочи до появления окраски, не исчезающей при перемешивании. В растворе кислоты фенолфталеин бесцветен, поэтому при титровании щелочью необходимо уловить момент появления устойчивой окраски всего раствора от одной капли прибавляемого раствора щелочи. Появление окраски означает, что кислота полностью нейтрализована щелочью. Объем щелочи, пошедшей на титрование, записать в таблицу 4.1 с точностью до 0,1 мл. Первое титрование является ориентировочным. Титрование следует повторить еще 2 раза. Взяв среднее значение объема раствора щелочи, пошедшего на титрование, рассчитать нормальность кислоты. Рассчитать массу кислоты, содержащейся в 10 мл этого раствора.
Таблица 4.1. Данные для определения концентрации раствора кислоты
| № опыта | Объем кислоты, мл | Объем щелочи, пошедшей на титрование, мл | Нормальность щелочи | Среднее значение объема щелочи, мл |
| 1. | ||||
| 2. | ||||
| 3. |
Опыт № 2. Определение концентрации раствора щелочи
Опыт выполняется аналогично опыту 1. В чистую коническую колбочку налить указанное количество миллилитров щелочи неизвестной концентрации, отмеренное с помощью цилиндра, и добавить 2─3 капли индикатора ─ метилоранжа. Поставить колбочку под бюретку с раствором кислоты известной концентрации на чистый лист белой бумаги. Приливать в колбочку из бюретки небольшими порциями (приблизительно по 1 мл) раствор кислоты до изменения окраски с желтой на красную от одной капли кислоты.
Изменение окраски означает, что щелочь полностью нейтрализована кислотой. Объем кислоты, пошедшей на титрование, записать в таблицу 4.2 с точностью до 0,1 мл.
Первое титрование является ориентировочным. Титрование следует повторить еще 2 раза. Взяв среднее значение объема раствора кислоты, пошедшего на титрование, рассчитать нормальность щелочи. Рассчитать массу щелочи, содержащейся в 10 мл этого раствора.
Таблица 4.2. Данные для определения концентрации раствора щелочи
| № опыта | Объем щелочи, мл | Объем кислоты, пошедшей на титрование, мл | Нормальность кислоты | Среднее значение объема кислоты, мл |
| 1. | ||||
| 2. | ||||
| 3. |
Формулы для расчета
1. Вычислить нормальную концентрацию раствора кислоты (оп.№1) или раствора щелочи (оп.№2) из формулы закона эквивалентов для растворов:
 .
.
2. Вычислить массу кислоты (оп.№1) или щелочи (оп.№2), содержащейся в 10 мл соответствующего раствора, из формулы нормальной концентрации:

3. Вычислить массу воды (растворителя) в 10 мл раствора, считая плотность раствора равной 1:


4. Пользуясь полученными данными, вычислить заданные концентрации по соответствующим формулам.
Лабораторная работа №5
Теоретическая часть
Электролитической диссоциацией называется частичный или полный распад молекул электролита на ионы под действием полярных молекул растворителей. Диссоциация протекает в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителей. Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов – гидратацией) ионов. В растворах электролитов образуются сольватированные ионы.
Электролиты проводят электрический ток, так как в растворах имеются заряженные частицы: катионы и анионы.
Количественно процесс диссоциации характеризуется степенью электролитической диссоциации α. Степенью диссоциации называется отношение числа молекул, распавшихся на ионы n к общему числу молекул N растворенного вещества:

Степень диссоциации выражается в процентах или долях единицы. Электролиты делятся на три группы: а) сильные (α > 30 %); б) средние (3 < α < 30 %); в) слабые
(α < 3 %).
В учебной литературе приведены таблицы степеней диссоциации кислот, основании и солей. Степень диссоциации зависит от природы растворенного вещества и растворители, температуры, концентрации и присутствия в растворе одноименных ионов. Для слабых электролитов степень диссоциации существенно зависит от концентрации: чем меньше концентрация раствора, тем больше степень электролитической диссоциации.
Значительно удобней характеризовать способность электролитов к диссоциации в растворе константой диссоциации К, которая не зависит от концентрации раствора. Константа диссоциации К представляет собой константу равновесия обратимого процесса диссоциации слабого электролита – кислоты или основания. Константа диссоциации кислот называют также константой кислотности, а оснований – константой основности. Значения констант диссоциации слабых электролитов приведены в таблицах для стандартных условий.
Пример
 .
.
Константа диссоциации (основности) выражается отношением произведения равновесных концентраций ионов в растворе данного слабого электролита к концентрации недиссоциированных молекул:
 .
.
Константа диссоциации является мерой относительной силы слабых электролитов: чем она меньше, тем слабее электролит. Связь между константой и степенью диссоциации слабого бинарного электролита подчиняется закону разведения Оствальда:
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...