
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Общие указания по проведению опытов
Вещества, между которыми проводится реакция, берутся в одинаковых пропорциях (8–10 капель), причем, смешивание веществ следует производить в той последовательности, которая указана в задании.
Внимательно следите за внешними изменениями (изменение цвета, запаха, выделение газа или осадка) при протекании реакции и фиксируйте их. Для определения возможных продуктов воспользуйтесь таблицей 7.1. Рекомендуется начать определение возможных продуктов реакции с поиска потенциальных окислителей и восстановителей.
Оформление опытов следует начинать с написания уравнений электронно-ионного баланса, затем, просуммировав эти уравнения с учетом найденных коэффициентов, получают сокращенную ионную форму ОВР. Дополнив левую и правую часть сокращенной ионной формы фоновыми ионами, получают полную ионную форму ОВР и, наконец, объединив ионы в молекулы, – молекулярную форму ОВР.
Опыт №1. Реакции, в которых окислителями являются элементы в высшей степени окисления
| 1. KMnO4 + H2SO4 + NaNO2 2.KMnO4 + H2O + NaNO2 3. KMnO4 + NaOH + NaNO2 4. KMnO4 + H2SO4 + FeSO4 5. CuCl2+ NaNO2 6. FeSO4+ H2SO4+ K2CrO4 |
7. KMnO4 + H2SO4 + Na2S
8. (NH4)2Cr2O7  9. KMnO4 + MnSO4
10. KMnO4 + KOH +Na2S2O3
11. KMnO4 + KOH +KI
12. KMnO4 + KOH +I2
9. KMnO4 + MnSO4
10. KMnO4 + KOH +Na2S2O3
11. KMnO4 + KOH +KI
12. KMnO4 + KOH +I2
|
Таблица 7.1.Степени окисления и внешние признаки основных окислителей и восстановителей
| Элемент | Степень окисления | Соединение или ион | Внешние признаки |
| Азот | +5 | NO3- | Бесцветный раствор |
| +4 | NО2 ↑ | Бурый газ с резким запахом | |
| +3 | NО2-(KNО2,...) | Бесцветный раствор | |
| +2 | NO↑ | Бесцветный газ с резким запахом | |
| + 1 | N2O↑ | Бесцветный газ со слабым наркотическим действием | |
| N2↑ | Бесцветный газ без запаха | ||
| –3 | NH3 или NH4+ (NH4NO3..) | Бесцветный газ с резким запахом или бесцветный раствор | |
| Сера | –2 | H2S↑, или S2- (Na,S...) | Бесцветный газ или раствор с запахом тухлых яиц |
| S↓ | Осадок или взвесь белого цвета | ||
| +2 | S2O32- (Na2S2O3.,.) | Бесцветный раствор | |
| +4 | SO2↑, SО32- (Na2SO3..) | Бесцветный газ с резким запахом или бесцветный раствор | |
| +6 | SO42- (Na2SO4...) | Бесцветный раствор | |
| Марганец | +7 | MnO4-(KMnО4...) | Малиновый раствор |
| +6 | MnO42- (K2MnО4...) | Зеленый или сине-зеленый раствор | |
| +4 | MnO2 | Бурый оcадок или взвесь | |
| +2 | Mn2+ (MnSO4..) | Бесцветный раствор | |
| Хром | +6 | CrO42-_ (K2CrO4...), Сr2О72- (К2Сr2О7...) | Желтый раствор Оранжевый раствор |
| +3 | Cr3+ (CrCl3, Cr2(SO4)3...) | Зеленый или фиолетово-голубой раствор | |
| Железо | +3 | Fe3+ (Fe2(SO4),...) | Желтоватый раствор |
| +2 | Fe2+ (FeCl2, FeSO4...) | Очень бледный желтый или зеленоватый раствор | |
| Медь | +2 | Cu2+ (CuCl2,...) | Голубой раствор |
| +1 | Cu1+ (CuCl,...) | Зеленый раствор | |
| Иод | +3 | IO3- (KIO3, NaIO3..) | Бесцветный раствор |
| + 1 | IO-(KIO,NaIO...) | Бесцветный раствор | |
| I2 | Бурый раствор с характерным запахом или темно-фиолетовые кристаллы | ||
| –1 | I- (KI, NaI...) | Очень бледно-желтый (почти бесцветный) раствор | |
| Кислород | O2↑ | Бесцветный газ без запаха | |
| –1 | H2O2 | Бесцветная жидкость | |
| –2 | h2o, oh- | Бесцветная жидкость |
Опыт №2. Реакции, в которых восстановителями являются элементы в низшей степени окисления или свободные металлы
| 1. KMnO4 + H2SO4 +KI 2. KI+FeCl3 3. KI+ H2SO4 + NaNO2 4. KI+ H2SO4конц 5. Mg+ HNO3конц 6. Mg+ HNO3разб 7. K2CrO4+ H2SO4+Mg | 8. KMnO4 + H2SO4 +Mg 9. KI+ HNO3конц 10. KI+ H2SO4 + K2CrO4 11. KMnO4 + H2SO4 +Na2S 12. Na2S+I2 13. Na2S+ H2SO4 + K2CrO4 14. KMnO4 + H2SO4 +Zn |
Опыт №3. Окислительно-восстановительная двойственность элементов в промежуточной степени окисления
| 1. KI+ H2SO4 + H2O2 2. NaNO2+ H2SO4+ K2CrO4 3. H2O2+ H2SO4+ K2CrO4 4. Na2S2O3+ NaOH +I2 5. Na2S2O3+ H2SO4 6. Na2S2O3+HCl | 7. KMnO4 + H2SO4 + H2O2 8. I2+ KOH 9. KMnO4 + H2O2 10. Na2S2O3+ KMnO4 11. Na2S2O3+ H2SO4 + K2CrO4 12. CuCl2+ Na2S2O3 |
Выводы
По каждой реакции следует указать, какой элемент ипочему является окислителем и восстановителем, составить уравнения электронно-ионного баланса и на их основании молекулярные уравнения ОВР и пояснить, к какому типу окислительно-восстановительных реакций относится данная реакция.
Лабораторная работа №8
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Цель работы: опытным путем исследовать активность металлов и изучить анодный и катодный процессы, протекающие в гальваническом элементе.
Теоретическая часть
Количественной характеристикой активности (способности отдавать электроны) являются значения потенциала ионизации и стандартного электродного потенциала. Электродный потенциал – это скачок потенциала, возникающий на границе металл/раствор электролита.
Стандартный электродный потенциал – это не абсолютное значение потенциала, а значение его относительно потенциала нормального водородного электрода, условно принятого за нуль, если концентрации всех участвующих веществ равны 1 моль/л.
Если расположить металлы в ряд в порядке возрастания их стандартных потенциалов, то получим ряд напряжений металлов (см. табл.8.1).
Таблица 8.1. Стандартные потенциалы металлов. Ряд напряжений
| Электрод | Потенциал, В | Электрод | Потенциал, В |
| Li/Li+ | –3,045 | Co/Co2+ | –0,277 |
| К/К+ | –2,924 | Ni/Ni2+ | –0,250 |
| Са/Са2+ | –2,866 | Sn/Sn2+ | –0,136 |
| Na/Na+ | –2,714 | Pb/Pb2+ | –0,126 |
| Mg/Mg2+ | –2,363 | Fe/Fe3+ | –0,037 |
| Al/Al3+ | –1,663 | H2/2H+ | |
| Ti/Ti2+ | –1,630 | Bi/Bi3+ | 0,215 |
| Mn/Mn2+ | –1,179 | Cu/Cu2+ | 0,337 |
| Zn/Zn2+ | –0,763 | Ag/Ag+ | 0,799 |
| Cr/Cr2+ | –0,744 | Hg/Hg2+ | 0,850 |
| Fe/Fe2+ | –0,440 | Pt/Pt2+ | 1,188 |
| Cd/Cd2+ | –0,403 | Au/Au3+ | 1,498 |
Ряд напряжений выражает следующие закономерности:
1. Металлы, расположенные до магния, вытесняют водород из воды.
2. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из: растворов кислот (соляной, разбавленной серной и др., кроме азотной).
3. Каждый металл вытесняет расположенные после негометаллы из растворов их солей (это условие выполняется для металлов, расположенных после магния).
Если концентрации электролитов не равны 1 моль/л, то электродный потенциал рассчитывается по уравнению Нернста:
 ,
,
где Е° ─ стандартный электродный потенциал,
n ─ заряд иона металла;
 ─ молярная концентрация ионов металла в растворе, моль/л или моль ионов/л.
─ молярная концентрация ионов металла в растворе, моль/л или моль ионов/л.
Описание прибора
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую энергию за счет различия величин электродных потенциалов двух электродных реакций.
Наиболее простой цинково-медный гальванический элемент был создан Даниэлем и Якоби. Схема его представлена на рис.8.1.
| |
| |
| |
| |
| |
| |

Рис.8.1. Схема гальванического элемента Даниэля ─ Якоби:
1 ─ стаканы с растворами: сульфата цинка (а); сульфата меди (б); 2 ─ цинковый и медный электроды;
3 ─ электролитический ключ; 4 ─ токопроводящая проволока; 5 ─ гальванометр
Элемент устроен и работает следующим образом: в два сосуда с растворами (ZnSO4, CuSO4) опущены цинковая и медная проволоки (электроды) соответственно, которые соединены медной проволокой.
Величины стандартных электродных потенциалов цинка и меди соответственно равны Zn/Zn 2+ = ─ 0,76 В, Cu/Cu 2+ = +0,34 В и указывают, что на поверхности цинка, как более активного металла, больше электронов, чем на меди. При погружении в сосуды электролитического ключа (U-образной трубки, соединяющей сосуды между собой), наполненного электролитом, электроны с цинкового электрода будут перемещаться к медной пластине, при этом замкнется внешняя электрическая цепь.
Цинковый электрод начнет окисляться, посылая ионы Zn2+ в раствор:
Zn – 2ē= Zn2+.
Прибывшие на медный электрод электроны будут восстанавливать ионы меди, находящиеся в растворе: Сu2+ + 2ē = Сu°, атомы меди осаждаются на электроде. Медный электрод является катодом, цинковый ─ анодом.
Ионы  , оставшиеся после восстановления ионов меди, будут перемещаться по электролитическому ключу в сосуд с сульфатом цинка в эквивалентном количестве с образующимися ионами цинка и замкнут электрическую цепь.
, оставшиеся после восстановления ионов меди, будут перемещаться по электролитическому ключу в сосуд с сульфатом цинка в эквивалентном количестве с образующимися ионами цинка и замкнут электрическую цепь.
Суммарный процесс, протекающий на электродах, можно изобразить общим уравнением:
Zn0 + Cu2+ = Zn2+ + Cu0 .
Гальванический элемент будет работать до тех пор, пока не сравняются потенциалы медного и цинкового электродов. Работа элемента Даниэля – Якоби опишется схемой:
(─) Zn/ZnSO4//CuSO/Cu(+) .
Для определения электродвижущей силы (ЭДС) гальванического элемента надо из потенциала катода вычесть потенциал анода. Величина ЭДС медно-цинкового гальванического элемента для стандартных условий составит:
 0,34 ─ (─ 0,76) = 1,1 (В).
0,34 ─ (─ 0,76) = 1,1 (В).
Практическая часть
Опыт №1.Активность металлов в растворах электролитов
В три пробирки внесите растворы указанных солей. Опустите во все пробирки, хорошо зачищенные данные металлы. Составьте электронные уравнения протекающих реакций. Сделайте вывод о течении их с точки зрения электродных потенциалов металлов или о невозможности протекания других реакций.
Соли Металл
1. Pb(NO3)2, CuCl2, ZnSO4 железо
2. CuSO4, BaCl2, FeSO4 цинк
3. Pb(NO3)2, CuCl2, MgCl2 алюминий
4. Hg(NO3)2, NaCl, CuSO4 олово
5. Hg(NO3)2, FeSO4, ZnSO4 медь
6. CuSO4, K2CrO4, Na2CO3 магний
7. Hg(NO3)2, NaCl, CuSO4 свинец
8. CuSO4, K2CrO4, Na2CO3 цинк
Опыт №2.Работа гальванического элемента Даниэля – Якоби
Приготовьте раствор сульфата цинка нужной концентрации путем разбавления имеющегося раствора ZnSO4 концентрации 2н водой в мерном цилиндре (например, для приготовления раствора 0,1н надо разбавить в 2:0,1= 20 раз. Это можно сделать в два этапа: 1) разбавить в два раза, налив воды и раствора сульфата цинка поровну;
2) полученный раствор разбавить в 10 раз, для этого налить в мерный цилиндр 1 мл раствора и долить воды до 10 мл.
Соберите гальванический элемент по схеме, изображенной на рисунке 8.1. Для этого налейте в один стакан, чуть-чуть не доходя до края, раствор сульфата цинка указанной концентрации, а в другой ─ столько же раствора сульфата меди указанной концентрации.
Заполните электролитический ключ ( изогнутую стеклянную трубочку) раствором сульфата калия так, чтобы в трубочке не было воздушных пузырей, которые разомкнут электрическую цепь. Соедините оба стакана заполненным электролитическим ключом следующим образом: плотно закрыв пальцем один конец трубочки, другой опустите в стакан с раствором соли, быстро опустите второй конец в другой стакан. Если электролит выльется из трубочки в процессе погружения, то эту операцию необходимо повторить.
В раствор сульфата цинка опустите хорошо зачищенный цинковый электрод, в сульфат меди ─ медный электрод. Наблюдайте отклонение стрелки вольтметра. Напишите уравнения анодного и катодного процессов. Рассчитайте электродные потенциалы с учетом указанных концентраций по уравнению Нернста, ЭДС гальванического элемента. Сравните его значение с показанием вольтметра.
1. Zn/ZnSO4 (0,2 н)//CuSO4(2h)/Cu 5. Zn/ZnSO4 (0,025н)//CuSO4(2н)/Cu
2. Zn/ZnSO4, (0,125 h)//CuSO4 (2h)/Cu 6. Zn/ZnSO4(0,04н)//CuSO4(2н)/Cu
3. Zn/ZnSO4 (0,4 h)//CuSO4(2h)/Cu 7. Zn/ZnSO4 (0,02н)//CuSO4(2н)/Cu
4. Zn/ZnSO4 (0,5н)/CuSO4(2н)/Cu 8. Zn/ZnSO4 (0,2н)//CuSO4(1н)/Cu
Опыт №3.Работа концентрационного гальванического элемента
В качестве электродов используется один и тот же металл, опушенный в раствор соответствующей соли.
1. Fe/FeSO4(2M)//FeSO4(0,1н)/Fe
1. Al/Al2(SO4)3(0,3M)//Al2(SO4)3(0,03н)/Аl
2. Co/CoSO4(4н)/Со//СоSO4(0,02M)
3. Ag/AgNO3(2н)//AgNO3(0,5M)/Ag
4. Cd/CdSO4(0,8M)//CdSO4(0,04н)/Cd
5. Mn/MnSO4(0,5н)//MnSO4(0,5M)/Mn
6. Bi/Bi(NO3)3(3н)//Bi(NO3)3(0,006M)/Bi
7. Mg/MgSO4(0,01M)//MgSO4(0,0002н)/Mg
Формулы для расчетов
1. Пересчитайте нормальную концентрацию Сн в молярную концентрацию СМ:
 , отсюда
, отсюда  .
.
Эквивалентная масса ионов металла равна
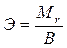
 ,
,
где 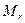 – молярная масса ионов металла,
– молярная масса ионов металла,
В – валентность металла.
Подставив Э в формулу для СМ, получим:  .
.
2. Вычислите электродный потенциал по уравнению Нернста.
3. Вычислите ЭДС как разность потенциалов катода и анода.
Лабораторная paбoтa №9
ЭЛЕКТРОЛИЗ
Цель работы: опытным путем изучить электролиз растворов солей.
Теоретическая часть
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах, при прохождении электрического тока через раствор или расплав электролита. Это не самопроизвольный процесс, для осуществления химической реакции требуется электрическая энергия. Сущность электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде – процесс окисления. Процессы, протекающие на электродах, зависят как от электролита, так и от вещества, из которого сделан анод.
Различают два вида анодов: растворимые и нерастворимые.
Нерастворимый, или инертный анод не изменяется в процессе электролиза, играет роль передатчика электронов (графит, уголь, платина и др.).
Растворимый, или активный анод в процессе электролиза окисляется (медь, железо, кобальт и др.): Мео – nē=Мen+.
На электродах легче всего протекают процессы, требующие минимальной затраты энергии. На катоде быстрее восстанавливаются ионы, молекулы, атомы, имеющие наибольшее значение электродного потенциала.
Практическая последовательность восстановления на катоде при электролизе водных растворов:
1) ионы металлов от конца ряда напряжений до цинка: Аu3+....Zn2+ по уравнению:
 ē
ē  .
.
Металл при этом выделяется в свободном виде.
2) молекулы воды: 2Н2О + 2ē = Н2↑ + 2ОН-.
Если в растворе одновременно находятся катионы нескольких металлов, то при разных концентрациях их в первую очередь на катоде разряжаются ионы того металла, у которого больше величина электродного потенциала. Например, если в растворе одновременно присутствуют в равных концентрациях различные катионы (Zn2+, Au3+, Cu2+, Fe2+), то, в соответствии с величинами их электродных потенциалов, катионы будут восстанавливаться в следующей последовательности: Au3+, Cu2+, Fe2+, Zn2+.
На аноде легче всего окисляются ионы, молекулы, атомы, имеющие наименьшее значение электродного потенциала.
Практическая последовательность окисления на аноде при электролизе водных растворов:
а) анод – инертный:
1) анионы бескислородных кислот: Se2-, S2-, I-, Вr-, Сl- (кроме F-) до соответствующих соединений в свободном виде Se, S, I2, Br2, Cl2↑;
2) молекулы воды: 2Н2О – 4ē = О2↑ + 4Н+;
б) анод — активный:
окисляется сам анод: Мео – nē = Мen+.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...