
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
КОРРОЗИЯ МЕТАЛЛОВ И БОРЬБА С НЕЙ
Цель работы: изучить анодные и катодные процессы при коррозии металлов и некоторые способы защиты от коррозии.
Теоретическая часть
Коррозией называется самопроизвольное разрушение металлов вследствие физико-химического воздействия окружающей среды, металл переходит при этом в окисленное (ионное) состояние.
Коррозионные процессы по характеру протекания разделяются на химические и электрохимические.
Химическая коррозия – это разрушение металлов при непосредственном воздействии на них газов окружающей среды (хлора, сероводорода, диоксида углерода и др.) при высоких температурах, поэтому ее называют также газовой коррозией.
Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
В среде электролита система из основного металла и металла примеси образует большое число микрогальванических элементов, состоящих из анодных и катодных участков. Анодный процесс – это переход металла в раствор в виде ионов с оставлением эквивалентного количества электронов в металле, осуществляется по схеме:
Mе0 → Меn++nē.
Катодный процесс заключается в связывании избыточных электронов, появившихся в металле, молекулами, атомами или ионами окислителей, присутствующих в окружающей среде.
Основными окислительными агентами являются:
1) кислород, растворенный в воде (атмосферная коррозия):
О2+2Н2О + 4ē → 4ОН-;
2) кислород, растворенный в кислоте:
О2 + 4Н+ + 4ē → 2Н,О;
3) ионы водорода (кислая среда):
2H++2ē → H2.
Энергичным ускорителем является ион хлора, который разрушает защитные пленки на металлах.
Основные методы защиты от коррозии
1. Применение защитных покрытий (полимерные, лакокрасочные, металлические). Металлические защитные покрытия по механизму действия делятся на катодные и анодные. При катодных покрытиях защищающий металл имеет большую величину электродного потенциала по сравнению с электродным потенциалом защищаемого металла. Например, железо, покрытое более устойчивым в обычных условиях оловом (луженое железо). При нарушении целостности покрытий образуется гальваническая пapa Fe/Sn. В соответствии с величинами электродных потенциалов
( 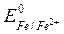 =–0,44 В <
=–0,44 В < 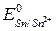 = – 0,14 В ) в этой паре железо является анодом и будет окисляться:
= – 0,14 В ) в этой паре железо является анодом и будет окисляться:
Fe – 2ē=Fe2+,
олово будет являться катодом, на его поверхности пойдет один из трех вышеназванных катодных процессов в зависимости от условий протекания коррозии. При анодных покрытиях защищающий металл имеет меньшую величину электродного потенциала, чем защищаемый металл. Например, железо, покрытое цинком (оцинкованное железо):
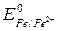 = – 0,44 В >
= – 0,44 В > 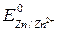 = – 0,76 B.
= – 0,76 B.
При нарушении целостности покрытия образуется гальваническая пара Fe/Zn, в которой цинк является анодом и будет окисляться:
Zn – 2ē = Zn2+,
а железо –катодом, на его поверхности пойдет соответствующий катодный процесс.
2. Электрохимические методы защиты (протекторная, электрическая).
3. Применение ингибиторов коррозии – веществ, замедляющих процесс коррозии. Подразделяются на анодные и катодные, т. е. тормозящие анодные и катодные процессы.
Механизм действия анодных ингибиторов объясняется переходом защищаемого металла в пассивное состояние за счет окисления поверхности металла или адсорбцией поверхностью металла аниона. К ним относятся фосфаты, силикаты, хроматы, органические амины.
Катодные ингибиторы уменьшают скорость коррозии за счет повышения перенапряжения катодного выделения водорода (соли мышьяка, висмута) или являются поглотителями катодных деполяризаторов, главным образом кислорода (сульфит натрия, гидразин).
4. Создание новых сплавов, обладающих высокой коррозионной стойкостью.
Практическая часть
Опыт №1.Влияние гальванической пары на коррозию металла
Приготовьте гальванические пары. Для этого плотно скрутите друг с другом тщательно зачищенные наждачной бумагой металлические проволоки согласно данному преподавателем заданию. В пробирку налейте по 2 мл 2н соляной кислоты и опустите гальванические пары. Что наблюдается в пробирках?
Отметьте, на каком металле происходит более интенсивное выделение пузырьков газа. Составьте электронные уравнения анодного и катодного процессов и суммарное уравнение.
В заданиях 1–5 в каждую пробирку добавьте по три капли красной кровяной соли K3[Fe(CN)4], которая является реагентом на ионы двухвалентного железа Fe2+, образуя с ними осадок синего цвета – турнбулеву синь Fe3[Fе(CN)4]2 . Напишите уравнения соответствующих реакций. В заданиях 8–10 в каждую пробирку добавьте по 1 капле иодида калия КI, которая образует желтый осадок иодида свинца PbI2 в присутствии ионов свинца Pb2+. Напишите соответствующие уравнения.
| 1) железо/цинк 2) железо/медь 3) железо/алюминий 4) железо/олово 5) железо/свинец | 6) цинк/медь 7) алюминий/медь 8) алюминий/свинец 9) цинк/свинец 10) медь/свинец |
Опыт №2. Влияние активатора (хлорид-иона) на коррозию
Приготовьте две пробирки, в которых налито по 2 мл раствора соли меди: в первую – хлорид меди CuCl2, во вторую – сульфат меди CuSO4. Опустите в них cоответствующие металлы:
1) железо 5) свинец
2) алюминий 6) алюминий
3) цинк 7) цинк
4) олово
Обратите внимание на различную скорость происходящих процессов. Составьте электронные уравнения химических реакций и сделайте вывод.
Опыт №3. Методы защиты от коррозии
а) Образование на металле защитных пленок
В пробирки налейте по 1 мл 0,1н раствора серной кислоты и опустите гальванические пары (см. задание из опыта №1). Наблюдайте выделения газа. Добавьте в одну пробирку 1 мл раствора фосфата натрия, а в другую – 1 мл раствора силиката натрия. Что происходит? Дайте объяснение. Напишите уравнения соответствующих реакций.
б) Действие ингибиторов
Налейте в две пробирки по 1 мл 0,2н раствора соляной кислоты или 0,1н раствора серной кислоты. В одну пробирку добавьте анилин, а в другую – уротропин и опустите в них гальванические пары (см. задание из опыта №1).
Что наблюдается? Объясните наблюдаемые явления.
Лабораторная работа № 12
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...