
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРОВЕДЕНИИ ЛАБОРАТОРНЫХ РАБОТ МАЛОГО ПРАКТИКУМА ПО ОРГАНИЧЕСКОЙ ХИМИИ
ПРАКТИКУМ
ПО КУРСУ ОРГАНИЧЕСКОЙ ХИМИИ
для студентов факультета экономики и управления
Учебное пособие
Москва, 2003т.
Министерство образования Российской Федерации
Российский государственный университет нефти и газа
имени И.М. Губкина
Кафедра органической химии и химии нефти
Л.В. Зиновьева, Е.Е. Янченко
ПРАКТИКУМ
ПО КУРСУ ОРГАНИЧЕСКОЙ ХИМИИ
для студентов факультета экономики и управления
Учебное пособие
Под редакцией проф. В.Н. Кошелева
Москва, 2003
УДК 547
Зиновьева Л.В., Янченко Е.Е. Практикум по курсу органической химии. – М.: РГУ нефти и газа, 2003. - 62 с.
В пособии изложены основные теоретические сведения по органической химии и химии нефти, необходимые студентам факультета экономики и управления для дальнейшего изучения некоторых специальных дисциплин в вузе нефтяного профиля, а также приводится описание 5 лабораторных работ, во время выполнения которых студенты на практике знакомятся с характерными реакциями различных классов органических соединений и с индивидуальными особенностями их важнейших представителей.
Пособие предназначено для студентов специальностей 060800- «Экономика и управление на предприятиях нефтегазовой отрасли», 061100 -«Менеджмент».
Издание подготовлено на кафедре органической химии и химии нефти.
Рецензент - проф. Р.З. Сафиева
Российский государственный университет нефти и газа им. И.М. Губкина, 2003.
С О Д Е Р Ж А Н И Е стр.
1. Введение……………………………………………………… ...5
2. Техника безопасности при проведении лабораторных работ малого практикума по органической химии……………………..6
3. Лабораторная работа № 1.КАЧЕСТВЕННЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ………………………………9
4. Лабораторная работа № 2. ПЕРВИЧНАЯ ПЕРЕГОНКА НЕФТИ……………………………………………………………..14
5. Лабораторная работа № 3.МЕТОДЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОРОДОВ…………….19
6. Лабораторная работа № 4. КИСЛОРОД- И АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ГЕТЕРОАТОМНЫЕ СОЕДИНЕНИЯ НЕФТЕЙ………..………34
7. Лабораторная работа № 5. ПОЛУЧЕНИЕ И СВОЙСТВА НЕКОТОРЫХ ПРАКТИЧЕСКИ ВАЖНЫХ ПРОДУКТОВ НА ОСНОВЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ………………………51
8. Литература…………………………………………………………62
В В Е Д Е Н И Е
Курс органической химии для студентов факультета экономики и управления РГУ нефти и газа им. И.М. Губкина является базой для последующего изучения ими некоторых специальных дисциплин (например, «технологии переработки нефти»). Курс состоит из лекционного (теоретического) материала и так называемого «малого практикума», во время которого студенты практически знакомятся с методикой, приемами работы с органическими соединениями, из которых в основном и состоит нефть.
Лабораторные работы обращают внимание студентов на фактические свойства органических соединений: растворимость, горючесть, характер пламени, температура кипения и температура плавления и др. Студенты проводят опыты, демонстрирующие основные химические свойства изучаемых органических соединений, отдельные методы их получения.
Специальная лабораторная работа знакомит студентов с процессом первичной перегонки нефти.
Практическая реализация основных положений органической химии, излагаемых в лекционном курсе, повышает интерес студентов к предмету, помогает им в дальнейшем использовать полученные знания в решении проблем, возникающих при организации поиска, добычи и переработки нефти и газа, где знание основных свойств органический соединений необходимо.
К выполнению практических работ можно приступать только после предварительного ознакомления с теорией по теме работы.
Лабораторная работа № 1
КАЧЕСТВЕННЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органическая химия - это химия углеводородов и их производных.
В состав углеводородов входят элементы углерод и водород. В составе производных углеводородов кроме углерода и водорода могут содержаться кислород, азот, сера, галогены и другие элементы.
Для обнаружения в составе органического соединения тех или иных элементов требуется разрушение его молекулы и перевод составляющих его элементов в простейшие соединения.
Анализ элементного состава может проводиться как качественное определение элементов, входящих в состав органических соединений (С, Н, О, N, S, Cl), так и количественное, показывающее процентное содержание каждого элемента в анализируемом органическом соединении.
Присутствие тех или иных элементов в органическом соединении может быть обнаружено различными методами качественного анализа.
Качественное определение углерода и водорода основано на сжигании органических веществ. При этом углерод окисляется до двуокиси углерода, а водород – до воды.
Образующийся углекислый газ улавливается бариевой или кальциевой водой. Вода обнаруживается по появлению капель на холодных стенках пробирки или по изменению окраски (посинение) прокаленного белого порошка медного купороса.
Для обнаружения азота, серы и галогенов в органических соединениях их полностью разрушают прокаливанием в присутствии активных металлов (металлического натрия). При этом азот частично образует с углеродом и натрием цианистую соль, которую легко обнаружить качественно по образованию комплексного цианида – берлинской лазури. Сера и галогены переходят в неорганические соли (сульфиды и хлориды).
Сернистый натрий с нитропруссидом натрия дает малиновое окрашивание, а с азотнокислым свинцом - черный осадок (или темно-коричневую окраску).
Галогены можно обнаружить качественной пробой Бейльштейна по изменению окраски пламени при внесении медной проволоки с пробой анализируемого вещества в пламя газовой горелки, что объясняется образованием летучих при высокой температуре галогенидов меди. Эта проба чувствительна даже на присутствие следов галогена в органических соединениях.
Некоторое представление о химической природе вещества может дать его поведение при горении. Сильно коптящее пламя горящих паров вещества указывает на высокое содержание углерода. В большинстве случаев органические вещества горят и легко воспламеняются.
Опыт 1. Горение толуола и спирта
В фарфоровую чашечку наливают ≈1 мл этилового спирта и поджигают. Спирт горит почти бесцветным пламенем:
 С2Н5ОН + 3 О2 2СО2 + 3 Н2О
С2Н5ОН + 3 О2 2СО2 + 3 Н2О
В другую фарфоровую чашечку помещают ≈ 1 мл толуола. При поджигании толуол горит коптящим пламенем. При внесении в пламя стеклянной пластинки или палочки на них образуется слой копоти:
 2 С6Н5СН3 + 6 О2 3 СО2 + 9 С + 6 Н2О
2 С6Н5СН3 + 6 О2 3 СО2 + 9 С + 6 Н2О
Таким образом, по характеру горения можно сделать вывод о том, что % -ое содержание углерода в толуоле выше, чем в спирте.
Следует иметь в виду, что при горении толуола в избытке кислорода весь углерод окисляется до двуокиси углерода:
 2 С6Н5СН 3 + 15 О2 12 СО2 + 6 Н2О
2 С6Н5СН 3 + 15 О2 12 СО2 + 6 Н2О
Опыт 2. Обнаружение углерода и водорода в глицерине
В сухую пробирку, закрытую пробкой с газоотводной трубкой, помещают 0,2 г оксида меди (II) (CuO) и 2-3 капли глицерина. Пробирку со смесью осторожно нагревают, конец газоотводной трубки вводят в другую пробирку, содержащую известковую воду ( раствор Ca(OH)2 ) или баритовую воду ( раствор Ba(OH)2), так, чтобы конец трубки был опущен в жидкость. Углекислый газ легко обнаруживается по появлению осадка малорастворимого углекислого кальция или бария. Образование воды наблюдается по появлению капель на холодных стенках пробирки и трубки:
 С3Н8О3 + 7 CuO 3 CO2 + 4 H2O + 7 Cu
С3Н8О3 + 7 CuO 3 CO2 + 4 H2O + 7 Cu

 СO2 + Ca(OH)2 CaCO3 + H2O
СO2 + Ca(OH)2 CaCO3 + H2O
Опыт 3. Качественное определение азота и серы
В пробирку помещают исследуемое органическое вещество, содержащее азот и серу ( обычно для этой цели используют войлок), и небольшой кусочек металлического натрия. Пробирку прокаливают до прекращения выделения газообразных веществ. При этом разрушается структура органического соединения и все входящие в органическое соединение элементы образуют с натрием водорастворимые соли. Горячую пробирку быстро опускают в фарфоровый стаканчик с 5-6 мл воды так, чтобы пробирка лопнула и содержимое ее перешло в раствор. Раствор отфильтровывают через фильтр и делят его на 3 части ( в 3 пробирки).
а) Проба на азот.
Берут 1-2 мл полученной жидкости, затем добавляют 4-5 капель раствора FeSO4 и кипятят 1 мин на пламени горелки, охлаждают, подкисляют разбавленной соляной кислотой и прикапывают раствор хлорного железа FeCl3. Образование синего осадка берлинской лазури указывает, что исходное вещество содержит азот:
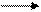 Na + O2 + RCN NaCN+ CO2 + Na2S + H2O
Na + O2 + RCN NaCN+ CO2 + Na2S + H2O
_______________
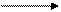 1. 2 NaCN + FeSO4 Fe(CN )2 + Na 2SO4
1. 2 NaCN + FeSO4 Fe(CN )2 + Na 2SO4
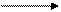 2. Fe(CN)2 + 4 NaCN Na4[Fe(CN)6]
2. Fe(CN)2 + 4 NaCN Na4[Fe(CN)6]

 3. 3 Na4[Fe(CN)6] + FeCl3 Fe4[Fe(CN)6]3 + 12 NaCl
3. 3 Na4[Fe(CN)6] + FeCl3 Fe4[Fe(CN)6]3 + 12 NaCl
б) Проба на серу
Ко второй части отфильтрованного раствора прибавляют 1 каплю раствора нитропруссида натрия.
Появление ярко-фиолетового окрашивания указывает на наличие серы:
 Na2S + Na2[Fe(CN)5NO] 2 Na3[Fe(CN)5ONSNa]
Na2S + Na2[Fe(CN)5NO] 2 Na3[Fe(CN)5ONSNa]
в) Присутствие серы можно также определить прибавлением нескольких капель исследуемой жидкости к раствору ≈ 1 мл нитрата свинца (II) в растворе едкого натра. При этом образуется темно-коричневый или черный осадок (PbS) сульфида свинца (II):

 Pb(NO3)2 + Na2S PbS + 2 NaNO3
Pb(NO3)2 + Na2S PbS + 2 NaNO3
Опыт 4. Определение галогенов.
Медную проволочку (предварительно хорошо прокаленную) опускают в исследуемое вещество и снова вносят в пламя горелки. В присутствии галогенов пламя принимает зеленую окраску, что объясняется образованием летучих при высокой температуре галогенидов меди. Проба очень чувствительна даже на следы галогена в соединении.
Этот способ качественного обнаружения галогена в органическом веществе был предложен в 1872 году русским академиком Ф.Ф. Бейльштейном и получил название “проба Бейльштейна”.
Контрольные вопросы для самопроверки:
1. Что изучает органическая химия?
2. Какие элементы могут входить в состав органического соединения?
3. Назовите элементы, встречающиеся в органических соединениях в наибольших количествах.
4. Напишите уравнения реакций горения на воздухе этилового спирта и бензола. Какова разница в характере горения?
5. Каким образом можно качественно определить наличие углерода и водорода в органическом соединении?
6. В чем заключается качественная реакция на присутствие азота в органическом соединении?
7. Как качественно определить наличие серы в органическом соединении?
8. Что такое “проба Бейльштейна”?
Лабораторная работа № 2
ПЕРВИЧНАЯ ПЕРЕГОНКА НЕФТИ
Введение.
Наиболее важными источниками углеводородов являются нефть и горючие (природные и попутные) газы.
Природными называются газы, образующие самостоятельное месторождение. Главным компонентом их является метан (до 96-98%).
Попутными называются газы, сопровождающие нефть при её добыче. Наряду с метаном (содержание до 70 %) в них содержатся также этан, пропан, бутан и пары низкомолекулярных жидких углеводородов.
Следует отметить, что в состав и природных, и попутных газов входят наряду с углеводородами, некоторые неорганические газы – например, азот, сероводород, гелий, углекислый газ и др.
Нефть представляет собой сложную смесь органических веществ, главным образом, углеводородов. Все нефти содержат метановые углеводороды (алканы), нафтеновые (циклоалканы) и ароматические углеводороды (арены). Количественное содержание этих углеводородов в различных нефтях неодинаково и также зависит от месторождения. Кроме того, в нефтях имеются в небольших количествах органические соединения, содержащие кислород, серу, азот. В нефти также содержатся минеральные вещества в виде различных солей. В небольших количествах в нефти могут быть растворены углеводородные газы.
Перегонка нефти – процесс разделения ее на фракции по температурам кипения (отсюда термин «фракционирование») – лежит в основе переработки нефти и получения при этом моторного топлива, смазочных масел и различных других ценных химических продуктов. Первичная перегонка нефти является первой стадией изучения ее химического состава.
Основные фракции, выделяемые при первичной перегонке нефти:
1. Бензиновая фракция – нефтяной погон с температурой кипения от н.к. (начала кипения, индивидуального для каждой нефти) до 150-205 0С (в зависимости от технологической цели получения авто-, авиа-, или другого специального бензина).
Эта фракция представляет собой смесь алканов, нафтенов и ароматических углеводородов. Во всех этих углеводородах содержится от 5 до 10 атомов С.
2. Керосиновая фракция – нефтяной погон с температурой кипения от 150-180 0С до 270-280 0С. В этой фракции содержатся углеводороды С10-С15.
Используется в качестве моторного топлива (тракторный керосин, компонент дизельного топлива), для бытовых нужд (осветительный керосин) и др.
3. Газойлевая фракция – температура кипения от 270-280 0С до 320-350 0С. В этой фракции содержатся углеводороды С14-С20. Используется в качестве дизельного топлива.
4. Мазут – остаток после отгона выше перечисленных фракций с температурой кипения выше 320-350 0С.
Мазут может использоваться как котельное топливо, или подвергаться дальнейшей переработке – либо перегонке при пониженном давлении (в вакууме) с отбором масляных фракций или широкой фракции вакуумного газойля (в свою очередь, служащего сырьем для каталитического крекинга с целью получения высокооктанового компонента бензина), либо крекингу.
5. Гудрон - почти твердый остаток после отгона от мазута масляных фракций. Из него получают так называемые остаточные масла и битум, из которого путем окисления получают асфальт, используемый при строительстве дорог и т.п. Из гудрона и других остатков вторичного происхождения может быть получен путем коксования кокс, применяемый в металлургической промышленности.
Порядок выполнения работы.
В колбу Вюрца объемом 100 мл наливают 50 мл сырой нефти. Колбу закрывают пробкой с термометром и соединяют через прямой холодильник и алонж с приемником (как показано на рис. 1).
Массу взятой нефти вычисляют по формуле m=V×r, где V-объем нефти, а r - ее плотность. Приемниками (сменными) служат 3 плоскодонные колбочки, предварительно взвешенные.
Колбу Вюрца с нефтью осторожно нагревают на песчаной бане, или на асбестовой сетке, или на воронке Бобо.
Начало кипения (н.к.) первой фракции фиксируют по температуре поступления первой капли бензина в приемник, после чего отбирают фракцию, выкипающую до 180 0С. При отборе этой фракции по достижении температуры 135 0С прекращают подачу воды в холодильник. При достижении температуры 180 0С меняют колбу I- I приемник и отбирают керосиновую фракцию с температурой кипения 180-270 0С, а затем снова, сменив приемник, отбирают газойлевую фракцию (270-320 0С, или 270- 350 0С).
Приемники с отобранными фракциями взвешивают и по разности масс колбы с продуктом и пустой колбы вычисляют массу каждой фракции. С помощью цилиндров определяют объем каждой фракции и вычисляют их плотность. Убеждаются, что плотность фракции растет с увеличением температуры их кипения.
Затем бензиновые фракции со всех установок сливают в один мерный цилиндр, керосиновые - в другой, а газойлевые – в третий, и определяют экспериментально плотность каждой фракции с помощью ареометров. Эти данные сравнивают с вычисленными. Рассчитывают объемный и весовой выход каждой фракции, в соответствии с количеством исходной нефти, равной 100%. Все полученные результаты вносят в табл.1.

Рис. 1. Прибор для перегонки нефти.
Таблица 1.
Материальный баланс фракционной перегонки нефти
| Название Продукта | Пределы кипения фракции, 0С | Объем, см3 | Масса, г | Плотность, r | Выход фракции, % | ||
| вычис. | эксп. | объемн. | весов. | ||||
| Всего взято: Нефть | 100,0 | 100,0 | |||||
| Получено: | |||||||
| 1. Бензин | н.к. - 180 0С | ||||||
| 2. Керосин | 180 - 270 0С | ||||||
| 3. Газойль | 270 - 320 0С | ||||||
| 4.Мазут + потери (по разности) | > 320 0С | ||||||
| Всего получено: | 100,0 | 100,0 |
Контрольные вопросы
1. В каких пределах может изменяться плотность нефти?
2. Как изменяется плотность фракции в зависимости от температуры кипения?
3. Какими двумя методами можно определить плотность нефтепродукта?
4. Какие углеводороды входят в состав бензиновой фракции, керосиновой фракции, газойлевой фракции и мазута?
5. В какой из фракций содержатся углеводороды С8Н18? С6Н6? С6Н5 -С2Н5?
6. Как определяют температуру кипения фракции?
7. Расскажите об использовании:
а) бензиновой фракции; б) керосиновой фракции;
в) газойлевой фракции; г) мазута;
д) гудрона; е) битума.
6. Как вычисляют объемный (или массовый) выход любой фракции при перегонке?
Лабораторная работа № 3
МЕТОДЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОРОДОВ
(алканы, алкены, алкины, арены)
Углеводороды - соединения, состоящие из углерода и водорода, являющиеся родоначальниками всех других классов органических соединений.
Углеводороды могут отличаться как строением углеродного скелета, так и характером С-С – связей.
Алканы( предельные, насыщенные углеводороды) - соединения, в молекулах которых атомы углерода связаны между собой одинарной связью, а все остальные валентности насыщены атомами водорода. Они образуют гомологический ряд с общей формулой СnН2n+2 и имеют сходное строение и химические свойства.
Предельные углеводороды в природе наряду с углеводородами других рядов (циклопарафинами и ароматическими) входят в состав нефтей. Низшие представители находятся в природном (метан) и попутном ( метан, этан, пропан, бутаны) газах.


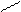
 Углеводороды с двойной связью - алкены (этиленовые) характеризуются наличием в их молекуле двойной связи между углеродными атомами С ═ С .
Углеводороды с двойной связью - алкены (этиленовые) характеризуются наличием в их молекуле двойной связи между углеродными атомами С ═ С .
Этиленовые углеводороды образуют гомологический ряд с общей формулой СnН2n.
Основной источник этиленовых углеводородов - продукты нефтепереработки (термического и каталитического крекинга и пиролиза).
Углеводороды с тройной связью - алкины (ацетиленовые) - непредельные углеводороды, в молекулах которых имеется тройная связь между углеродными атомами − С ≡ С −.
Простейшим представителем этого ряда является ацетилен состава С2Н2 .
Общая формула гомологического ряда - СnН2n-2 .
 |
Ароматическими углеводородаминазываются соединения, в молекулах которых имеется особаяциклическая группировка из шести углеродных атомов - бензольное кольцо. Простейшее вещество, содержащее такую группировку - бензол; все остальные ароматические соединения рассматриваются как его производные. Бензол имеет состав С6Н6 и структурную формулу
По своему составу, казалось бы, бензол представляет сильно непредельное соединение. Однако, он не дает характерных реакций для непредельных соединений ( не обеспечивает бромную воду и раствор марганцовокислого калия), и в обычных условиях не склонен к реакциям присоединения.
Характерные реакции для ароматических углеводородов - реакции замещения водорода в бензольном кольце: сульфирование, нитрование, галогенирование, алкилирование, ацилирование.
Атомы углерода в бензольном кольце равноценны, поэтому не имеет значения, при каком из них произошло замещение водорода.
Однако, если в молекуле арена уже имеется заместитель, то следующий заместитель вступает не в любое, а в строго определенное положение по отношению к первому.
С этой точки зрения все заместители делятся на две большие группы.
Ориентанты ( заместители) первого рода - облегчают реакции замещения (кроме галогенов), посылают следующий заместитель в орто- и пара-положения по отношению к первому ( т.е. уже имеющемуся).
Это: Alk - (CH3-, CH3-CH2-, C3H7- и т.п.)
-OH
-NH2
-Hal (-Cl, -Br)
Ориентанты II рода - затрудняют реакции замещения, посылают следующий заместитель в мета-положение по отношению к уже имеющемуся.




 Это: O
Это: O

 NO2, −SO3H, −COOH , −C , − C≡N
NO2, −SO3H, −COOH , −C , − C≡N
H
Примеры:
1.
 |
Сульфирование толуола
орто-сульфотолуол пара-сульфотолуол
орто-метилбензолсульфо- пара-метилбензолсульфо-
кислота кислота
1-метил-2-сульфобензол 1-метил-4-сульфобензол
2. Бромирование бензойной кислоты
 |
АЛКАНЫ
Опыт 1. Получение и горение метана
В ступке растирают одну част ацетата натрия с двумя частями натронной извести. (Натронная известь представляет собой смесь Са(ОН)2 и NaOH). Смесь пересыпают в сухую пробирку с газоотводной трубкой и нагревают.
Поджигают выделяющийся из трубки метан. Он спокойно горит голубоватым пламенем:



 O
O

 СН3−С + Н−ОNa CH4 + Na2CO3
СН3−С + Н−ОNa CH4 + Na2CO3
ONa
 CH4 + 2 O2 CO2 + 2 H2O
CH4 + 2 O2 CO2 + 2 H2O
Опыт 2. Химические свойства гексана
Гексан представляет собой бесцветную прозрачную жидкость с характерным запахом. Температура кипения 68,7о С, ρ425 = 0,6548.
а) Отношение к кислотам и щелочам
В две пробирки наливают по 1 мл гексана. В первую вносят 0,5 мл конц. Н2SO4, во вторую - 0,5 мл раствора NaOH. Пробирки встряхивают, отмечают отсутствие в них каких-либо внешних изменений.
б) Отношение к окислителям
В пробирку наливают ~1 мл гексана. Туда же вносят ~1 мл раствора перманганата калия. Встряхивают. Отмечают, что изменений не происходит - реакция не идет.
в)Отношение к галогенам
В пробирку с ~1мл гексана, добавляют ~ 0,5 мл бромной воды. Отмечают, что обесцвечивания не происходит - реакция не идет.
АЛКЕНЫ
Опыт 3. Получение и свойства этилена.
Готовят две пробирки с бромной водой и с раствором перманганата калия. В третью пробирку с газоотводной трубкой помещают 1 мл этилового спирта и, осторожно взбалтывая, приливают 1 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку и начинают медленно и осторожно нагревать до начала равномерного выделения газа. Реакционная смесь при этом темнеет из-за выделения углерода (в результате побочных процессов):

Побочные реакции:

Как только из реакционной пробирки начинает выделяться этилен, газоотводную трубку опускают поочередно в пробирки с бромной водой и перманганатом калия. Наблюдают, как при пропускании газа через приготовленные растворы они постепенно обесцвечиваются (во время опыта полезно время от времени вынимать из пробирок с раствором брома и перманганата калия подводящую газ трубочку и встряхивать пробирку):

Затем, не прекращая нагревания пробирки со смесью спирта и кислоты, газоотводную трубку поворачивают отверстием вверх и зажигают выделяющийся этилен. На внесенной в пламя этилена фарфоровой чашке появляется черное пятно сажи:
 |
Опыт 4. Бромирование гексена-1 и стирола.
В одну пробирку помещают 1мл гексена-1, в другую 1 мл стирола. Добаляют в каждую по 0,5 мл бромной воды. Встряхивают пробирки, наблюдают почти мгновенное исчезновение окраски брома в обеих пробирках.


 Н2С =СН-СН2-СН2-СН2-СН3 + Br2 Н2С-СН-СН2-СН2-СН2-СН3
Н2С =СН-СН2-СН2-СН2-СН3 + Br2 Н2С-СН-СН2-СН2-СН2-СН3
раствор Br Вr
 |
Наличие атомов брома в полученных соединениях определяют пробой Бейльштейна (изменение окраски пламени при внесении в пламя горелки медной проволоки с анализируемым образцом).
Опыт 5. Взаимодействие с серной кислотой.
В пробирку с 1 мл гексена-1 добавляют 0,5 мл конц. серной кислоты. Осторожно встряхивают пробирку. Наблюдают постепенное исчезновение двух слоев жидкостей вследствие поглощения алкена серной кислотой - образования алкилсерного эфира.

 Н2С=СН-СН2-СН2-СН2-СН3 + Н2SO4 CH3CHCH2CH2CH2CH3
Н2С=СН-СН2-СН2-СН2-СН3 + Н2SO4 CH3CHCH2CH2CH2CH3
OSO3H
Опыт 6. Полимеризация стирола
В фарфоровую чашечку помещают ~ 1 мл стирола и добавляют 1-2 капли конц. H2SO4 . Постепенно вязкость жидкости повышается вследствие полимеризации стирола, на поверхности фарфоровой чашки образуется глянцевая пленка полистирола:
 |
АЛКИНЫ
Опыт 7. Получение и свойства ацетилена
В двух пробирках готовят водные растворы брома и перманганата калия (последний слегка подкисляют серной кислотой). В третью сухую пробирку помещают кусочек карбида кальция. Осторожно приливают в эту пробирку 3 мл воды и сразу же закрывают ее пробкой с газоотводной трубкой. Выделяющийся ацетилен пропускают поочередно через растворы брома и перманганата калия. Отмечают обесцвечивание растворов:


 СаС2 + Н2О Са(ОН)2 + НС ≡НС
СаС2 + Н2О Са(ОН)2 + НС ≡НС

 +Br2 Br Br
+Br2 Br Br






 НС ≡ НС + Br2 НС = НС НС - НС
НС ≡ НС + Br2 НС = НС НС - НС
Br Br Br Br
KMnO4
 НС ≡ НС 2 CO2 + H2O
НС ≡ НС 2 CO2 + H2O
H2SO4
Затем газоотводную трубку переворачивают вверх и зажигают выделяющийся ацетилен. Обращают внимание на яркий цвет пламени.
 2С2Н2 + 5 О2 4 СО2 + 2 Н2О + Q
2С2Н2 + 5 О2 4 СО2 + 2 Н2О + Q
АРЕНЫ
Опыт 8. Бромирование бензола, толуола и фенола.
В две пробирки (в одну из них предварительно насыпают немного ~0,5 г железных опилок) помещают по 1 мл бензола, в третью наливают 1 мл толуола.
В каждую из пробирок доливают по 0,5 мл бромной воды и встряхивают. Наблюдают переход брома из воды в бензол и толуол.
Бромирование толуола протекает медленно на холоду, быстрее при нагревании на водяной бане, что видно по скорости исчезновения окраски брома.
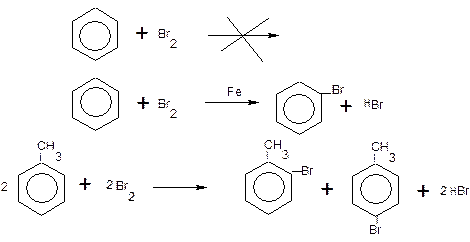 |
Бромирование бензола происходит только при нагревании на водяной бане в присутствии катализатора. В пробирке с бензолом без катализатора окраска брома не исчезает и при кипячении, реакция не идет.
Опыт 9.Окисление бензола и толуола.
В две пробирки помещают по 1 мл раствора перманганата калия и 4 капли разбавленной серной кислоты и затем добавляют в одну пробирку 2 мл бензола, а в другую – такое же количество толуола. Сильно встряхивают обе пробирки. Наблюдают, что смесь, содержащая бензол, не изменяет окраски, а в пробирке с толуолом розовая окраска постепенно исчезает.
Бензол весьма устойчив к действию окислителей. Гомологи бензола окисляются сравнительно легко с образованием бензойной кислоты:
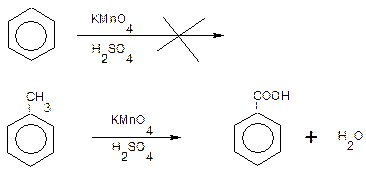 |
разб.
Опыт 10. Нитрование нафталина.
В пробирку с 0,5 г нафталина добавляют 2 мл концентрированной азотной кислоты. При встряхивании смесь начинает желтеть уже при комнатной температуре. Смесь нагревают на кипящей водяной бане 5 мин и выливают в пробирку с холодной водой. α- Нитронафталин выделяется в виде оранжевого масла, быстро твердеющего при встряхивании:

α- нитронафталин
Опыт 11. Сульфирование толуола
В пробирку наливают 1 мл толуола и добавляют 1 мл концентрированной серной кислоты. Нагревают пробирку на водяной бане, постепенно встряхивая. Наблюдают увеличение кислотного слоя за счет растворившихся в нем орто- и пара- толуолсульфокислот:
 |
орто- и пара-толуолсульфокислоты
Опыт 12. Конденсация с формалином
(формалитовая реакция – качественная проба на присутствие ароматических соединений)
 |
В фарфоровую чашечку наливают 4 капли чистой концентрированной кислоты, затем прибавляют 2 капли формалина и 2-3 капли испытуемого продукта (сначала гексана, затем толуола). При отсутствии ароматических углеводородов смесь остается бесцветной или слегка желтеет. Яркое окрашивание, а часто выделение осадка указывает на наличие ароматических углеводородов. Если реакция получилась неясной, в конце нужно добавить еще 2-3 капли серной кислоты:
Опыт 12. Контрольная задача.
Получают у лаборанта 3 пробирки с веществами - в одной находится гексан, в другой – часть бензиновой фракции, полученной при перегонке нефти в лабораторной работе № 2, а в третьей – крекинг-бензин. Бензин прямой гонки содержит смесь метановых, нафтеновых и ароматических углеводородов. Крекинг-бензин, помимо этих классов углеводородов, содержит также в небольшом количестве непредельные углеводороды.
Учитывая разницу в химических свойствах углеводородов различных рядов, определяют, какое вещество находится в каждой пробирке.
Контрольные вопросы.
1. Напишите схему реакции получения метана из ацетата натрия. Реагирует ли метан с бромной водой и раствором перманганата калия?
2. Напишите схемы реакций бромирования этилена, пропилена, ацетилена, метилацетилена, стирола, фенола, анилина, нитробензола, бензола и толуола. Укажите, в каких реакциях необходимо использовать катализатор (и какой)? В чем принципиальная разница между бромированием непредельных и ароматических соединений?
3. Напишите схемы реакций гидробромирования этилена, пропилена, ацетилена и метилацетилена.
4. Напишите схемы реакций дегидратации, протекающих при нагревании с серной кислотой
а)этанола
б)бутанола-2
в)2-метилпропанола-2
5. Напишите схему получения ацетилена из карбида кальция.
6. Напишите схемы реакций окисления раствором перманганата калия
а) этилена
б) пропилена
в) ацетилена
г) толуола
д) этилбензола
7. В чем суть “формалитовой реакции”? Напишите соответствующую схему реакции.
8. Напишите уравнения реакций сульфирования
а) бензола
б) толуола
в) фенола
9. Напишите схемы реакций нитрования:
а) бензола, б) толуола, в) нафталина.
Лабораторная работа № 4.
КИСЛОРОД- И АЗОТСОДЕРЖАЩИЕ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ.
ОН ОН


 СН2-СН-СН2 -1,2,3 –пропантриол - глицерин
СН2-СН-СН2 -1,2,3 –пропантриол - глицерин
ОН ОН ОН
Фенолы – гидроксилпроизводные ароматических углеводородов, у которых гидроксил непосредственно связан с ароматическим кольцом.
 |
Примеры:
Фенол орто- крезол
2-метилфенол

Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...