
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Нормальные условия: температура – 273 К, давление – 101325 Па.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Задание 1. Даны вещества (см. вариант в табл. 1). Укажите класс соединения. По формуле соединения определите молярную массу эквивалента Мэ, степень окисления и процентное содержание каждого элемента. Составьте структурную формулу соединения.
Т а б л и ц а 1
| Номер варианта | Соединение | Номер варианта | Соединение |
| НClO4, Al(OH)3, K2O In2O3, H2Cr2O7, NiCl2 KHCO3, H2SO3, P2O5 Ca(OH)2, H2ZnO2, SO3 Fe(OH)2Cl, BrF3, PbO2 FeS2, H3AsO4, OF2 ClO2, H3BO3, Zn(OH)2 I2O5, Ca3(PO4)2, H2Se H2O2, K2GeO3, HClO K2MnO4, NO2, H2S CoO(OH), HgSO4, NH3 N2H4, Sr(OH)2, HNO2 NH2OH, HАlO2, N2O5 O2F2, H3AlO3, CaCl2 K2SO3, Cr(OH)3, BaO2 | MgCO3, H2SnO2, CrO3 H2SeO3, Na2O2, BCl3 V2O5, H2PbO3, Na2SiO3 H3SbO4, Mn(OH)2, SO2 Cr2(SO4)3, Fe(OH)2, HCl Na3VO4, B(OH)3, KH HClO2, Na2HPO4, LiH HIO,GeO2,(FeOH)SO4 KClO, Pb(OH)2, CH4 NaBiO3, HAsO2, Cu2O AuCl3, Ba(CrO2)2, HBr FeSO4,Cu(OH)2, Sb2O3 PbCrO4, MoO3, Ni(OH)2 MgOHCl, ClO2, H2WO4 CaO2, H2TeO2, Al2S3 |
Задание 2. Рассчитайте молярную массу эквивалента Мэ двухвалентного металла, если при его взаимодействии массой mMe (см. вариант в табл. 2) с кислотой выделяется водород объемом V(H2), измеренный при определенной температуре и давлении. Назовите металл.
Нормальные условия: температура – 273 К, давление – 101325 Па.
Т а б л и ц а 2
| Номер варианта | mMe, г | V(H2), мл | Т, °С | Р, Па | Номер вари-анта | mMe, г | V(H2), мл | Т, °С | Р, Па |
| 1,172 0,5 0,512 0,2 0,755 | 1,493 0,835 0,606 1,192 1,57 |
О к о н ч а н и е т а б л. 2
| Номер вари-анта | mMe, г | V(H2), мл | Т, °С | Р, Па | Номер вари-анта | mMe, г | V(H2), мл | Т, °С | Р, Па |
| 2,536 1,085 1,57 0,905 1,0 0,432 2,314 0,464 0,312 3,726 | 105 105 | 0,3 0,175 1,44 1,186 0,473 0,94 0,505 1,557 1,647 0,5 |
Задание 3. На нейтрализацию кислоты массой mкисл израсходовано некоторое количество гидроксида mосн(см. вариант в табл. 3). Рассчитайте молярную массу эквивалента кислоты и гидроксида. Напишите соответствующие молекулярные и ионно-молекулярные уравнения реакций.
Т а б л и ц а 3
| Номер варианта | mкисл,г | mосн, г | Номер варианта | mкисл, г | mосн, г | ||||
| Н3РО4 Н3РО4 Н3РО4 Н3РО4 Н3РО4 H2SO4 H2SO4 HCl HNO3 H2SO4 Н3РО4 Н3РО4 HCl HCl HCl | 0,35 1,0486 0,49 0,233 0,49 0,326 0,18 0,312 0,63 0,27 0,1225 0,175 0,78 0,337 0,136 | КОН NaOH NaOH KOH KOH KOH NaOH Zn(OH)2 Zn(OH)2 KOH KOH KOH Al(OH)3 Al(OH)3 Al(OH)3 | 0,2 0,428 0,4 0,4 0,56 0,186 0,147 0,85 0,497 0,309 0,14 0,3 0,833 0,24 0,291 | H2S H2S Н3РО4 Н3РО4 H2SO4 HCl HCl Н3РО3 Н3РО3 HI HI H2CO3 H2CO3 H2CO3 H2CO3 | 0,145 0,206 0,2 0,278 0,4165 0,44 0,63 0,4715 0,82 0,8 1,21 0,248 0,16 0,124 0,48 | NaOH KOH KOH NaOH NaOH Fe(OH)2 Fe(OH)2 KOH NaOH Mg(OH)2 Mg(OH)2 NaOH KOH NaOH KOH | 0,34 0,34 0,343 0,34 0,34 0,542 1,533 0,644 0,4 0,182 0,55 0,16 0,29 0,16 0,433 | ||
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
В РАСТВОРАХ
Перераспределение химических связей, происходящее в процессе превращения одних веществ в другие, сопровождается изменением электронного состояния частиц – атомов, молекул, ионов, участвующих в реакции.
Изменение электронного состояния может явиться результатом практически полной передачи электронов от одних реагирующих частиц другим, тогда образуются или исчезают ионы:
2 Na0 + Cl20 = 2Na+ + 2Cl–.
Передача электрона может быть и неполной – меняется лишь полярность связей. Например, в реакции
СН4 (г) + 2 Cl2 (г) = С (к) + 4 HCl (г)
вместо малополярных связей С – Н появляются сильнополярные связи Н – Cl.
Реакции, сопровождающиеся переносом электронов от одной частицы к другой, называются окислительно-восстановительными (ОВР). В процессе передачи электронов в ОВР участвуют два партнера: два вещества, или две частицы, или два атома внутри одной частицы – окислитель и восстановитель.
Вещество (частица, атом, элемент), отдающее электроны, называется восстановителем; вещество, принимающее электроны, называется окислителем.
В качестве окислителей могут выступать любые вещества, содержащие элементы, способные понизить степень окисления, присоединив один или несколько электронов.
В качестве восстановителей могут выступать любые вещества, содержащие элементы, которые могут повысить степень окисления, отдав один или несколько электронов.
Степень окисления есть положительное или отрицательное число, которое по определенным правилам может быть приписано любому элементу в любом соединении и формально представляет собой гипотетический заряд на атоме этого элемента при допущении, что все гетероатомные химические связи чисто ионные.
Степень окисления (с.о.) определяется по следующим правилам.
1. Степень окисления элемента в простом веществе равна нулю.
2. Степень окисления элемента, находящегося в состоянии одноатомного иона, равна заряду этого иона.
3. В ковалентном соединении электронные пары связи полностью относят к более электроотрицательному элементу и степенью окисления считают образующиеся при этом заряды.
4. Алгебраическая сумма степеней окисления всех элементов нейтральной молекулы равна нулю, в сложном ионе – заряду иона.
При этом нужно помнить:
1. Фтор, как самый электроотрицательный элемент, всегда имеет с.о. –1.
2. Кислород имеет с.о. –2, за исключением: а) фторидов, в которых его с.о. положительна, б) пероксида водорода и его производных, в которых с.о. кислорода равна –1.
3. Водород в соединениях с неметаллами имеет с.о. +1, а в соединениях с активными металлами –1.
4. Щелочные металлы во всех соединениях имеют с.о. +1, щелочноземельные металлы +2.
5. Положительная степень окисления элемента не может превышать числа валентных электронов.
6. Отрицательная степень окисления нехарактерна для s- и
d-элементов, а для р-элементов она, как правило, равна n – 2, где
n – число валентных электронов.
7. В формулах бинарных соединений элемент, стоящий на втором месте, имеет отрицательную степень окисления.
8. Знак степени окисления записывается перед цифрой над символом химического элемента.
В окислительно-восстановительной реакции восстановитель окисляется, а окислитель восстанавливается. Различают следующие случаи ОВР.
Межмолекулярное окисление – восстановление, когда окислитель и восстановитель участвуют в реакции как разные вещества (или входят в состав разных частиц):

Внутримолекулярное окисление – восстановление, когда окислитель и восстановитель входят в состав одного вещества, одной молекулы:

Самоокисление – самовосстановление, когда окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления:
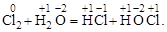
Реакции такого типа чаще называют реакциями диспропорционирования.
Подбор коэффициентов в ОВР основан на следующем положении: суммарное число электронов, отдаваемых восстановителем, должно быть равно суммарному числу электронов, принимаемых окислителем. Это положение сокращенно называют электронным балансом.
Нахождение электронного баланса можно вести двумя методами: 1) с использованием степеней окисления; 2) с использованием полуреакций восстановления и окисления.
Составим схему реакции:
NaBr + KMnO4 + H2SO4 ® Br2 + MnSO4 +. . . .
Первый метод – метод электронного баланса
1. Определим элементы, которые изменяют степень окисления в ходе реакции.
2. Составляем схемы переходов степеней окисления окислителя и восстановителя.
Переход окислителя: Mn+7 + 5e– = Mn+2
Переход восстановителя: 2Br– – 2e– = Br2
3. Составляем электронный баланс, умножая первое уравнение на 2, второе на 5. Наименьшее общее кратное равно десяти: восстановитель отдает 10е–, окислитель принимает 10е– :
| Mn+7 + 5e– = Mn+2 | |
| 2Br– – 2e– = Br2 |
4. Переносим эти основные коэффициенты в схему реакции – коэффициенты расставляем вначале перед окисленными формами, а затем перед восстановленными с учетом атомов элемента в молекуле вещества:
10 NaBr + 2 KMnO4 + H2SO4 ® 5 Br2 + 2 MnSO4 +... .
5. Дополняем продукты реакции теми веществами, которые образованы из ионов, не участвующих в окислении и восстановлении:
10 NaBr + 2 KMnO4 + H2SO4 ® 5 Br2 + 2 MnSO4 +
+ Na2SO4 + K2SO4 + . . . .
и находим для них коэффициенты, исходя из основных коэффициентов перед NaBr и KMnO4:
10 NaBr + 2 KMnO4 + H2SO4 ® 5 Br2 + 2 MnSO4 +
+ 5 Na2SO4 + K2SO4 + . . . .
6. Подсчитаем число ионов SO42– в правой части:
2 MnSO4 + 5 Na2SO4 + K2SO4 ® 8 SO4–2
и находим коэффициент 8 перед H2SO4:
10 NaBr + 2 KMnO4 + 8 H2SO4 ® 5 Br2 + 2 MnSO4 +
+ 5 Na2SO4 + K2SO4 + . . . .
7. Водород, переходя в воду вместе с атомами кислорода из ионов MnO4–, не меняет свою степень окисления. Из 16 атомов водорода, входящих в состав серной кислоты, и 8 атомов кислорода, входящих в состав пермангант-иона, получается 8 Н2О. Заканчиваем уравнение:
10 NaBr +2 KMnO4 + 8 H2SO4 ® 5 Br2 +2 MnSO4 +
+ 5 Na2SO4 + K2SO4 + 8Н2О.
Второй метод – метод ионно-электронного баланса
Метод основан на разделении окислительно-восстановительной реакции на две полуреакции. Полуреакция восстановления включает окисленную и восстановленную формы только одного элемента в виде частиц, реально существующих в растворе, и электроны, участвующие в процессе восстановления.
Составление полуреакций начинают с нахождения ионов и молекул, которые в процессе реакции изменяют свой заряд или состав или все одновременно.
В данном примере, Mn+7 в растворе находится в виде аниона состава MnO4–, который переходит в ион Mn+2.
1. Записываем схему перехода: MnO4– ® Mn+2.
2. Кислород не должен менять состояние окисления, поэтому при составлении уравнения следует перевести атомы (О–2) из состава аниона-окислителя в состав воды: MnO4– ® Mn+2 + Н2О.
Необходимые для этого атомы водорода в кислой среде берутся в виде ионов Н+: MnO4– + Н+ ® Mn+2 + Н2О.
3. Уравниваем количества атомов каждого элемента в левой и правой частях. Чтобы связать 4 атома кислорода, нужно 8 ионов водорода: MnO4– + 8 Н+ ® Mn+2 + 4 Н2О.
4. Теперь находим число электронов, участвующих в переходе. Для этого подсчитываем заряды частиц в левой (–1 + 8 = +7) и в правой (+2) частях схемы. Из уравнения +7 + хе– = +2 находим х = 5, т.е.
в процессе восстановления участвуют 5 электронов.
5. Получаем в окончательном виде уравнение полуреакции восстановления:
MnO4– + 8 Н+ + 5е– ® Mn+2 + 4 Н2О.
6. Аналогично составляем полуреакцию окисления восстановителя:
2 Br– – 2 e– = Br20.
7. Составляем электронный баланс, умножая первое уравнение на 2, второе на 5:
| MnO4– + 8 Н+ + 5е– ® Mn+2 + 4 Н2О | ´ 2 |
| 2 Br– – 2 e– = Br20 | ´5 |
8. Складываем оба уравнения, используя найденные коэффициенты, и получаем уравнение в ионной форме:
2 MnO4– + 16 Н+ + 10 Br– = 2 Mn+2 + 5 Br20 + 8 Н2О.
9. Сравниваем суммы зарядов частиц в левой (–2 – 10 + 16 = +4) и в правой (+4) частях уравнения. Они должны быть равны.
10. Переходим к молекулярной форме записи. Для этого нужно включить ионы, входящие в исходные вещества, но не участвующие в окислительно-восстановительном процессе – 2К+ (в 2 KMnO4), 10 Na+ (в 10 NaBr), 8 SO4–2 (в 8 H2SO4):
10 NaBr + 2 KMnO4 + 8 H2SO4 ® 5 Br2 + 2 MnSO4 +
+ 5 Na2SO4 + K2SO4 + 8Н2О.
Как правило:
a) в кислой среде в полуреакции восстановления связываем (O-2) в воду:
(О–2) + 2Н+ = Н2О.
Например, NO3– + 4H+ + 3e– = NO + 2H2O;
б) в полуреакции окисления берем (О–2) из воды:
Н2О = (О–2) + 2Н+.
Например, Br– + 3H2O – 6e– = BrO3– + 6H+ ;
в) в щелочной среде в полуреакции восстановления удаляем (О–2) в ионы гидроксида:
(О–2) + Н2О = 2ОН–.
Например, ClO4– + 4H2O + 8e– = Cl– + 8OH– ;
г) в полуреакции окисления берем (О–2) из ионов гидроксида:
2ОН– = (О–2) + Н2О.
Например, Cr(OH)3 + 5ОН– – 3е– = CrO42– + 4 H2O.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Задание. Дана окислительно-восстановительная реакция (номер реакции соответствует варианту).
1. Определите: а) окислитель и восстановитель, б) тип окислительно-восстановительной реакции, в) молярные массы эквивалента окислителя и восстановителя.
Энергетика
Химическая термодинамика
Термодинамика изучает возможность и невозможность самопроизвольного перехода системы из одного состояния в другое и энергетические эффекты этих переходов. Во многих случаях процессы в термодинамических системах протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота Q является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии, а при постоянном давлении – изменению энтальпии Н. Единица измерения энтальпии – кДж/моль. Изменение энтальпии DН равно тепловому эффекту химической реакции, протекающей в изобарно-изотермичес-ких условиях (р = const, T = const), когда единственным видом работы является работа расширения газа. Если DН < 0, процесс сопровождается выделением теплоты в окружающую среду (экзотермическая реакция), если DН > 0, процесс идет с поглощением теплоты (эндотермическая реакция).
Для того чтобы облегчить сравнение энтальпий различных химических реакций, используют понятие «стандартного состояния». Стандартное состояние – это состояние чистого вещества при давлении 1атм и заданной температуре. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температу-
ре T, обозначают 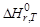 (r означает «reaction»). В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
(r означает «reaction»). В термохимических уравнениях указывают не только формулы веществ, но и их агрегатные состояния или кристаллические модификации.
Тепловой эффект химического процесса, протекающего в условиях р, Т = const, W = p×DV, не зависит от пути его протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции (закон Гесса).
Практическое значение закона Гесса состоит в том, что с его помощью можно вычислить неизвестную теплоту реакции путем комбинирования термохимических уравнений других изученных реакций.
Следствие 1 закона Гесса. С термохимическими уравнениями реакций можно обращаться как с алгебраическими уравнениями. Если реакция превращения вещества 1 в вещество 2: 1 ® 2, характеризуется изменением энтальпии DH1®2, а реакция 3 ® 2 характеризуется DH3®2, то реакция 1 ® 3 характеризуется изменением энтальпии:
DH1®3 = DH1®2 – DH3®2.
Следствие 2 закона Гесса . Тепловой эффект химической реакции равен разности теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
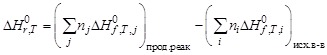
где j – для продуктов реакции; i – для исходных веществ; n – стехио-метрические коэффициенты, 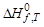 – стандартные теплоты образования веществ.
– стандартные теплоты образования веществ.
Стандартной энтальпией (теплотой) образования вещества
(f означает «formation») при заданной температуре называют энтальпию реакции образования одного моля этого вещества из элементов, находящихся в наиболее устойчивом стандартном состоянии. Энтальпия образования наиболее устойчивых простых веществ в стандартном состоянии равна 0 при любой температуре. Стандартные энтальпии образования веществ при температуре 298 К приведены в справочниках. Энтальпия образования соединения – мера его термодинамической устойчивости.
Следствие 3 закона Гесса.Тепловой эффект химической реакции равен разности теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
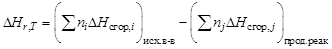 ,
,
где j – для продуктов реакции; i – для исходных веществ; n – стехио-метрические коэффициенты; 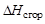 – теплоты сгорания веществ.
– теплоты сгорания веществ.
Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
В технических расчетах используют удельную теплоту сгора-
ния QT, которая равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества и 1 м3 газообразного вещества до образования высших оксидов:
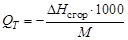 или
или 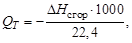
где М – масса 1 моль вещества; 22,4 л – объем 1 моль газа.
Если расчет теплоты сгорания ведется применительно к реакции с образованием жидкой воды, то удельная теплота сгорания называется высшей, а для реакции с образованием газообразной воды – низшей.
Энтропия S – так же, как и энтальпия, является термодинамической функцией состояния системы:
S = R× lnW,
где R – молярная газовая постоянная, 8,31 Дж/моль, К; W – термодинамическая вероятность состояния системы.
Термодинамической вероятностью состояния системы называется число микросостояний, с помощью которых осуществляется данное макросостояние.
Величина S прямо пропорциональна lnW, поэтому энтропия является мерой неупорядоченности системы. Единица измерения энтро-пии – Дж/(моль×К).
Ее значение увеличивается с ростом температуры и уменьшается с ее понижением. При повышении давления энтропия газа уменьшается, а при понижении – увеличивается.
На величину S влияют все факторы, связанные с природой вещества, например, полярность однотипных молекул – SHCl(г) < SHBr(г) <
< SHI(г),молярная масса молекул – S(F2) < S(Cl2) < S(Br2).
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное. Усложнение молекул также сопровождается ростом энтропии.
Изменение энтропии DS в процессе химической реакции можно подсчитать, используя следствие из закона Гесса:
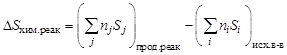 .
.
Стандартное изменение энтропии в химической реакции при
Т = 298 К легко вычислить, используя таблицы термодинамических величин, в которых приводятся стандартные энтропии веществ S0 при Т = 298 К.
При химических взаимодействиях одновременно изменяются энтальпия и энтропия системы, откуда возникла идея сопоставления энтальпийного DН и энтропийного ТDS факторов химической реакции.
Если тенденция к порядку и беспорядку в системе одинаковы, то DН =ТDS, что является математическим условием равновесного состояния системы, из которого ее можно вывести только путем внешнего воздействия.
В процессе перехода системы из одного состояния в другое происходят изменения DН ¹ ТDS.
Устойчивость любой системы определяется соотношением энтальпийного и энтропийного факторов, которые объединяются функцией, называемой энергией Гиббса DG, которая равна
DG = DH – TDS, [DG] = кДж/моль.
Изменение энергии Гиббса учитывает одновременно изменение энтальпии и энтропии системы, суммируя тенденции к порядку и беспорядку при переходе системы из одного состояния в другое. Именно поэтому DG – критерий, определяющий направление самопроизвольного протекания химических процессов.
Из уравнения DG = DH – TDS следует:
1) если DН <0 и DS >0, то всегда DG < 0, т.е. реакция, протекающая с выделением теплоты и увеличением степени беспорядка, возможна при всех температурах;
2) если DН >0 и DS <0, то всегда DG >0, т.е. реакция с поглощением теплоты увеличением степени порядка невозможна ни при каких температурах;
3) во всех остальных случаях (DН < 0 и DS <0 и если DН >0 и DS > 0, знак DG <0 зависит от соотношения членов DН и DS;
4) чем выше температура, тем большее значение приобретает член Т ×DS и при высоких температурах даже эндотермические реакции становятся самопроизвольными.
Стандартную энергию Гиббса реакции рассчитывают по следствию закона Гесса:
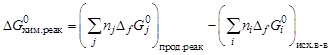 ,
,
где Df G0 – стандартные значения энергии Гиббса.
Стандартные значения энергий Гиббса образования простых веществ в стандартных состояниях и модификациях равны нулю.
Изменение стандартной энергии Гиббса при химической реакции может быть вычислено по уравнению:
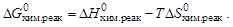
Если пренебречь изменением DН0и DS0 с увеличением температуры, то можно определить температуру Травн, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
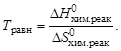
Если реагенты находятся в состояниях, отличных от стандартного, то изменение энергии Гиббса рассчитывается по уравнению, по-лучившему название изотермы Вант–Гоффа, которое для реакции
аА + bВ = сС + dD записывается в виде:

где р(А, В, С, D) – относительные парциальные давления соответствующих газов.
Учитывая, что DG0 = – RT× lnK, где К – константа равновесия, то изотерма Вант–Гоффа будет иметь вид:
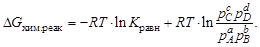
примеры решения задач
1. Известны тепловые эффекты следующих реакций (1) и (2) при 273 К и постоянном давлении 101,3 кПа. Рассчитать при тех же условиях тепловой эффект реакции (3).
(1) 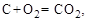
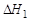 =
= 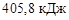
(2)  ½
½ 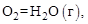
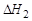
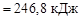
(3) 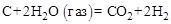
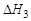 = ?
= ?
Решение. Для определение теплового эффекта реакции воспользуемся следствием 1 закона Гесса. Термохимическое уравнение реак-ции (3) можно получить в результате следующей комбинации термохимических уравнений реакций (1) и (2): (3) = (1) – 2 × (2)
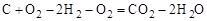
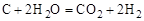 .
.
Следовательно: 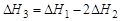 ;
;
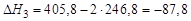 кДж.
кДж.
2. Вычислите тепловой эффект образования NH3 из простых веществ при стандартном состоянии по тепловым эффектам реакций:
(1) 2Н2 + О2 = 2Н2О(ж), DН01 = –571,68 кДж,
(2) 4NH3 + 3O2 = 6Н2О(ж) + 2N2, DН02 = –1530,28 кДж.
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить:
(3) ½ N2 + 3/2 Н2 = NH3, Df H0(NH3) = ?
В уравнения (1) и (2) входят Н2O(ж) и О2, которые не входят в уравнение (3). Поэтому, чтобы исключить их из уравнений (1) и (2), умножим уравнение (1) на 3 и вычтем из него уравнение (2):
6Н2 + 3О2 – 4NH3 – 3О2 = 6Н2О(ж) – 6Н2О(ж) – 2N2(г). (4)
После преобразования уравнения (4) и деления его на 4 получаем искомое уравнение (3).
Аналогичные действия проделаем с тепловыми эффектами:
(DН01×3 – DН02):4 = DН03.
В результате получаем: [–571,68×3 – (–1530,28)]:4 = –46,19 кДж,
т.е. Df H0(NH3) = –46,19 кДж/моль.
3. Вычислите теплоту гидратации СаCl2, если известно, что при растворении 1 моль безводного СаСl2 выделяется 72,7 кДж, а при растворении 1 моль кристаллогидрата CaCl2×6Н2О поглощается 18,0 кДж теплоты.
Решение. Процесс растворения в воде хлорида кальция можно разбить на две стадии:
(1) CaCl2(к) + 6Н2О(ж) = СаСl2×6Н2О(к); DН01
(2) СаСl2×6Н2О(к) + aq = СаСl2aq(ж) + 6Н2О(ж); DН02.
Первая стадия – процесс гидратации, т.е. получение кристаллогидрата, тепловой эффект которой нужно рассчитать; вторая стадия – растворение кристаллогидрата в воде. Суммарный тепловой эффект DН02 + DН01 равен теплоте растворения безводной соли DН03:
СаСl2(к) + aq = СaCl2aq(ж); DН03.
Разность теплот растворения безводной соли (DН03) и растворения кристаллогидрата (DН02) представляет собой теплоту гидратации (DН01).
Подставив соответствующие значения тепловых эффектов, получаем:
DН0гидр = –72,7 – (+18,0) = –90,7 кДж,
т.е. при гидратации 1 моль CaCl2 выделяется 90,7 кДж теплоты.
4. Какое из перечисленных соединений HF(г), HCl(г) и HBr(г), находящихся в стандартном состоянии, является наиболее устойчивым, т.е. будет разлагаться при более высоких температурах.
Решение. Тепловые эффекты реакций, протекающих в прямом и обратном направлениях, равны по величине и противоположны по знаку. Это означает, что если известны стандартные теплоты образования данных соединений, то энтальпии разложения этих соединений будут равны, но противоположны по знаку энтальпии образования. Чем прочнее молекула, тем больше энергии необходимо затратить на ее разложение.
Df H0(HF)= –270,7; Df H0(HCl)= –92,30; Df H0(HBr)= –35,98(кДж/моль).
Из трех соединений наиболее устойчивым является HF, так как на разложение 1 моль этого соединения потребуется 270,7 кДж теплоты, т.е.
Df Н0HF(г) = –DН0разлож.НF(г).
5. Определить тепловой эффект реакции в стандартных условиях (Т = 298 К).
 .
.
Решение. Для определение теплового эффекта реакции воспользуемся следствием 2 закона Гесса. Стандартные теплоты образования исходных веществ и продукта реакции находим в справочнике:
Вещество  , кДж/моль
, кДж/моль
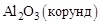 –1675,0
–1675,0
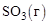 –395,2
–395,2
 –3434,0
–3434,0
Поскольку в справочнике  приводится в расчете на 1 моль, то при расчете теплового эффекта реакции соответствующее значение
приводится в расчете на 1 моль, то при расчете теплового эффекта реакции соответствующее значение  умножается на число моль вещества, участвующего в реакции.
умножается на число моль вещества, участвующего в реакции.
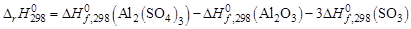
 –3434,0–(–1675,0) – 3 (–395,2) = –573,4 (кДж/моль).
–3434,0–(–1675,0) – 3 (–395,2) = –573,4 (кДж/моль).
Данная реакция идет с поглощением теплоты ( 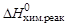 > 0), т.е. является эндотермической.
> 0), т.е. является эндотермической.
6. По известным значениям тепловых эффектов реакций сгорания алмаза и графита рассчитайте тепловой эффект превращения одного моля углерода в форме алмаза в графит ( 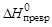 = ?).
= ?).
Решение. Определим энтальпии реакций сгорания графита и алмаза:
(1) Сграфит + О2 = СО2; DН01 = –396,3 кДж/моль,
(2) Салмаз + О2 = СО2; DН02 = –399,197 кДж/моль,
DН02= 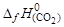 +(
+( 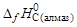 +
+ 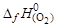 )= –396,3 – 1,897 – 0 =
)= –396,3 – 1,897 – 0 =
= –398,197 кДж/моль.
Чтобы из уравнений (1) и (2) получить уравнение перехода алмаза в графит с неизвестным тепловым эффектом, достаточно из второго вычесть первое:
Салмаз = Сграфит, DН03 = ?
и соответственно,
DН03 = DН02 – DН01 = –398,197 – (–396,3) = –1,897 кДж/моль.
7. Сколько теплоты выделится при сжигании 20 литров этилена, взятого при нормальных условиях, если известны стандартные теплоты образования веществ.
Решение. Запишем уравнение процесса горения этилена:
С2Н4(г) + 3О2 = 2СО2(г) + 2Н2О(ж)
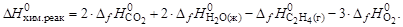
Подставив справочные данные, получим:
DНхим.реак = 2×(–396,3) + 2×(–285,84) – 52,28 = –1130,72 кДж/моль.
Следовательно, при сжигании 1 моль С2Н4 выделяется 1130,72 кДж.
Однако по условию задачи сжигается 20 л этилена, что составляет
nмоль= 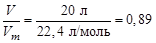 моль,
моль,
где 22,4 л/моль – мольный объем любого газа при н.у. Таким образом, при сгорании 0,89 моль этилена выделится:
0,89 моль×(–1130,72 кДж/моль) = –1009,57 кДж теплоты.
8. Предскажите знак изменения энтропии в следующих реакциях:
а) N2(г) + 3H2(г) = 2NH3(г),
б) С(к) + Н2О(г) = СО2(г) + Н2(г),
в) 2СО(г) + О2(г) = 2СО2(г).
Решение. Известно, что энтропия газов всегда значительно больше энтропии твердых тел и жидкостей, поэтому в химических реакциях, идущих с участием газообразных веществ, энтропия реакции всегда положительна (DS0 > 0), если в результате процесса возрастает число молей газообразных веществ и отрицательна (DS0 < 0), если число молей газообразных уменьшается.
Нетрудно увидеть, что в реакции (а) число молей газообразных веществ в системе уменьшается от 4 до 2, поэтому (DS0(а) < 0); в реакции (б) число молей газообразных веществ возрастает DS0(б) > 0; в реакции (в) уменьшается DS0(в) < 0.
9. Определите энтропию реакции
H2S(г) + Cl2(г) = 2HCl(г) + S(к).
Решение. Поскольку энтропия – функция состояния системы, то ее изменение DS0хим.реак в процессе химической реакции можно подсчитать, пользуясь следствием из закона Гесса:
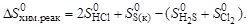
Подставив соответствующие значения энтропии для каждого из веществ, взятые из справочных данных, получаем:
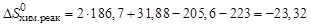 Дж/К.
Дж/К.
10. Рассчитайте энтропийный и энтальпийный факторы протекания процесса при стандартных условиях и 298 К:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж).
Какой из факторов способствует самопроизвольному протеканию реакции в прямом направлении?
Решение. Для расчета энтальпийного и энтропийного факторов воспользуемся следствием из закона Гесса:
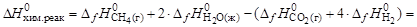
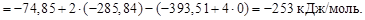
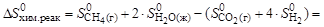
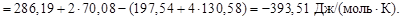
Энтальпийным фактором процесса является энтальпия реакции. Самопроизвольному протеканию процесса способствует уменьшение энтальпии системы (DН0хим.реак). Энтропийный фактор равен произ-ведению абсолютной температуры на энтропию реакции, т.е.
Т × DS0хим.реак. Самопроизвольному течению процесса способствует рост энтропии системы DS0 > 0.
В нашем случае энтропийный фактор равен:
Т× DS0хим.реак = –393,51×298 = –117265,98 Дж/моль,
или –117,266 кДж/моль, величина которого не способствует самопроизвольному протеканию процесса.
Энтальпийный фактор DНхим.реак = –253 кДж способствует самопроизвольному протеканию процесса в прямом направлении.
11. Рассчитайте стандартную энергию Гиббса химической реакции при 298 К и установите возможность ее самопроизвольного протекания в прямом направлении.
CuSO4(к) + 2NH4OH(ж) = Cu(OH)2(ж) + (NH4)2SO4(к).
Решение. Энергия Гиббса DG – термодинамическая функция состояния системы. Изменение энергии Гиббса химической реакции может быть рассчитано на основании следствия из закона Гесса:
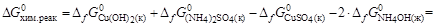
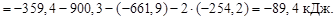
Любая химическая реакция протекает самопроизвольно в том направлении, которое отвечает при заданных условиях (давлении и температуре) уменьшению величины G.
В данном случае DG0хим.реак < 0, следовательно, возможно само-произвольное протекание процесса в прямом направлении.
12. Установите, возможно ли при температурах 298 и 1000 К образование водяного газа по уравнению: С(графит) + Н2О(г) = Н2(г) +
+СО(г),полагая, что все газы находятся при давлении 1 атм.
Для данной реакции определите температуру начала самопроизвольного процесса при стандартных состояниях веществ.
Решение. В справочных таблицах найдем значения Df Н0
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...