
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Зависимость термодинамических функций от температуры
Расчет стандартной энергии Гиббса и константы равновесия
По методу Темкина – Шварцмана
Изменение стандартной энергии Гиббса в результате реакции равно
 . (15)
. (15)
С учетом того, что D C p определяется уравнением (4), уравнение (15) можно преобразовать в форму, удобную для расчета:
 ,
,
где
 .
.
Коэффициенты M0, M1,…, Mn приведены в справочнике [1]. Логарифм константы равновесия равен
 . (16)
. (16)
Пример 4.Определить К 0 при 900 К для реакции СН4 (г) + 2Н2О (г) = СО2 (г) + 4Н2 (г).
Решение. Пользуясь справочником [1], находим
Dr H º298 = 165020 Дж/моль;
Dr S 0 298 = S 0 298(CO2)+ 4 S 0 298(Н2) - S 0 298(CН4) – 2 S 0 298(Н2О) =
=213,66 + 4×130,52 – 186,27 - 2×188,72 = 172,33 Дж / К;
При 900 К величины Mn имеют следующее значение: M0 = 0,4361; M1 = 0,2012 × 10 3;
M2 = 0,1004 × 10 6 ; M – 2 = 0,2521 × 10 - 5.
Подставляя эти значения в уравнение (16) и используя результаты, полученные в примере 1, получаем
ln K 0 (900) =  [ -
[ -  + 172,33 + 75,81 . 0,4361 + (- 59,81 . 10 – 3 ) . 0,2012 . 10 3 +
+ 172,33 + 75,81 . 0,4361 + (- 59,81 . 10 – 3 ) . 0,2012 . 10 3 +
+ (- 1,117 . 10 – 6 ) . 0,1004 . 10 6 + 9,87 . 10 5 . 0,2521 . 10 – 5 ] = 1,49;
K 0 (900) = 4,4.
Расчет изменения стандартной энергии Гиббса и константы равновесия
С помощью функций приведенных энергий Гиббса веществ
Под стандартной приведенной энергией Гиббса, или стандартным приведенным термодинамическим потенциалом, понимают функцию

где G °T - стандартное значение энергии Гиббса при температуре Т; H °0 и H °298 – стандартные значения энтальпии при 0 и 298 К соответственно.
Стандартная энергия Гиббса равна
 ,
,

Логарифм стандартной константы равновесия реакции равен
 .
.
Для температуры 298 К эта формула имеет вид:
 .
.

Если стандартные энтальпии образования веществ при 0 К отсутствуют, то вычисление Dr H 0 0 можно осуществить на основании табличных данных для стандартных энтальпий образования Df H 0298 и высокотемпературных составляющих энтальпий [H 0T – H 0298] при 298 К для каждого реагента:

Задачи
В задачах №№ 1 – 45 для данных химических реакций выполните следующие задания (необходимые данные возьмите из справочника):
1. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения
D r H 0T в интервале температур 300 – 1000 К с шагом 100 K. Выразите уравнением зависимость DrH 0T от температуры. Постройте график зависимости DrH 0T = f (T).
2. Используя значения стандартных теплоемкостей веществ C 0p 298, рассчитайте D r H 0T при температуре Т. Сравните значения D r H 0T для этой температуры, рассчитанные двумя методами.
3. Учитывая зависимости теплоемкостей веществ от температуры, вычислите значения
D r S 0T в интервале температур 300 – 1000К с шагом 100 K. Постройте график зависимости
D r S 0T = f (T).
4. Вычислите значения D r G 0 T в интервале температур 300 – 1000 К с шагом 100 K по методу Темкина - Шварцмана. Постройте график зависимости D r G 0 T = f (T).
5. Рассчитайте значение константы равновесия К 0 (Т) при температуре Т, пользуясь методом Темкина - Шварцмана.
6. Используя значения функций приведенной энергии Гиббса F 0 T и F¢ 0 T определить константу равновесия при температуре Т. Сравните результаты расчетов двумя методами.
7. Проанализируйте результаты термодинамических расчетов и определите, каким образом можно уменьшить выход экологически вредных продуктов реакции. При каких условиях следует проводить процесс?
| № задачи | Реакции | Т, K |
| 0,5 H2 (г) + 0,5 Br2 (г) = HBr (г) | ||
| 0,5 CH4 (г) + 0, 5 CO2 (г) = CO (г) + 2H2 (г) | ||
| C2H6 (г) = C2H4 (г) + H2 (г) | ||
| NO (г) + 1,5 H2O (г) = NH3 (г) + 1,25O2 (г) | ||
| NO2 (г) = NO(г) + 0,5 O2 (г) | ||
| CO (г) + Cl 2 (г) = COCl 2 (г) | ||
| CH 4 (г) + 0,5 O 2 (г) = CH3 OH (г) | ||
| CO (г) + ½ O2 (г) = CO2 (г) | ||
| CO2 (г) + H2 (г) = HCOOH (г) | ||
| СН4 (г) = 0,5 С2Н2 (г) + 1,5 Н2 (г) | ||
| 3H2 (г) + CO (г) = CH4 (г) + H2O (г) | ||
| 2CO (г) + 3H2 (г) = C2H2 (г) + 2H2O (г) | ||
| SO2 (г) + Cl2 (г) = SO2Cl2 (г) | ||
| 2NH3 (г) + 2O2 (г) = N2O (г) + 3H2O (г) | ||
| CO (г) + H2 (г) = HCOH (г) | ||
| CO (г) + H2O (г) = CO2 (г) + H2 (г) | ||
| NO (г) + H 2 O (г) = NO2 (г) + H2 (г) | ||
| C6 H6 (г) + 3 H 2 (г) = цикло - C 6 H 12 (г) | ||
| C2H2 (г) + N2 (г) = 2HCN (г) | ||
| C (графит) + 2Cl2 (г) = CCl4 (г) | ||
| CS 2 (г) + 4 H 2 (г) = 2 H 2 S (г) + CH 4 (г) | ||
| C (графит) + 2H2 (г) = CH4 (г) | ||
| CO (г) + NO (г) = CO2 (г) + 0,5N2 (г) | ||
| CCl4 (г) + 2H2O (г) = CO2 (г) + 4HCl (г) | ||
| н-C4H10 (г) = C4H8 (г) + H2 (г) | ||
| CH4 (г) + 2H2O (г) = CO2 (г) + 4H2 (г) | ||
| CH3CHO (г) + H2 (г) = C2H5OH (г) | ||
| C2H6 (г) + CO (г) = CH3COCH3 (г) (ацетон) | ||
| CH4 (г) + CH3Cl (г) = C2H6 (г) + HCl (г) | ||
| NO (г) + 2,5 H2 (г) = NH3 (г) + H2O (г) | ||
| CO2 (г) + 2H2 (г) = HCHO (г) + H2O (г) | ||
| C2H4 (г) = C2H2 (г) + H2 (г) | ||
| HCHO (г) + H2 (г) = CH3OH (г) | ||
| CH3Cl (г) + 2Cl2 (г) = CHCl3 (г) + 2HCl (г) | ||
| CO2 (г) + 3H2 (г) = CH3OH (г) + H2O (г) | ||
| CCl4 (г) + H2O (г) = COCl2 (г) + 2HCl (г) | ||
| C2H5OH (г) = C2H4 (г) + H2O(г) | ||
| C3H8 (г) = C3H6 (г) + H2 (г) | ||
| CO2 (г) + 4H2 (г) = CН4 (г) + 2H2O (г) | ||
| C 3 H 8 (г) = C 2 H 4 (г) + CH 4 (г) | ||
| CH3CHO (г) = CН4 (г) + СO (г) | ||
| 0,5 С2H4 (г) + 1,5 O2 (г) = CO2 (г) + H2O (г) | ||
| 2H2 (г) + CO (г) = CH3OH (г) | ||
| 2NO (г) + 2H2 (г) = N2 (г) + 2H2O (г) | ||
| NO(г) + 0,5 Cl 2 (г) = NOCl (г) |
Отсюда следует
 .
.
В реальных предельно разбавленных растворах для растворителя выполняется закон Рауля, а для растворенного вещества выполняется закон Генри:
 ,
,
где K Г - константа Генри.
Парциальные молярные величины
Парциальной молярной величиной (пмв) данного компонента называют частную производную от экстенсивного свойства раствора (g) по числу моль этого компонента
(ni ) при постоянстве температуры, давления и числа моль всех остальных компонентов:
 .
.
Парциальная молярная величина (  ) i - го компонента характеризует изменение данного экстенсивного свойства раствора (g) при добавлении 1 моль i – го компонента к столь большому количеству раствора при постоянных Т и p, что добавление этого количества компонента практически не изменяет состава раствора.
) i - го компонента характеризует изменение данного экстенсивного свойства раствора (g) при добавлении 1 моль i – го компонента к столь большому количеству раствора при постоянных Т и p, что добавление этого количества компонента практически не изменяет состава раствора.
Общее значение свойства g выражается суммой вкладов всех компонентов (первое уравнение Гиббса - Дюгема):
 .
.
Парциальные молярные величины при постоянных р и Т связаны вторым уравнением Гиббса - Дюгема:

Тогда
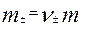 ,
,
где
 .
.
Активность электролита определяется как
 .
.
Согласно представлениям об ионной силе раствора, коэффициенты активности ионов не зависят от природы ионов, находящихся в растворе, а зависят от ионной силы раствора (I):
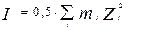 ,
,
где Z i - зарядовое число иона, m i - моляльная концентрация иона. Согласно первому приближению теории Дебая – Хюккеля, можно рассчитать средний ионный коэффициент активности  :
: 
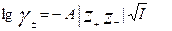 ,
,
где Z + , Z - - зарядовые числа ионов, I – ионная сила раствора, A – константа, зависящая от диэлектрической проницаемости раствора и от температуры. Для разбавленных водных растворов при T = 298 K А = 0,509. Для 1, 1 – зарядного электролита данное уравнение имеет вид:
 .
.
Если ионная сила раствора не превышает 0,1, коэффициенты средней ионной активности ионов равного заряда примерно одинаковы.
Пример 13. В водном растворе содержится 0,5 моль MgSO4, 0,1 моль АlCl3 и 0,2 моль (NH4)2SO4 на 1000 г воды. Определить ионную силу раствора.
Решение. Найдем моляльность (m) всех ионов: m Mg2+= 0,5 ; m Al3+ = 0,1; m (NH4)+ = 0,4.
Так как из 1 моль (NH4)2SO4 получается 2 моль иона NH4+ , m SO42- = 0,5 + 0,2 = 0,7 ;
m Cl- = 0,3 , так как из одного моль АlCl3 получается 3 моль – иона Cl - .
I = 0,5 ∑ m ί Ζ ί 2
Умножив моляльность каждого иона на квадрат его зарядового числаи суммируя произведения, получаем : I = 0.5 ( 0,5 . 4 + 0,1 . 9 + 0,4 . 1 + 0,7 . 4 + 0,3 . 1) = 3,2 .
Пример 14. Вычислить средние ионные коэффициенты активности (γ±) для растворов
NaCl с моляльной концентрацией m1 = 0.01 и m2 =0,001.
Решение. Для 1-1-валентного электролита используем уравнение: lgγ± = - 0,509  m
m
lg γ± 1 = - 0,509  0,01= - 0,0509; γ±1 = 0,888 ;
0,01= - 0,0509; γ±1 = 0,888 ;
lg γ± 2 = - 0,509  0,001 = -0,016 ; γ± 2 = 0,963 .
0,001 = -0,016 ; γ± 2 = 0,963 .
Пример 15. Для раствора Cr2(SO4)3 с моляльной концентрацией 0,1 вычислить среднюю ионную активность ( a±), активность электролита, а также активности ионов Cr3+ и
SO4 2 - при Т = 298К.
Решение. Рассчитаем среднюю ионную моляльность по формуле:
m ± = m ( ν+ ν+ . ν-ν- )1/ ν ,
где ν+ и ν- - число катионов и число анионов, ν = (ν+ + ν-) – общее число ионов
m ± = ( 22 · 33 )1/5 · 0,1 = 0,255 .
Вычислим среднюю ионную активность по уравнению: a ± = m ±· γ ± .
Величину γ ± берем из таблицы [1, c. 131] : γ± = 0,0458 . Тогда
a ± = 0,255· 0,0458 = 0,0177 .
Активность электролита (a) рассчитываем по уравнению: a = (a ± ) ν = a +ν+ · a -ν- .
Чтобы найти активности ионов, сначала рассчитываем моляльности ионов:
m+ = m · ν+ ; m - = m · ν - ; m Cr3+= 0,1· 3 = 0,3 ; m SO42-= 0,1· 2 = 0,2 ;
Активности ионов определяем по формулам: a + = γ+· m + ; a - = γ- · m - ;
a Cr3+ = 0,3 · 0,0458 = 0,0137 ; a SO42- = 0,2 · 0.0458 = 0,0092 ;
Задачи
В задачах 128 - 162 выполнить следующие задания:
1. Определить ионную силу водного раствора электролита А с моляльной концентрацией m.
2. Определить ионную силу водного раствора электролита А с моляльной концентрацией m, если в растворе присутствует электролит В с концентрацией m1.
3. Вычислить средний ионный коэффициент активности g± при 298 К электролита А с концентрацией m.
4. Вычислить средний ионный коэффициент активности раствора электролита А с концентрацией m при 298 К, если в растворе присутствует электролит В с концентрацией m1.
5. Определить среднюю ионную активность а ±раствора электролита А с концентрацией m при 298 К.
| № задачи | Электролит А | m, моль/кг Н2О | Электролит В | m1, моль/кг Н2О |
| NaCl | 0,01 | Ca(NO3)2 | 0,025 | |
| CdSO4 | 0,003 | CuCl2 | 0,01 | |
| MgCl2 | 0,02 | ZnSO4 | 0,015 | |
| Na2SO4 | 0,01 | FeCl2 | 0,05 | |
| HNO3 | 0,05 | H2SO4 | 0,02 | |
| KOH | 0,02 | Ba(NO3)2 | 0,04 | |
| HCl | 0,01 | CdCl2 | 0,02 | |
| CuCl2 | 0,005 | LaBr3 | 0,005 | |
| H2SO4 | 0,015 | KCl | 0,01 | |
| KBr | 0,02 | GaCl3 | 0,003 | |
| ZnSO4 | 0,01 | NaNO3 | 0,02 | |
| KNO3 | 0,05 | LaCl3 | 0,025 | |
| CdCl2 | 0,01 | HCl | 0,025 | |
| AgNO3 | 0,003 | Co(NO3)2 | 0,01 | |
| CsCl | 0,02 | H2SO4 | 0,015 | |
| HBr | 0,01 | Mg(ClO4)2 | 0,05 | |
| ZnBr2 | 0,05 | HClO4 | 0,02 | |
| Co(NO3)2 | 0,02 | ZnSO4 | 0,04 | |
| KCl | 0,01 | LaCl3 | 0,02 | |
| LiCl | 0,005 | Na2SO4 | 0,005 | |
| Na2S2O3 | 0,015 | NaBr | 0,01 | |
| CoCl2 | 0,02 | NaNO3 | 0,003 | |
| NaClO3 | 0,01 | ZnCl2 | 0,02 | |
| Mg(ClO4)2 | 0,05 | NaCl | 0,025 | |
| Ca(NO3)2 | 0,01 | HNO3 | 0,025 | |
| HCl | 0,01 | KCl | 0,05 | |
| H2SO4 | 0,01 | K2SO4 | 0,05 | |
| CaCl2 | 0,1 | KCl | 0,05 | |
| NaH2PO4 | 0,02 | NaCl | 0,04 | |
| CuCl2 | 0,02 | CuSO4 | 0,04 | |
| MgSO4 | 0,005 | Mg(NO3)2 | 0,05 | |
| ZnSO4 | 0,05 | CuSO4 | 0,07 | |
| KClO3 | 0,05 | KCl | 0,03 | |
| (NH4)2SO4 | 0,05 | NH4NO3 | 0,10 | |
| Al2(SO4)3 | 0,02 | AlCl3 | 0,03 |
Задачи
163. Для обратимого процесса А D В константы скоростей прямой и обратной реакций равны соответственно k 1 = 0,01 c – 1 и k 2 = 0,15 c – 1. Начальные концентрации веществ А и В взяты равными 0,2 моль/л. Определить концентрации этих веществ через 8 с.
164. Константа равновесия обратимой реакции А D В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Определить время, за которое концентрации обоих веществ достигнут равенства, если вначале в системе содержалось только вещество А.
165. Для обратимой реакции А D В начальные концентрации веществ равны С A0 =
= 0,4 моль/л и С В0 = 0. Через 10 мин после начала реакции С A = 0,15 моль/ л и С В =
= 0,25 моль/ л. Определить концентрацию вещества А через 20 мин, если константа равновесия реакции равна K = 3.
166. Константа скорости гомогенного мономолекулярного процесса цис-транс-изомеризации бутена при 417 0С равна 1,6 . 10 6 с – 1. Константа равновесия при этой температуре равна 1,14. В начальный момент времени в системе присутствует только цис-изомер. Вычислить время достижения равных концентраций изомеров.
167. Для реакции изомеризации А D В при 25 0 С концентрации исходного вещества А в разные моменты времени даны в таблице. Равновесная концентрация вещества А составила С A¥ = 0,078 моль / л. Найти константы скоростей прямой k 1 и обратной реакций k 2 . Начальная концентрация С В0 = 0.
| t, ч | С At , моль / л |
| 0,366 | |
| 71,8 | 0,277 |
| 215,8 | 0,174 |
| 333,3 | 0,130 |
168. Константа равновесия обратимой реакции А D В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Начальные концентрации веществ А и В равны 0,3 моль/л и 0 моль/л соответственно. Определить время, за которое прореагирует 10 % вещества А.
169. Для обратимого процесса А D В известно, что k 1 + k - 1 = 5,13 . 10 - 5 c – 1, а k 1/ k - 1 = 0,575. Начальная концентрация вещества А равна 0,32 моль/л, а вещества В в начальный момент времени нет. Определить концентрации веществ через 100 мин после начала реакции.
170. Для обратимой реакции А D В начальные концентрации составляют С А0 = 18,23 моль/л и С В 0 = 0 моль/л, k 1 = 0,027 с – 1 . Равновесная концентрация вещества А равна 4,95 моль/л. Определить значение k - 1 .
171. Константа скорости прямой реакции А D В при некоторой температуре равна 10, а константа скорости прямой реакции равна 5 . 10 - 4 с – 1. Константа равновесия равна 1,6. В начальный момент присутствует только вещество А. Определить время, за которое прореагирует 30 % вещества А.
172. Константа равновесия обратимой реакции А D В равна 1,4, а константа скорости прямой реакции равна 6 . 10 – 5 с – 1. Определите, какая доля начального количества вещества прореагирует за 40 мин, если в начальный момент в системе содержалось только вещество А.
173. В параллельных реакциях первого порядка: 1. А ® В; (k 1) , 2. А ® D. (k 2) выход вещества В равен 53 %, а время превращения вещества А на 1 / 3 равно 40 с. Найти k 1 и k 2.
174. Параллельные элементарные реакции: 1. А ® В , 2. 2 А ® С характеризуются следующими данными: скорости обеих реакций равны при концентрации вещества А, равной 0,2 моль / л, а при концентрации вещества А равной 0,4 моль / л скорость превращения А составляет 0,24 моль / (л . с). Определить значения констант скоростей k1 и k 2.
175. Параллельные элементарные реакции: 1. А ® В, 2. А ® С характеризуются следующими данными: выход вещества В равен 63 %, а время полупревращения вещества А по приведенной схеме составляет 19 мин. Рассчитать значения констант скоростей k 1 и k 2.
176. Определить, сколько азота и оксида азота (I) образуется через 0,1 с при нагревании
4 моль/ л окиси азота при 1300 К, если константы скорости параллельных бимолекулярных реакций равны k 1 = 25,7 и k2 = 18,2 л/(моль . с).
& N2 + O2 (k 1 )
2 NO
( N2O + 0,5 O2 . (k 2)
177. Реакция разложения вещества А может протекать параллельно по трем направлениям:
1. А ® В, 2. А ® D, 3. А ® F. Концентрации продуктов в смеси через 5 мин после начала реакции были равны: С B = 2 моль / л, C D = 1,5 моль / л, C F = 3 моль / л. Определить константы скорости k1, k2, k3, если период полураспада вещества А равен t ½ = 8 мин.
178. Для некоторой системы, в которой протекают конкурирующие необратимые реакции:
1. А + В ® D ; 2. А + С ® F ; при 25 0 С соотношение продуктов составило C D : C F = 1 : 5. При 60 0 С соотношение продуктов составило C D : C F = 1 : 3. Определить энергию активации реакции 2, если для первой реакции она составляет 30 кДж / моль.
179. Последовательная реакция А ® В ® С характеризуется следующими данными: при достижении максимума концентрации вещества В отношение концентраций С А / С В = 4 : 5, а время превращения вещества А на 25 % составляет 85 с. Определить значения констант скоростей k 1 и k 2.
180 . В системе осуществляется последовательная реакция 
Максимальная концентрация вещества В равно 0,77 [A] 0 и достигается через 170 мин после начала реакции. Рассчитать k 1 и k 2 .
181. Распад радиоактивного изотопа Zn 30 по схеме: Zn 30 ® Ga 31® Ge 32
характеризуется тем, что максимальное содержание радиоактивного изотопа галлия в образце достигается через 30,3 суток. Причем отношение числа атомов изотопа цинка к числу атомов изотопа галлия в это время оказывается равным 3,48. Определить периоды полураспада изотопов цинка и галлия.
182. Последовательная реакция первого порядка протекает по схеме:
 .
.
При 298 К k1 = 0,1 мин - 1; k2 = 0,05 мин - 1; начальная концентрация исходного вещества СA0 = 0,5 моль / л. Вычислить: 1. координаты максимума кривой С B = f (t); 2. Время достижения концентрации С A = 0,001 моль / л (продолжительность реакции А ® B); 3. концентрации С B и С D в момент окончания реакции А ® B.
183. Образец радиоактивного урана массой 200 г распадается по схеме:

(над стрелками указаны периоды полураспада). Рассчитать массы нептуния и плутония через 10 мин. После начала распада. Определить максимальную массу нептуния, которая может быть получена из данного образца урана.
184. Образец радиоактивного урана массой 200 г распадается по схеме:
 ,
,
где значения констант составляют k1 = 4,7 . 10 – 18 с – 1 и k2 = 1,381 . 10 – 11 с – 1 . Определить периоды полураспада урана и радия и максимальную массу, которая может быть получена из данного образца урана.
185. Был предложен следующий механизм термического разложения озона:
О3 ® O 2 + O (k 1)
O + O2 ® O3 (k – 1)
O + O3 ® 2O2 (k 2)
С помощью метода квазистационарных концентраций получить выражение для скорости распада, включающее константы k1, k - 1, k2 и концентрации О2 и О3.
186. Для реакции NO2Cl ® NO2 + 0,5 Cl2 предложен следующий двухстадийный механизм:
1. NO2Cl ® NO2 + Cl . (k 1 );
2. NO 2 Cl + Cl . ® NO 2 + Cl 2. (k 2 )
Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения NO2Cl.
187. В одной из теорий мономолекулярных реакций был предложен следующий механизм активации молекул (схема Линдемана): 1. А + А ® А* + А, (k 1 ) (активация)
2. А + А* ® А + А, (k - 1) (дезактивация)
3. А* ® В + D. (k 2) (распад)
Используя метод квазистационарных концентраций, вывести уравнение для скорости мономолекулярной реакции и определить порядок реакции при больших и малых концентрациях А.
188. Предложен следующий механизм для гомогенного пиролиза метана (М - инертная молекула): 1. CH4 + М ® CH3 . + H . + М; (k 1)
2. CH4 + CH3 . ® C2H6 + H . ; (k 2)
3. CH4 + H . ® CH3 . + H2 ; (k 3)
4. H . + CH3 . + M ® CH4 + M. (k 4)
Вывести уравнение для скорости образования C2H6 на основе приведенного механизма, используя метод стационарных концентраций. Концентрации СН3 · и Н · очень малы, поэтому стационарны и не должны входить в уравнение.
189. Химическая реакция N2O ® N2 + 0,5 O2 протекает по следующему механизму (М – инертная частица): 1. N2O + М ® N2О* + М; (k 1)
2. N2O * ® N2 + O . ; (k 2)
3. N2O * + М ® N2О + М; (k 3)
4. N2O + О ® N2 + O2 ; (k 4)
Считая концентрации N2O * и О . стационарными, найти выражение для скорости распада N2O.
190. Дана схема цепной реакции: АН ® А . + Н . , (k 1)
А . ® В . + С, (k 2)
АН + В . ® А . + D, (k 3)
А . + В . ® Р . (k 4)
Используя метод квазистационарных концентраций, вывести уравнение для скорости образования продукта Р.
191. Вывести уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2 N2O 5 ( г) ® 4 NO2 ( г) + O2 ( г) при следующем механизме реакции (активные промежуточные частицы NO3 и NO):
1. N2O5 ® NO2 + NO3 ; (k 1)
2. NO 2 + NO 3 ® N 2 O 5 ; (k - 1)
3. NO 2 + NO 3 ® N O2 + O 2 + NO; (k 2)
4. NO + N 2 O 5 ® 3 NO 2 . (k 3)
192. При изучении кинетики реакции SiH 4 (г) ® Si (т) + 2 H 2 (г) был установлен следующий механизм: 1. SiH4 ® SiH2 + 2 H2 ; (k 1)
2. SiH2 ® Si + H2; (k 2)
3. SiH2 + H 2 ® SiH4 ; (k 3)
Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения SiH4.
193. Для реакции нитрит - иона с кислородом предложен следующий механизм:
1. NO2 - + O2 ® NO3 - + O; (k 1)
2. NO2 - + O ® NO3- ; (k 2)
3. O + O ® O2; (k 3)
Вывести уравнение для скорости образования иона NO3 -, используя метод квазистационарных концентраций. Упростить полученное выражение, предполагая, что реакция (3) гораздо медленнее реакции (2).
194. Предложен следующий механизм разложения азотной кислоты:
1. HNO3 ® HO + NO2;
2. HO+NO2 ® HNO3;
3. HO+HNO3 ® H2O + NO3.
Предположив, что концентрация НО стационарна, вывести выражение для скорости разложения азотной кислоты. Как изменится приведенное выше уравнение, если предположить, что исчезновение NO2 происходит быстро?
195. Предполагают, что реакция разложения бромметана 2 CH3Br ® C2H6 + Br2 может протекать по следующему механизму: 1. CH3Br ® CH 3 . + Br . ; (k 1)
2. СН 3 . + CH3Br ® C2H6 + Br . ; (k 2)
3. Br . + CH3Br ® СН 3 . + Br2 ; (k 3)
4. 2 СН 3 . ® C2H6 . (k 4)
Используя метод квазистационарных концентраций, вывести уравнение для скорости образования этана.
196. Термическое разложение углеводорода R 2 протекает последующему механизму:
1. R 2 ® 2 R . ; (k 1)
2. R . + R 2 ® P B + R¢ . ; (k 2)
3. R¢ . ® P A + R . ; (k 3)
4. 2 R . ® P A + P B . (k 4)
Здесь R 2, PA , PB - устойчивые углеводороды, R . и R¢ . – радикалы. Найти зависимость скорости разложения R 2 от концентрации R 2.
197. Дана следующая схема разложения ацетальдегида:
1. СН3СНО ® СН 3 . + СНО . ; (k 1)
2. СН3 . + СН 3 СНО ® СН 4 + СН 2 СНО . ;(k 2)
3. СН2СНО . ® СН 3 . + СО; (k 3)
4. СН3 . + СН3 . ® С2Н6 ; (k 4)
Используя приближение квазистационарных концентраций, вывести выражение для скорости образования метана и скорости расходования ацетальдегида.
198. Предполагают, что реакция образования фосгена СО + Cl2 ® СОCl2 может протекать по следующему механизму: 1. Cl2 ®2 Cl . ; (k 1)
2. 2 Cl . ® Cl 2 ; (k 2)
3. СО + Cl . ® СОCl . ; (k 3)
4. СОCl . ® СО + Cl . ; (k 4)
5. СОCl . + Cl 2 ® СОCl2 + Cl . . (k 5)
Используя приближение стационарных концентраций, вывести выражение для скорости образования фосгена.
199. Предполагают, что распад вещества А 2 в растворителе RH протекает по следующему механизму: 1. А 2 ® 2 А . ;
2. А . ® Р + В . ;
3. В . +RH ® BH + R . ;
4. R . + R .®R – R.
Используя приближение квазистационарных концентраций, вывести выражение для скорости образования продукта Р.
200. Для реакции синтеза иодоводорода из простых веществ H2 (г)+ I2 (г) ®2HI (г) предложен следующий механизм: 1. I2 ® 2 I· ; (k 1)
2. 2I· ® I2 ; (k 2)
3. 2I· + H2 ® 2HI. (k 3)
Используя квазиравновесное приближение, вывести уравнение для скорости образования HI.
201. Для реакции 2 NO + O 2 ® 2 NO2 предложен следующий механизм:
1. 2 NO D (NO) 2 ; ( k 1, k – 1)
2. (NO)2 + O 2 ® 2 NO2. (k 2)
Вывести уравнение для скорости образования NO2 , предполагая, что первая стадия – быстрая, а вторая – медленная.
Задачи
202. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
| С, ммоль/ см 3 | 0,018 | 0,031 | 0,062 | 0,126 |
| a, ммоль/г | 0,467 | 0,624 | 0,801 | 1,11 |
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха.
203. При изучении адсорбции уксусной кислоты на угле при 25 0С были получены следующие данные:
| С, ммоль/ см 3 | 0,268 | 0,471 | 0,882 |
| a, ммоль/г | 1,55 | 2,04 | 2,48 |
Определить графически константы в уравнении изотермы адсорбции Фрейндлиха.
204. По уравнению Фрейндлиха вычислить равновесную концентрацию уксусной кислоты, если 1 г угля адсорбирует 3,76 ммоль СН3СООН. Константа k = 2,82; n =2,44.
205. При изучении адсорбции ацетона древесным активированным углем при 20 0С были получены следующие данные:
| С, ммоль/л | 2,34 | 14,65 | 88,62 | 177,69 | 268,97 |
| a, ммоль/г | 0,208 | 0,618 | 1,50 | 2,08 | 2,88 |
Определить графически постоянные уравнения изотермы Фрейндлиха и рассчитать количество ацетона, адсорбируемое 1 г угля при равновесной концентрации ацетона 125 ммоль/л.
206. Определить постоянные уравнения Фрейндлиха, используя следующие данные для адсорбции при 231 К углекислого газа на угле:
| р (CO 2) . 10 – 3, Па | 1,00 | 4,48 | 10,00 | 14,40 | 25,00 | 45,20 |
| Адсорбция a . 10 2, кг/кг | 3,23 | 6,67 | 9,62 | 11,72 | 14,50 | 17,70 |
207. По приведенным данным об адсорбции СО2 на угле марки С при (- 42 0 С) определить константы в уравнении Фрейндлиха.
| р (СО2), Торр | 10,0 | 50,0 | ||||
| a, моль/кг | 0,659 | 1,341 | 1,545 | 2,000 | 2,341 | 2,591 |
208. По приведенным результатам адсорбции амилового спирта на активном угле марки СКТ при 20 0С составить уравнение изотермы адсорбции Ленгмюра и определить удельную поверхность угля. Площадь поперечного сечения молекул амилового спирта принять равной
1,6 . 10 – 19 м 2.
| С, моль/ м 3 | 0,94 | 1,83 | 3,10 | 5,60 | 11,05 |
| a, моль/ кг | 0,61 | 1,21 | 1,76 | 2,65 | 3,96 |
209. По приведенным данным для адсорбции уксусной кислоты на древесном угле при 25 0С составить уравнение изотермы адсорбции Фрейндлиха.
| С, моль / л | 0,05 | 0,10 | 0,50 | 1,00 | 1,50 |
| a, г / г | 0,04 | 0,06 | 0,12 | 0,16 | 0,19 |
210. По приведенным результатам адсорбции СО2 на угле марки С при (- 42 0 С) составить уравнение изотермы адсорбции Фрейндлиха.
| р (СО 2), кПа | 1,00 | 4,48 | 10,0 | 14,4 | 25,0 | 45,2 |
| a . 10 3, моль/ кг | 7,34 | 15,2 | 21,9 | 26,6 | 32,9 | 40,2 |
Задачи № 211 - 214. По приведенным данным: а) построить изотерму адсорбции; б) проверить применимость уравнения Ленгмюра; в) если изотерма не соответствует уравнению Ленгмюра, составить уравнение адсорбции Фрейндлиха.
211. Адсорбция H2S на цеолите CaX при 25 0С:
| p (H2S), Торр | |||||||||
| a, моль/кг | 0,735 | 0,882 | 1,412 | 1,559 | 1,941 | 2,118 | 2,294 | 2,471 | 2,588 |
212. Адсорбция H2S на цеолите NaA при 25 0С:
| p (H2S), Торр | |||||||||
| a, моль/кг | 2,294 | 2,941 | 3,235 | 3,529 | 3,765 | 3,882 | 4,059 | 4,176 | 4,298 |
213. Адсорбция H2S на цеолите CaА при 25 0С:
| p(H2S), Торр | |||||||||
| a, моль/кг | 1,588 | 2,824 | 3,294 | 3,765 | 4,176 | 4,353 | 4,471 | 4,647 | 4,706 |
214. Адсорбция H2S на цеолите NaХ при 25 0С:
| p (H2S), То |
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...