
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Приближенные методы химической кинетики
В сложных реакциях с участием активных промежуточных частиц используется метод квазистационарных (или стационарных) концентраций. В этих реакциях за малый промежуток времени (мало изменение концентрации исходных веществ) в системе устанавливается режим, при котором разность скоростей образования r o и расходования r p промежуточных частиц становится малой по сравнению с этими скоростями. Такой режим процесса называется квазистационарным, а соответствующие ему концентрации промежуточных частиц - квазистационарными концентрациями. В квазистационаром режиме можно полагать:
 ,
,
где  - концентрация промежуточных частиц.
- концентрация промежуточных частиц. 
В результате можно выразить концентрации промежуточных частиц через концентрации стабильных веществ, принимающих участие в данном процессе. Если время установления квазистационарного режима мало, концентрации активных промежуточных частиц будут непрерывно подстраиваться к новым квазистационарным значениям, то есть квазистационарный режим не будет нарушаться на протяжении всего процесса. Таким образом, метод квазистационарных концентраций состоит в том, что в системе дифференциальных уравнений, описывающей сложный химический процесс, дифференциальные уравнения для активных промежуточных частиц заменяются алгебраическими уравнениями, выражающими равенство скоростей образования и расходования этих частиц. Метод квазистационарных концентраций применяется обычно к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
Квазиравновесное приближение применяют тогда, когда одна из реакций является обратимой, причем равновесие быстро устанавливается и медленно разрушается. Рассмотрим кинетическую схему:
1. A D B ; (k 1 , k – 1 )
2. B ® C . (k 2 )
Поскольку равновесие на первой стадии устанавливается быстро, то k 2 << k – 1. Тогда концентрацию промежуточного продукта В можно выразить через константу равновесия:
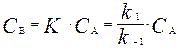 .
.
Скорость реакции равна:
 .
.
Мы получили уравнение реакции первого порядка.
Пример 16. Для обратимого процесса А D В константы скоростей прямой и обратной реакций равны соответственно k 1 = 0,4 c – 1 , k 2 = 0,05 c – 1. Начальные концентрации веществ А и В равны 0,04 моль/л. Определить какими окажутся концентрации этих веществ через 0,2 с.
Решение.
 ,
,
где x – количество прореагировавшего вещества А, a и b – начальные концентрации веществ А и В. Решение этого уравнения:
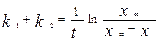 . (*)
. (*)
Здесь 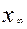 - количество прореагировавшего вещества А к моменту равновесия – равно
- количество прореагировавшего вещества А к моменту равновесия – равно
 .
.
При t ® ¥ наступает равновесие, которое характеризуется константой равновесия
 .
.
Вычисляем 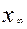
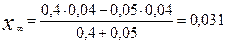 моль/л
моль/л
Из уравнения (* ) получаем
 моль/л;
моль/л;
С А = 0,04 – 0,0027 = 0,0373 моль/л;
С В = 0,04 + 0,0027 = 0,0427 моль/л.
Пример 17. В параллельных реакциях первого порядка: 1. А ® В ; (k 1 )
2. A ® D ; (k 2 )
Выход вещества В равен 40 %, а время превращения А на 30 % равно 5 мин. Найти k1 и k2.
Решение. Кинетическое уравнение для превращения вещества в двух параллельных реакциях первого порядка имеет вид
 .
.
С учетом превращения вещества А на 30 % получаем уравнение:
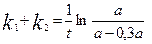 ,
,
где а – начальная концентрация вещества А. Вычисляем
 .
.
Выход вещества В равен 40 %, следовательно выход вещества D – 60 %. Отношение этих выходов равно отношению конечных концентраций веществ В и D. Следовательно, отношение соответствующих констант скоростей равно:
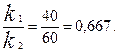
Решаем систему уравнений:
k 1 = 0,667 k 2 , k 1 + k 2 = 0,071.
0,667 k 2 + k 2 = 0,071 ; k 2 = 0,043 мин – 1; k 1 = 0,028 мин – 1 .
Пример 18. В системе осуществляется последовательная реакция
 .
.
Начальная концентрация вещества А равна 1 моль/л, вещества В и D в начальный момент в системе отсутствуют. Константы скорости равны k 1 = 0, 2 мин – 1 и k 2 = 0, 05 мин – 1 . Вычислите: 1) время достижения максимальной концентрации вещества В; 2) максимальную концентрацию вещества В; 3) время достижения концентрации С А = 0,01 моль/л.
Решение. 1. Рассчитаем время, которое будет соответствовать максимальной концентрации промежуточного вещества В:

2. Рассчитаем концентрацию вещества А через время t max:
 .
.
Максимальная концентрация промежуточного вещества равна:
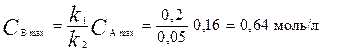
3. Рассчитаем время t x достижения концентрации С А = 0,01 моль/л:
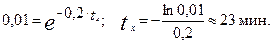
Пример 19. Реакция превращения пара-водорода в орто-водород протекает по следующему механизму (М – инертная частица):
1. п-Н 2 + М ® Н + Н + М ;
2. Н + п-Н 2 ® Н + о-Н 2 ;
3. Н + Н + М ® п-Н 2 + М .
Пользуясь методом квазистационарных концентраций, получить выражение для скорости конверсии пара-водорода.
Решение. Из уравнения (2) следует, что скорость образования орто-водорода равна:
 .
.
Метод квазистационарных концентраций применяем для активных атомов водорода
 .
.
Из этого выражения следует, что  .
.
Заметим, что в реакции (2) число атомов Н не изменяется, поэтому скорость изменения их концентрации определяется первой и третьей реакциями. Таким образом, получаем
 .
.
Задачи
163. Для обратимого процесса А D В константы скоростей прямой и обратной реакций равны соответственно k 1 = 0,01 c – 1 и k 2 = 0,15 c – 1. Начальные концентрации веществ А и В взяты равными 0,2 моль/л. Определить концентрации этих веществ через 8 с.
164. Константа равновесия обратимой реакции А D В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Определить время, за которое концентрации обоих веществ достигнут равенства, если вначале в системе содержалось только вещество А.
165. Для обратимой реакции А D В начальные концентрации веществ равны С A0 =
= 0,4 моль/л и С В0 = 0. Через 10 мин после начала реакции С A = 0,15 моль/ л и С В =
= 0,25 моль/ л. Определить концентрацию вещества А через 20 мин, если константа равновесия реакции равна K = 3.
166. Константа скорости гомогенного мономолекулярного процесса цис-транс-изомеризации бутена при 417 0С равна 1,6 . 10 6 с – 1. Константа равновесия при этой температуре равна 1,14. В начальный момент времени в системе присутствует только цис-изомер. Вычислить время достижения равных концентраций изомеров.
167. Для реакции изомеризации А D В при 25 0 С концентрации исходного вещества А в разные моменты времени даны в таблице. Равновесная концентрация вещества А составила С A¥ = 0,078 моль / л. Найти константы скоростей прямой k 1 и обратной реакций k 2 . Начальная концентрация С В0 = 0.
| t, ч | С At , моль / л |
| 0,366 | |
| 71,8 | 0,277 |
| 215,8 | 0,174 |
| 333,3 | 0,130 |
168. Константа равновесия обратимой реакции А D В равна 10, а константа скорости прямой реакции равна 0,2 с – 1. Начальные концентрации веществ А и В равны 0,3 моль/л и 0 моль/л соответственно. Определить время, за которое прореагирует 10 % вещества А.
169. Для обратимого процесса А D В известно, что k 1 + k - 1 = 5,13 . 10 - 5 c – 1, а k 1/ k - 1 = 0,575. Начальная концентрация вещества А равна 0,32 моль/л, а вещества В в начальный момент времени нет. Определить концентрации веществ через 100 мин после начала реакции.
170. Для обратимой реакции А D В начальные концентрации составляют С А0 = 18,23 моль/л и С В 0 = 0 моль/л, k 1 = 0,027 с – 1 . Равновесная концентрация вещества А равна 4,95 моль/л. Определить значение k - 1 .
171. Константа скорости прямой реакции А D В при некоторой температуре равна 10, а константа скорости прямой реакции равна 5 . 10 - 4 с – 1. Константа равновесия равна 1,6. В начальный момент присутствует только вещество А. Определить время, за которое прореагирует 30 % вещества А.
172. Константа равновесия обратимой реакции А D В равна 1,4, а константа скорости прямой реакции равна 6 . 10 – 5 с – 1. Определите, какая доля начального количества вещества прореагирует за 40 мин, если в начальный момент в системе содержалось только вещество А.
173. В параллельных реакциях первого порядка: 1. А ® В; (k 1) , 2. А ® D. (k 2) выход вещества В равен 53 %, а время превращения вещества А на 1 / 3 равно 40 с. Найти k 1 и k 2.
174. Параллельные элементарные реакции: 1. А ® В , 2. 2 А ® С характеризуются следующими данными: скорости обеих реакций равны при концентрации вещества А, равной 0,2 моль / л, а при концентрации вещества А равной 0,4 моль / л скорость превращения А составляет 0,24 моль / (л . с). Определить значения констант скоростей k1 и k 2.
175. Параллельные элементарные реакции: 1. А ® В, 2. А ® С характеризуются следующими данными: выход вещества В равен 63 %, а время полупревращения вещества А по приведенной схеме составляет 19 мин. Рассчитать значения констант скоростей k 1 и k 2.
176. Определить, сколько азота и оксида азота (I) образуется через 0,1 с при нагревании
4 моль/ л окиси азота при 1300 К, если константы скорости параллельных бимолекулярных реакций равны k 1 = 25,7 и k2 = 18,2 л/(моль . с).
& N2 + O2 (k 1 )
2 NO
( N2O + 0,5 O2 . (k 2)
177. Реакция разложения вещества А может протекать параллельно по трем направлениям:
1. А ® В, 2. А ® D, 3. А ® F. Концентрации продуктов в смеси через 5 мин после начала реакции были равны: С B = 2 моль / л, C D = 1,5 моль / л, C F = 3 моль / л. Определить константы скорости k1, k2, k3, если период полураспада вещества А равен t ½ = 8 мин.
178. Для некоторой системы, в которой протекают конкурирующие необратимые реакции:
1. А + В ® D ; 2. А + С ® F ; при 25 0 С соотношение продуктов составило C D : C F = 1 : 5. При 60 0 С соотношение продуктов составило C D : C F = 1 : 3. Определить энергию активации реакции 2, если для первой реакции она составляет 30 кДж / моль.
179. Последовательная реакция А ® В ® С характеризуется следующими данными: при достижении максимума концентрации вещества В отношение концентраций С А / С В = 4 : 5, а время превращения вещества А на 25 % составляет 85 с. Определить значения констант скоростей k 1 и k 2.
180 . В системе осуществляется последовательная реакция 
Максимальная концентрация вещества В равно 0,77 [A] 0 и достигается через 170 мин после начала реакции. Рассчитать k 1 и k 2 .
181. Распад радиоактивного изотопа Zn 30 по схеме: Zn 30 ® Ga 31® Ge 32
характеризуется тем, что максимальное содержание радиоактивного изотопа галлия в образце достигается через 30,3 суток. Причем отношение числа атомов изотопа цинка к числу атомов изотопа галлия в это время оказывается равным 3,48. Определить периоды полураспада изотопов цинка и галлия.
182. Последовательная реакция первого порядка протекает по схеме:
 .
.
При 298 К k1 = 0,1 мин - 1; k2 = 0,05 мин - 1; начальная концентрация исходного вещества СA0 = 0,5 моль / л. Вычислить: 1. координаты максимума кривой С B = f (t); 2. Время достижения концентрации С A = 0,001 моль / л (продолжительность реакции А ® B); 3. концентрации С B и С D в момент окончания реакции А ® B.
183. Образец радиоактивного урана массой 200 г распадается по схеме:

(над стрелками указаны периоды полураспада). Рассчитать массы нептуния и плутония через 10 мин. После начала распада. Определить максимальную массу нептуния, которая может быть получена из данного образца урана.
184. Образец радиоактивного урана массой 200 г распадается по схеме:
 ,
,
где значения констант составляют k1 = 4,7 . 10 – 18 с – 1 и k2 = 1,381 . 10 – 11 с – 1 . Определить периоды полураспада урана и радия и максимальную массу, которая может быть получена из данного образца урана.
185. Был предложен следующий механизм термического разложения озона:
О3 ® O 2 + O (k 1)
O + O2 ® O3 (k – 1)
O + O3 ® 2O2 (k 2)
С помощью метода квазистационарных концентраций получить выражение для скорости распада, включающее константы k1, k - 1, k2 и концентрации О2 и О3.
186. Для реакции NO2Cl ® NO2 + 0,5 Cl2 предложен следующий двухстадийный механизм:
1. NO2Cl ® NO2 + Cl . (k 1 );
2. NO 2 Cl + Cl . ® NO 2 + Cl 2. (k 2 )
Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения NO2Cl.
187. В одной из теорий мономолекулярных реакций был предложен следующий механизм активации молекул (схема Линдемана): 1. А + А ® А* + А, (k 1 ) (активация)
2. А + А* ® А + А, (k - 1) (дезактивация)
3. А* ® В + D. (k 2) (распад)
Используя метод квазистационарных концентраций, вывести уравнение для скорости мономолекулярной реакции и определить порядок реакции при больших и малых концентрациях А.
188. Предложен следующий механизм для гомогенного пиролиза метана (М - инертная молекула): 1. CH4 + М ® CH3 . + H . + М; (k 1)
2. CH4 + CH3 . ® C2H6 + H . ; (k 2)
3. CH4 + H . ® CH3 . + H2 ; (k 3)
4. H . + CH3 . + M ® CH4 + M. (k 4)
Вывести уравнение для скорости образования C2H6 на основе приведенного механизма, используя метод стационарных концентраций. Концентрации СН3 · и Н · очень малы, поэтому стационарны и не должны входить в уравнение.
189. Химическая реакция N2O ® N2 + 0,5 O2 протекает по следующему механизму (М – инертная частица): 1. N2O + М ® N2О* + М; (k 1)
2. N2O * ® N2 + O . ; (k 2)
3. N2O * + М ® N2О + М; (k 3)
4. N2O + О ® N2 + O2 ; (k 4)
Считая концентрации N2O * и О . стационарными, найти выражение для скорости распада N2O.
190. Дана схема цепной реакции: АН ® А . + Н . , (k 1)
А . ® В . + С, (k 2)
АН + В . ® А . + D, (k 3)
А . + В . ® Р . (k 4)
Используя метод квазистационарных концентраций, вывести уравнение для скорости образования продукта Р.
191. Вывести уравнение для скорости разложения оксида азота (V) по суммарному уравнению 2 N2O 5 ( г) ® 4 NO2 ( г) + O2 ( г) при следующем механизме реакции (активные промежуточные частицы NO3 и NO):
1. N2O5 ® NO2 + NO3 ; (k 1)
2. NO 2 + NO 3 ® N 2 O 5 ; (k - 1)
3. NO 2 + NO 3 ® N O2 + O 2 + NO; (k 2)
4. NO + N 2 O 5 ® 3 NO 2 . (k 3)
192. При изучении кинетики реакции SiH 4 (г) ® Si (т) + 2 H 2 (г) был установлен следующий механизм: 1. SiH4 ® SiH2 + 2 H2 ; (k 1)
2. SiH2 ® Si + H2; (k 2)
3. SiH2 + H 2 ® SiH4 ; (k 3)
Используя метод квазистационарных концентраций, вывести уравнение для скорости разложения SiH4.
193. Для реакции нитрит - иона с кислородом предложен следующий механизм:
1. NO2 - + O2 ® NO3 - + O; (k 1)
2. NO2 - + O ® NO3- ; (k 2)
3. O + O ® O2; (k 3)
Вывести уравнение для скорости образования иона NO3 -, используя метод квазистационарных концентраций. Упростить полученное выражение, предполагая, что реакция (3) гораздо медленнее реакции (2).
194. Предложен следующий механизм разложения азотной кислоты:
1. HNO3 ® HO + NO2;
2. HO+NO2 ® HNO3;
3. HO+HNO3 ® H2O + NO3.
Предположив, что концентрация НО стационарна, вывести выражение для скорости разложения азотной кислоты. Как изменится приведенное выше уравнение, если предположить, что исчезновение NO2 происходит быстро?
195. Предполагают, что реакция разложения бромметана 2 CH3Br ® C2H6 + Br2 может протекать по следующему механизму: 1. CH3Br ® CH 3 . + Br . ; (k 1)
2. СН 3 . + CH3Br ® C2H6 + Br . ; (k 2)
3. Br . + CH3Br ® СН 3 . + Br2 ; (k 3)
4. 2 СН 3 . ® C2H6 . (k 4)
Используя метод квазистационарных концентраций, вывести уравнение для скорости образования этана.
196. Термическое разложение углеводорода R 2 протекает последующему механизму:
1. R 2 ® 2 R . ; (k 1)
2. R . + R 2 ® P B + R¢ . ; (k 2)
3. R¢ . ® P A + R . ; (k 3)
4. 2 R . ® P A + P B . (k 4)
Здесь R 2, PA , PB - устойчивые углеводороды, R . и R¢ . – радикалы. Найти зависимость скорости разложения R 2 от концентрации R 2.
197. Дана следующая схема разложения ацетальдегида:
1. СН3СНО ® СН 3 . + СНО . ; (k 1)
2. СН3 . + СН 3 СНО ® СН 4 + СН 2 СНО . ;(k 2)
3. СН2СНО . ® СН 3 . + СО; (k 3)
4. СН3 . + СН3 . ® С2Н6 ; (k 4)
Используя приближение квазистационарных концентраций, вывести выражение для скорости образования метана и скорости расходования ацетальдегида.
198. Предполагают, что реакция образования фосгена СО + Cl2 ® СОCl2 может протекать по следующему механизму: 1. Cl2 ®2 Cl . ; (k 1)
2. 2 Cl . ® Cl 2 ; (k 2)
3. СО + Cl . ® СОCl . ; (k 3)
4. СОCl . ® СО + Cl . ; (k 4)
5. СОCl . + Cl 2 ® СОCl2 + Cl . . (k 5)
Используя приближение стационарных концентраций, вывести выражение для скорости образования фосгена.
199. Предполагают, что распад вещества А 2 в растворителе RH протекает по следующему механизму: 1. А 2 ® 2 А . ;
2. А . ® Р + В . ;
3. В . +RH ® BH + R . ;
4. R . + R .®R – R.
Используя приближение квазистационарных концентраций, вывести выражение для скорости образования продукта Р.
200. Для реакции синтеза иодоводорода из простых веществ H2 (г)+ I2 (г) ®2HI (г) предложен следующий механизм: 1. I2 ® 2 I· ; (k 1)
2. 2I· ® I2 ; (k 2)
3. 2I· + H2 ® 2HI. (k 3)
Используя квазиравновесное приближение, вывести уравнение для скорости образования HI.
201. Для реакции 2 NO + O 2 ® 2 NO2 предложен следующий механизм:
1. 2 NO D (NO) 2 ; ( k 1, k – 1)
2. (NO)2 + O 2 ® 2 NO2. (k 2)
Вывести уравнение для скорости образования NO2 , предполагая, что первая стадия – быстрая, а вторая – медленная.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...