
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Данные опыта и результаты расчетов
| Масса цинка m(Zn), г. | Объем выделившегося водорода V , л | Условия опыта | Масса водорода m (H2), г. | Молярная масса эквивалентов цинка | |||
| Температура Т, К | давление атмосф. Р1, кПа | давление водяного пара Р2, кПа | практи- ческая МЭ,пр.(Zn), г/моль | теорети- ческая МЭ,т. (Zn), г/моль | |||
Вычисления
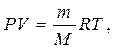 |
1. Вычислите массу выделившегося объема водорода, пользуясь уравнением Менделеева-Клапейрона:
где P - парциальное давление водорода; V - объем выделившегося водорода; m - масса водорода; M - молярная масса водорода; Т - температура опыта; R - универсальная газовая постоянная, равная 8,314 Дж/моль·К.
В нашем опыте водород собирается над водой и потому содержит водяной пар. Общее давление газа в приборе равно атмосферному, а складывается оно из парциальных давлений водорода и водяного пара. Для вычисления парциального давления водорода нужно из величины атмосферного давления вычесть величину давления насыщенного водяного пара при температуре опыта (табл.2). Р = Р1 - Р2.
2. Зная массу металла и массу водорода, по закону эквивалентов рассчитайте молярную массу эквивалентов цинка Мэ,пр. (Zn).
3 Рассчитайте теоретическую молярную массу эквивалентов цинка Мэ,т.(Zn).
4. Вычислите относительную ошибку опыта Е:
E = [(Mэ,т. - Mэ,пр.)/Mэ,т.)] ∙ 100 %.
Таблица 2
Давление насыщенного водяного пара при различных температурах
| Температура Т, К | Давление водяного пара, кПа | Температура Т, К | Давление водяного пара, кПа | Температура Т, К | Давление водяного пара, кПа |
| 1,693 | 2,186 | 2,799 | |||
| 1,817 | 2,337 | 2,982 | |||
| 1,933 | 2,479 | 3,166 | |||
| 2,062 | 2,642 | 3,360 |
Лабораторная работа 3
ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а с поглощением системой теплоты - эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔН. При экзотермической реакции энтальпия системы уменьшается и ΔН<0, а при эндотермической - энтальпия системы увеличивается и ΔН>0.
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают ΔН0.
Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями.
Например, термохимическое уравнение
СаО(К) + Н2O(Ж) = Са(ОН)2(К), ΔН0 = -65,3 кДж
показывает, что при взаимодействии 1 моль СаО и 1 моль воды образуется 1 моль Са(ОН)2 и выделяется количество теплоты, равное 65,3 кДж.
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса:тепловой эффект химической реакции (т. е. изменение энтальпии ΔН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Часто в термохимических расчетах применяют следствиеиз закона Гесса:энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ.
Например, стандартная энтальпия реакции
nА + mВ == рС + qD
рассчитывается по формуле
ΔН0х..р = ( р ΔН0298, С + q ΔН0298 , Р ) - ( n ΔН0 298 А + m ΔН0 298, в),
где ΔН0298 - стандартная энтальпия образования соединения.
Стандартной энтальпией (теплотой) образования вещества называется стандартная энтальпия реакции получения 1 моль данного вещества из простых веществ.
Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н++ОН- = Н20 (1)
Поэтому тепловой эффект реакции нейтрализации должен быть постоянным независимо от взятых кислоты и щелочи, если расчет вести на один эквивалент кислоты или щелочи.
Выполнение работы
Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов - внешнего и внутреннего, между которыми имеется изоляция из фольги.
В сухой внутренний стакан калориметра с помощью бюретки налейте 25мл раствора соляной кислоты с концентрацией 1 моль/л. В другой сухой стакан налейте из бюретки 25мл раствора щелочи такой же концентрации. Опустите в раствор кислоты термометр. Запишите температуру и, не вынимая термометр из стакана, быстро влейте в кислоту щелочь. Осторожно помешивая раствор термометром, отметьте и запишите максимальную температуру. Эту температуру считайте конечной. Полученные данные запишите в таблицу.
| Температура, К | Количество выделившейся теплоты ∆Н, кДЖ | ∆Н0нейтр.практ, кДж/моль | ∆Н0нейтр. теор, кДж/моль | Относит. ошибка опыта Е, % | |
| начальная | конечная | ||||
Вычисления
1. Рассчитайте количество выделившейся при реакции теплоты АН по формуле
ΔH = -VdcΔT,
где V - общий объем раствора; d - плотность раствора; с - теплоемкость раствора; AT - разность между конечной и начальной температурами.
Примите плотность раствора после нейтрализации равной 1 г/мл, а теплоемкость его, равной теплоемкости воды, т. е. 4,18 Дж/г-К.
2. Вычислите тепловой эффект реакции нейтрализации в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов НС1 содержится в 1 л (1000мл) раствора, а для реакции было взято 25 мл, то

3. Вычислите теоретическое значение теплоты реакции нейтрализации (АН иейтр. теор ) для уравнения (1). АН°298 образования Н+, ОБГ и Н20 соответственно равны 0, -230,2 и -285,8 кДж/моль.
4. Определите относительную ошибку опыта (Е)

Лабораторная работа 4
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени.
Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. В общем случае для реакции
nA + mB = pАВ
зависимость скорости реакции выражается уравнением:
V = k CАn×CВm
где CА и CВ - концентрации реагирующих веществ; k - константа скорости реакции. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза:
 |
где V2 и V1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции.
Выполнение работы
Зависимость скорости реакции от концентрации реагирующих веществ и температуры удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+ S↓ + H2O
Признаком реакции является помутнение раствора вследствие выделения серы. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить об относительной скорости реакции.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...