
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Лекция № 2. Химический элемент. Аллотропия.
Итак, как нами было выяснено в тексте прошлой лекции, атом – наименьшая частица химического элемента с одинаковым, положительным зарядом ядра. Из чего хорошо видно, что атом – носитель свойств химического элемента.
Химический элемент – это вид атомов, характеризующийся одинаковым положительным зарядом ядра.
Каждый химический элемент обозначают соответствующим символом, который в свою очередь подразумевает совокупность одного и того же вида атомов. Состав веществ условно обозначают химическими формулами, в которых соответствующими символами указывают химические элементы, входящие в состав вещества, а цифрами (индексами) – число атомов каждого химического элемента, входящего в состав данной молекулы. Химические формулы, указывающие истинное число атомов в молекуле, называют молекулярными или истинными формулами. Если же химическая формула указывает только относительное соотношение атомов в молекуле, то такие формулы называют эмпирическими или простейшими формулами. Эмпирические (простейшие) формулы отображают вид атомов и их относительное соотношение в молекуле. При написании формул часто указывают последовательность взаимного расположения атомов в молекуле. Такие формулы называют графическими. В формулах такого типа каждая химическая связь между атомами в молекуле обозначается чёрточкой. Необходимо отметить, что графические формулы не всегда дают правильное представление о собственно геометрии самой молекулы. Между понятиями «простое вещество» и «химический элемент» имеется существенное различие. Любое простое вещество характеризуется строго определённой совокупностью признаков – цветом, формой кристаллов (для твёрдых веществ), плотностью, температурой плавления, температурой кипения. Следовательно, этими и другими признаками простые вещества отличаются между собой. Говоря же о свойствах химического элемента, следует помнить, что под этим подразумевают характерные признаки отдельных атомов и в первую очередь – заряд ядра. Способность атомов химического элемента образовывать несколько простых веществ, называется аллотропией, а различные типы веществ образуемых атомами одного и того же химического элемента – называется его аллотропными модификациями. Явление аллотропии обусловлено несколькими причинами – образованием молекул с различным числом атомов, а также образованием кристаллов веществ различных модификаций – частный случай полиморфизма. Известно свыше 400 аллотропных модификаций простых веществ.
Лекция № 3. Относительная атомная и молекулярная масса. Количество вещества. Моль. Валентность.
Закон постоянства состава.
Итак, как нами было выяснено в тексте предыдущих лекций, атом представляет собой наименьшую частицу химического элемента с одинаковым, положительным зарядом ядра. Таким образом, как это хорошо видно, первой важной характеристикой атома является его заряд ядра. Второй важнейшей характеристикой атома является его масса. Масса представляет собой меру инертности тела по отношению к действующей на него силе, что хорошо видно из аналитического выражения второго закона Ньютона:
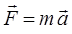
откуда соответственно:

Для характеристики масс атомов и молекул используют как абсолютные, так и относительные величины измерения. Абсолютные величины являются собственной характеристикой тела, показывая истинное значение величины. В отличие от абсолютных, относительные единицы измерения показывают насколько масса того или иного тела больше (или меньше) массы тела, принятого в качестве некоторого стандарта. Так, истинная масса атома химического элемента, называется абсолютной атомной массой  . Аналогично, истинная масса молекулы вещества, называется абсолютной молекулярной массой
. Аналогично, истинная масса молекулы вещества, называется абсолютной молекулярной массой  . Однако как показывает практика, выражать значения масс атомов или молекул посредством абсолютных единиц измерения, таких например, как – граммы, килограммы, центнеры или тонны – как минимум оказывается неудобным. Действительно, например масса атома углерода равна
. Однако как показывает практика, выражать значения масс атомов или молекул посредством абсолютных единиц измерения, таких например, как – граммы, килограммы, центнеры или тонны – как минимум оказывается неудобным. Действительно, например масса атома углерода равна  . Неудобство использования в практических расчётах абсолютных значений масс атомов и молекул, привели к необходимости использования так называемых относительных единиц измерения – относительных атомных и молекулярных масс. Как уже говорилось выше, в отличие от абсолютных единиц, относительные единицы измерения показывают, насколько масса атома или молекулы больше (меньше) некоторой массы, принятой за стандарт. В качестве такого стандарта принимают
. Неудобство использования в практических расчётах абсолютных значений масс атомов и молекул, привели к необходимости использования так называемых относительных единиц измерения – относительных атомных и молекулярных масс. Как уже говорилось выше, в отличие от абсолютных единиц, относительные единицы измерения показывают, насколько масса атома или молекулы больше (меньше) некоторой массы, принятой за стандарт. В качестве такого стандарта принимают  массы изотопа углерода
массы изотопа углерода  в котором массовое число
в котором массовое число  , принимает значение
, принимает значение  . Эта единица измерения атомной (молекулярной) массы получила название углеродной единицы (у.е.) или атомной единицы массы (а.е.м.):
. Эта единица измерения атомной (молекулярной) массы получила название углеродной единицы (у.е.) или атомной единицы массы (а.е.м.):

Такой подход создаёт единую основу, позволяя проводить все возможные физические (в том числе и технические) и химические расчёты.
Относительная атомная масса – это масса атома, выраженная в атомных единицах массы  . Относительная атомная масса показывает, во сколько раз масса атома данного химического элемента больше
. Относительная атомная масса показывает, во сколько раз масса атома данного химического элемента больше  массы изотопа углерода
массы изотопа углерода  . Например, относительная атомная масса железа
. Например, относительная атомная масса железа 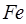 равна 56 а.е.м. Это в свою очередь означает, что атом железа
равна 56 а.е.м. Это в свою очередь означает, что атом железа  , в 56 раз тяжелее
, в 56 раз тяжелее  массы изотопа углерода
массы изотопа углерода  . Относительная атомная масса обозначается символом
. Относительная атомная масса обозначается символом 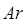 (где
(где 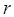 –начальная буква слова «relative» – относительный), а абсолютная атомная масса обозначается символом
–начальная буква слова «relative» – относительный), а абсолютная атомная масса обозначается символом  . Между абсолютной и относительной атомными массами существует простейшее соотношение, которое может быть в общем случае
. Между абсолютной и относительной атомными массами существует простейшее соотношение, которое может быть в общем случае
выражено формулой вида:

Для характеристики молекул можно пользоваться соответственно понятиями абсолютной  и относительной
и относительной  молекулярной массы.
молекулярной массы.
Относительная молекулярная масса – это масса молекулы, выраженная в атомных единицах массы  . Относительная молекулярная масса простых и сложных веществ равна сумме относительных атомных масс атомов, входящих в состав данной молекулы. Например:
. Относительная молекулярная масса простых и сложных веществ равна сумме относительных атомных масс атомов, входящих в состав данной молекулы. Например:


Как и в предыдущем случае, между абсолютной и относительной молекулярной массами существует простейшее соотношение, которое в общем случае может быть выражено формулой вида:

Количество вещества – физическое понятие, подразумевающее число структурных единиц (атомов, молекул, ионов или других частиц), образующих это вещество и обозначаемое символом 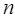 или греческой буквой
или греческой буквой  . Единицей количества вещества является
. Единицей количества вещества является 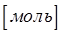 . Поскольку в практической деятельности оперируют не отдельными структурными единицами (атомами, молекулами или ионами), а значительным их количеством, то соответственно за единицу количества вещества в химии и физике принимают такое количество вещества
. Поскольку в практической деятельности оперируют не отдельными структурными единицами (атомами, молекулами или ионами), а значительным их количеством, то соответственно за единицу количества вещества в химии и физике принимают такое количество вещества  , которое содержит в общем случае
, которое содержит в общем случае  структурных или формульных единиц этого вещества (атомов, молекул, ионов или любых других частиц). Такое количество структурных (формульных) единиц вещества называют ещё числом (постоянной) Авогадро
структурных или формульных единиц этого вещества (атомов, молекул, ионов или любых других частиц). Такое количество структурных (формульных) единиц вещества называют ещё числом (постоянной) Авогадро  :
:

Таким образом, моль – это количество вещества определённой химической формулы, содержащее то же число структурных или формульных единиц (атомов, молекул, ионов, электронов или любых других частиц), какое имеется в 12 г чистого изотопа углерода  , а именно
, а именно  . Необходимо отметить, что понятие «моль» применимо не только к молекулам, но также и к атомам, ионам и любым другим частицам. Массу 1 моль данного вещества называют его молярной массой. Молярная масса вещества – это масса 1 моль вещества, выраженная в граммах. Молярная масса обозначается символом
. Необходимо отметить, что понятие «моль» применимо не только к молекулам, но также и к атомам, ионам и любым другим частицам. Массу 1 моль данного вещества называют его молярной массой. Молярная масса вещества – это масса 1 моль вещества, выраженная в граммах. Молярная масса обозначается символом  и имеет размерность
и имеет размерность  . Количество вещества
. Количество вещества  , масса
, масса 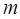 и молярная масса
и молярная масса  вещества взаимосвязаны между собой соотношением вида:
вещества взаимосвязаны между собой соотношением вида:

В правильности указанного выше уравнения связи убеждаемся, путём проверки размерности данного выражения. Действительно, имеем:
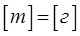
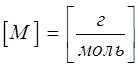
тогда будем иметь соответственно:

Из приведенной выше формулы взаимосвязи количества вещества с массой и молярной массой вещества:

следует, что:

а также, что:
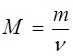
С учётом приведенных в тексте лекции соотношений, не трудно связать молярную массу вещества с его относительной молекулярной массой. Так, имеем:

тогда соответственно:

и таким образом:

где
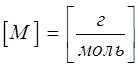
Как известно, атомы в молекулах связаны между собой посредством химических связей согласно их валентностям, поэтому, с одной стороны, исходя из формулы вещества, можно определить валентность атомов химических элементов. С другой стороны, формула химического соединения, как правило, составляется на основании валентностей соответствующих элементов. Количественной мерой валентности является число связей, образуемых данным атомом с другими атомами химических элементов, входящих в состав молекулы.
Валентность – это способность атомов химических элементов к образованию химических связей.
На основании введенных выше представлений рассмотрим бинарные соединения, т.е. соединения, состоящие из атомов двух химических элементов, которые можно в общем случае представить общей формулой:

На данном этапе научимся определять валентность кислородных и водородных соединений, а также решать обратную задачу – установление формулы вещества по их валентностям. Для реализации поставленных выше задач, рассмотрим так называемые водородные и кислородные соединения, на примере которых научимся решать прямую и обратную задачу, связанную с определением валентностей входящих в состав бинарного соединения элементов и, наоборот – на основании данных о числе атомов элементов входящих в состав бинарного соединения – определять валентности соответствующих химических элементов.
I. Водородные соединения:
Как известно, водород может образовывать с атомами других элементов только одну химическую связь, поэтому исходя из определения валентности, легко установить, что валентность атома водорода будет равняться единице  :
:

II. Кислородные соединения:
Использование кислородных соединений более целесообразней, поскольку не для всех элементов получены соединения с водородом. Зная, что атом кислорода всегда присоединяет два атома одновалентного элемента, т.е. валентность кислорода равняется двум  , а также зная состав кислородного соединения данного элемента, можно легко определить валентность этого химического элемента:
, а также зная состав кислородного соединения данного элемента, можно легко определить валентность этого химического элемента:

Кроме рассмотренных способов установления валентности по водороду и кислороду, в более сложных молекулах валентность находят по числу химических связей, образуемых данным атомом с атомами других химических элементов, входящих в состав молекулы данного химического соединения. На основании формулы данного химического соединения оказывается возможным решать следующие основные задачи: находить валентность атомов химических элементов, входящих в состав молекулы заданного состава; находить атомное соотношение элементов в молекуле; находить соотношение атомных масс; находить массовые доли каждого химического соединения, входящего в состав молекулы.
В общем случае имеется обобщённый способ нахождения валентностей атомов, входящих в состав молекулы заданного состава. Данный метод основывается на нахождении наименьшего общего кратного числа атомов входящих в состав молекулы заданного состава и наоборот – исходя из значений валентностей атомов химических элементов, входящих в состав молекулы вещества, устанавливать атомное соотношение. Данный подход основывается на законе постоянства состава, согласно которому «Любое вещество имеет постоянный состав независимо от способа его получения», т.е. имеем соответственно:

Например, для случая оксида натрия, имеем соответственно:

или в общем случае:
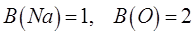
В общем случае общим кратным двух натуральных чисел называется число, которое делится на оба эти числа на цело (без остатка). Наименьшим общим кратным (НОК) двух и более натуральных чисел называется наименьшее натуральное число, которое само делится нацело на каждое из этих чисел. Вспомним, как находят наименьшее общее кратное (НОК) для двух и большего количества чисел. Этот способ оказывается особенно удобным для нахождения наименьшего общего кратного (НОК) трёх и большего количества чисел:
1. Разложить данные числа на простые множители. Например, если нам даны два натуральных числа 24 и 60, тогда будем иметь соответственно:
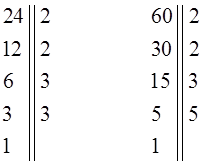
2. Выписать в строчку множители, входящие в разложение самого большого из чисел, а под ним или рядом с ним – разложение остальных чисел, т.е. имеем:

При этом необходимо помнить, что количество одинаковых множителей в разложениях соответствующих чисел может быть различным.
3. Подчеркнуть в разложении меньшего числа множители, которые не вошли в разложение большего числа (в нашем примере это число 2) и добавить эти множители в разложение большего числа:

4. Полученное произведение записать в ответ:
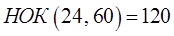
Возвращаясь к бинарным соединениям, имеем соответственно:
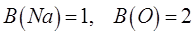
тогда наименьшее общее кратное (НОК) этих двух чисел будет:
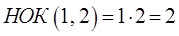
т.е. имеем соответственно:
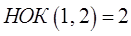
и далее, деля полученное выше значение для НОК соответственно на единицу, отвечающее значению валентности атома натрия  , находим, что число
, находим, что число 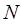 атомов натрия
атомов натрия 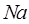 будет равно соответственно:
будет равно соответственно:

т.е. имеем:

Аналогично находим число атомов 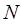 кислорода в соответствующем бинарном соединении, учитывая, что валентность атома кислорода равна двум. Принимая во внимание значение валентности кислорода
кислорода в соответствующем бинарном соединении, учитывая, что валентность атома кислорода равна двум. Принимая во внимание значение валентности кислорода 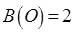 , находим, что число
, находим, что число 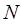 атомов кислорода
атомов кислорода 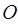 будет равно соответственно:
будет равно соответственно:

т.е. имеем:

и таким образом бинарное соединение общего вида:
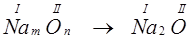
Поступая аналогичным способом, можно решить обратную задачу – по числу атомов входящих в состав молекул бинарного соединения найти валентности атомов соответствующих элементов, входящих в состав в состав молекулы. Данный метод особенно хорош при решении прямых и обратных задач для соединений, в состав которых входит более двух химических элементов.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...