
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Лекция № 4. Газообразное состояние вещества.
Закон Авогадро. Следствия из закона Авогадро.
Молярный объём газов.
Любой образец вещества характеризуется не только такими количественными показателями, как например масса, количество вещества, но характеризуется ещё и объёмом. Особенно важны измерения объёмов для веществ находящихся в газообразном состоянии. Гей-Люсак, изучая взаимодействие веществ в газообразном состоянии, вывел закон простых объёмных отношений, согласно которому: «Объёмы вступающих в реакцию газов при неизменной температуре и давлении относятся друг по отношению к другу, а также к объёмам образующихся газообразных продуктов как небольшие целые числа». Например, для реакции:
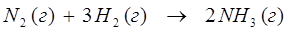
объёмы реагирующих и образующихся газов относятся друг по отношению к другу как небольшие целые числа 1:3:2. Для объяснения этого закона Авогадро выдвинул гипотезу, которая в дальнейшем была подтверждена экспериментально и получила название закона Авогадро: «В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул». Из закона Авогадро вытекает два важных следствия:
1. Одинаковое число молекул различных газов будут занимать одинаковый объём, равный 22,4 литра. Такой объём газов получил название молярного объёма 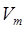 . Верно и обратное – молярный объём
. Верно и обратное – молярный объём 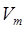 различных газов одинаков и равен 22,4 л.
различных газов одинаков и равен 22,4 л.
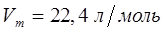
Действительно, поскольку 1 моль любого вещества содержит одинаковое число молекул, равное  , то очевидно и их объёмы в газообразном состоянии при одинаковых условиях будут одинаковыми. Таким образом, при нормальных условиях (н.у.), т.е. при давлении
, то очевидно и их объёмы в газообразном состоянии при одинаковых условиях будут одинаковыми. Таким образом, при нормальных условиях (н.у.), т.е. при давлении  и температуре
и температуре  молярный объём различных газов
молярный объём различных газов 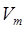 будет составлять
будет составлять  . Количество вещества
. Количество вещества  , объём
, объём  и молярный объём
и молярный объём 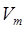 газов могут быть связаны между собой в общем случае соотношением вида:
газов могут быть связаны между собой в общем случае соотношением вида:
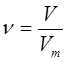
откуда соответственно:

В общем случае различают нормальные условия (н.у.):


к стандартным условиям относят:

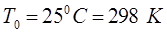
Для того чтобы перевести температуру по шкале Цельсия в температуру по шкале Кельвина, используют следующее соотношение:

Массу собственно газа можно вычислить по значению его плотности  , т.е.
, т.е.
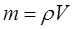
Поскольку как было показано выше:

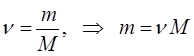
тогда очевидно:
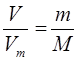
откуда соответственно:
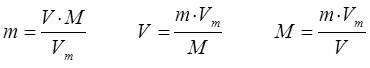
где
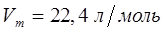
Из приведенных выше соотношений вида:


после подстановки в выражение:
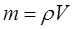
также следует, что:

откуда соответственно:
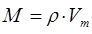
и таким образом имеем:
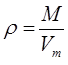
Поскольку при нормальных условиях 1 моль любого занимает объём равный:
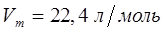
тогда соответственно:

Полученное таким образом соотношение достаточно важно для понимания 2-го следствия из закона Авогадро, которое в свою очередь непосредственно связано с таким понятием как относительная плотность газов  .
.
2. Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее или легче другого, т.е. во сколько раз плотность одного газа больше или меньше плотности другого, т.е. имеем соотношение вида:

Так, для первого газа имеем:

соответственно для второго газа:

тогда очевидно:

и таким образом:
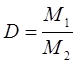
Другими словами, относительная плотность газа  есть отношение молекулярной массы исследуемого газа к молекулярной массе газа, с которым производится сравнение. Относительная плотность газа – безразмерная величина. Таким образом, для того чтобы вычислить относительную плотность одного газа по другому, достаточно знать молекулярные относительные молекулярные массы этих газов. Для того чтобы было понятно, с каким газом проводят сравнение, ставят индекс. Например,
есть отношение молекулярной массы исследуемого газа к молекулярной массе газа, с которым производится сравнение. Относительная плотность газа – безразмерная величина. Таким образом, для того чтобы вычислить относительную плотность одного газа по другому, достаточно знать молекулярные относительные молекулярные массы этих газов. Для того чтобы было понятно, с каким газом проводят сравнение, ставят индекс. Например,  обозначает, что сравнение проводят с водороду и тогда говорят о плотности газа по водороду, не употребляя уже слово «относительная», принимая это как бы по умолчанию. Аналогично измерения проводят, беря в качестве газа сравнения – воздух. В этом случае указывают, что сравнение исследуемого газа проводят с воздухом
обозначает, что сравнение проводят с водороду и тогда говорят о плотности газа по водороду, не употребляя уже слово «относительная», принимая это как бы по умолчанию. Аналогично измерения проводят, беря в качестве газа сравнения – воздух. В этом случае указывают, что сравнение исследуемого газа проводят с воздухом  . При этом средняя молекулярная масса воздуха принимается равной 29
. При этом средняя молекулярная масса воздуха принимается равной 29  , а поскольку относительная молекулярная масса и молярная масса численно совпадают, тогда:
, а поскольку относительная молекулярная масса и молярная масса численно совпадают, тогда:

Химическая формула исследуемого газа ставится рядом в скобках, например:

и читается как – плотность хлора по водороду. Зная относительную плотность одного газа по отношению к другому, можно вычислить молекулярную, а также молярную массу газа, даже если формула вещества неизвестна. Все приведенные выше соотношения относятся к так называемым нормальным условиям, т.е. к условиям, когда:


Законы Газового состояния.
До сих пор мы рассматривали поведение идеальных газов и процессы превращения в так называемых – нормальных условиях. Если же условия оказываются отличными от нормальных, то для приведения объёма газа к нормальным условиям пользуются уравнениями, основанными на законах газового состояния. Законы газового состояния применимы к расчёту молярных масс веществ не только в газообразном состоянии, но также и ко всем веществам, способным при нагревании переходить в газообразное состояние без разложения. Так, в зависимости от внешних условий (температуры и давления) почти каждое вещество может находиться в одном из агрегатных состояний – твёрдом, жидком, газообразном или плазменном. Газообразное состояние, в общем случае характеризуется малыми силами межмолекулярного взаимодействия, вследствие чего газ равномерно распределяется, занимая весь предоставленный ему объём. Жидкое состояние вещества характеризуется сравнительно большими силами межмолекулярного взаимодействия, поэтому молекулы теряют способность перемещаться независимо друг от друга. По этой причине тело может легко менять свою форму, но при этом мало изменяет объём. Твёрдое состояние вещества характеризуется главным образом определённым порядком в расположении молекул, атомов или ионов, образующих кристаллическую решётку данного вещества. Необходимо отметить, что для некоторых соединений не все первые три агрегатные состояния оказываются достижимы. Например, карбонат кальция, практически не удаётся получить ни в жидком, ни в газообразном состояниях, так как он при нагревании разлагается на оксид кальция и оксид углерода (IV). Для целого же ряда веществ возможны условия, при которых вещество может находиться одновременно в двух или даже в трёх агрегатных состояниях. Так, например, вода при температуре  и давлении
и давлении  находится в устойчивом равновесии в трёх состоянии – льда, жидкой воды и водяного пара (тройная точка воды). Плазменное состояние вещества характеризуется как газ, обладающий электропроводностью и другими свойствами, связанными с электропроводностью. Когда газ очень сильно разрежен, то расстояния между молекулами сравнительно велики, силы межмолекулярного взаимодействия ничтожно малы и ими в общем случае, можно пренебречь. При этом объём молекул составляет ничтожно малую часть всего объёма, занимаемого газом. Такое предельно разреженное состояние газа называется идеальным, а сам газ, находящийся в таком предельно разреженном состоянии – идеальным газом. Идеальный газ подчиняется законам газового состояния (газовым законам). На практике всегда наблюдаются отклонения от идеального состояния, которые тем более велики, чем больше плотность газа, т.е. реальные газы, отклоняются от газовых законов тем значительнее, чем ниже температура и выше давление. Рассмотрим свойства идеальных газов более подробней. Так, физическое состояние данной массы идеального газа определяется тремя величинами: температурой –
находится в устойчивом равновесии в трёх состоянии – льда, жидкой воды и водяного пара (тройная точка воды). Плазменное состояние вещества характеризуется как газ, обладающий электропроводностью и другими свойствами, связанными с электропроводностью. Когда газ очень сильно разрежен, то расстояния между молекулами сравнительно велики, силы межмолекулярного взаимодействия ничтожно малы и ими в общем случае, можно пренебречь. При этом объём молекул составляет ничтожно малую часть всего объёма, занимаемого газом. Такое предельно разреженное состояние газа называется идеальным, а сам газ, находящийся в таком предельно разреженном состоянии – идеальным газом. Идеальный газ подчиняется законам газового состояния (газовым законам). На практике всегда наблюдаются отклонения от идеального состояния, которые тем более велики, чем больше плотность газа, т.е. реальные газы, отклоняются от газовых законов тем значительнее, чем ниже температура и выше давление. Рассмотрим свойства идеальных газов более подробней. Так, физическое состояние данной массы идеального газа определяется тремя величинами: температурой –  , давлением –
, давлением –  и объёмом –
и объёмом –  . Все эти величины (параметры состояния) находятся между собой в определённой функциональной зависимости, выражаемой уравнением вида:
. Все эти величины (параметры состояния) находятся между собой в определённой функциональной зависимости, выражаемой уравнением вида:
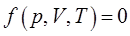
Такая зависимость носит название уравнения состояния, которое вытекает из газовых законов Бойля-Мариотта, Гей-Люсака, Шарля и Авогадро. Параметры, входящие в уравнение состояния, также связаны между собой. Как было сказано уже выше, параметры, входящие в уравнение состояния, находятся между собой в так называемой функциональной зависимости. Эту функциональную зависимость, в общем случае, можно выразить уравнением состояния. Однако наибольшей наглядностью, в данном случае, обладает так называемое цепочечное соотношение Эйлера, показывающее функциональную зависимость величин, входящих в уравнение состояния. К данному соотношению мы вернёмся немного позже, а пока детально рассмотрим законы газового состояния.
2.1. Закон Бойля-Мариотта ( 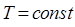 ):
):
«Объём данной массы (или количества) газа  при постоянной температуре
при постоянной температуре  , изменяется обратно пропорционально давлению
, изменяется обратно пропорционально давлению  , под которым находится рассматриваемый газ», т.е. имеем:
, под которым находится рассматриваемый газ», т.е. имеем:
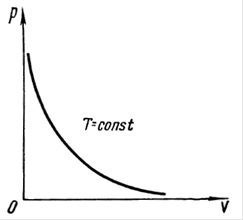
Рис.1. Изотерма идеального газа в координатах 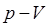
Действительно, на основании приведенной выше формулировки и схемы изотермического процесса, при котором происходит расширение газа, имеем:
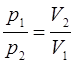
откуда следует соответственно, что:

Аналогичное равенство можно записать и для других значений параметров  и
и  :
:
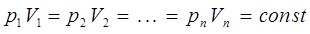
или отбросив индексы, при условии, что 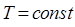 , можно будет записать:
, можно будет записать:
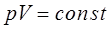
Таким образом, произведение объёма газа на его давление при постоянной температуре 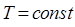 есть величина постоянная. Необходимо отметить, что величина константы в полученном выше уравнении зависит от природы газа, его количества и температуры, но не зависит от изменения объёма или изменения давления. На приведенном выше рисунке (рис.1) дано графическое изображение закона Бойля-Мариотта (изотермический процесс) в системе координат
есть величина постоянная. Необходимо отметить, что величина константы в полученном выше уравнении зависит от природы газа, его количества и температуры, но не зависит от изменения объёма или изменения давления. На приведенном выше рисунке (рис.1) дано графическое изображение закона Бойля-Мариотта (изотермический процесс) в системе координат 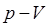 . Кривая в данном случае представляет собой равностороннюю гиперболу, асимптотически приближающуюся к осям координат. Для любой точки такой гиперболы произведения величин абсциссы на ординату равны между собой. Линии, выражающие зависимость изменения объёма от давления при постоянной температуре
. Кривая в данном случае представляет собой равностороннюю гиперболу, асимптотически приближающуюся к осям координат. Для любой точки такой гиперболы произведения величин абсциссы на ординату равны между собой. Линии, выражающие зависимость изменения объёма от давления при постоянной температуре 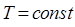 , носят название изотерм идеального газа.
, носят название изотерм идеального газа.
2.2. Законы Шарля и Гей-Люссака:
Изучая процессы изобарического 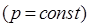 и изохорического
и изохорического  расширения газов, французский физик Ж. Л. Гей-Люссак в 1802 г. Установил следующие два закона, названные его именем:
расширения газов, французский физик Ж. Л. Гей-Люссак в 1802 г. Установил следующие два закона, названные его именем:
1. Для данной массы газа при постоянном давлении 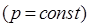 объём газа изменяется линейно с температурой, т.е.
объём газа изменяется линейно с температурой, т.е.

где 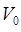 – объём газа при
– объём газа при  ;
;  – объём газа при температуре
– объём газа при температуре 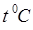 и соответственно
и соответственно 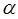 – коэффициент объёмного расширения газа.
– коэффициент объёмного расширения газа.
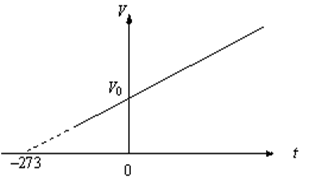
Рис.2. Изобара идеального газа в координатах 
2. Для данной массы газа при постоянном объёме  давление газа изменяется линейно с температурой, т.е.
давление газа изменяется линейно с температурой, т.е.

где 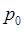 – давление газа при
– давление газа при  ;
;  – давление газа при температуре
– давление газа при температуре 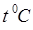 и соответственно
и соответственно  – термический коэффициент давления газа.
– термический коэффициент давления газа.

Рис.3. Изохора идеального газа в координатах 
Необходимо отметить, что закон для изохорического процесса  был высказан в предположительной форме французским учёным и воздухоплавателем Шарлем и потому закон линейного расширения идеального газа при постоянном объёме
был высказан в предположительной форме французским учёным и воздухоплавателем Шарлем и потому закон линейного расширения идеального газа при постоянном объёме  иногда называют законом Шарля. Поэтому данный закон для изохорического расширения газов с полным правом можно называть как законом Гей-Люссака, так и законом Шарля, устанавливая соотношение между объёмом или давлением данной массы идеального газа и температурой при постоянных давлении
иногда называют законом Шарля. Поэтому данный закон для изохорического расширения газов с полным правом можно называть как законом Гей-Люссака, так и законом Шарля, устанавливая соотношение между объёмом или давлением данной массы идеального газа и температурой при постоянных давлении 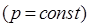 и соответственно объёме
и соответственно объёме  . Как оказалось, для всех газов:
. Как оказалось, для всех газов:

Согласно уравнениям:


изобарический и изохорический процессы на соответствующих графиках можно представить прямыми линиями (изобарами и изохорами), проходящими наклонно к оси температур и пересекающими её в точке  . Данная точка принята за начало отсчёта новой шкалы температур, называемой также термодинамической шкалой или шкалой Кельвина. Температура, отсчитываемая по этой шкале, называется термодинамической шкалой температур (или абсолютной шкалой). Нуль данной шкалы, взятый за точку начала отсчёта, называется абсолютным нулём температур. Если цену деления термодинамической шкалы сохранить той же, что и на шкале Цельсия, то очевидно термодинамическая температура
. Данная точка принята за начало отсчёта новой шкалы температур, называемой также термодинамической шкалой или шкалой Кельвина. Температура, отсчитываемая по этой шкале, называется термодинамической шкалой температур (или абсолютной шкалой). Нуль данной шкалы, взятый за точку начала отсчёта, называется абсолютным нулём температур. Если цену деления термодинамической шкалы сохранить той же, что и на шкале Цельсия, то очевидно термодинамическая температура  и температура, измеряемая по шкале Цельсия
и температура, измеряемая по шкале Цельсия  , будут связаны между собой следующим соотношением вида:
, будут связаны между собой следующим соотношением вида:

откуда:

а также:
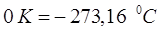
или

Из формулы для изобарического процесса 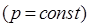 :
:

следует, что при температуре, равной  :
:
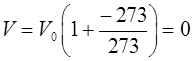
т.е. при температуре  вещество исчезает. Этот явно неверный вывод подтверждает уже упоминавшееся положение о том, что полученные экспериментально газовые законы оказываются неприменимыми в области низких температур. Действительно, при низкой температуре вещество не может существовать в газообразном состоянии, переходя в жидкое и даже твёрдое состояние. Таким образом, воспользовавшись для установления термодинамической температуры, а также установления значения нуля Кельвина законами Гей-Люссака и Шарля, мы поступили сугубо формально. Однако в 1852 г. В. Кельвин исходя из принципиально иных физических явлений, теоретически установил ту же самую шкалу температур с тем же самым значением нуля, какое формально было получено ранее из законов Гей-Люссака и Шарля. Поэтому абсолютную (термодинамическую) шкалу температур и
вещество исчезает. Этот явно неверный вывод подтверждает уже упоминавшееся положение о том, что полученные экспериментально газовые законы оказываются неприменимыми в области низких температур. Действительно, при низкой температуре вещество не может существовать в газообразном состоянии, переходя в жидкое и даже твёрдое состояние. Таким образом, воспользовавшись для установления термодинамической температуры, а также установления значения нуля Кельвина законами Гей-Люссака и Шарля, мы поступили сугубо формально. Однако в 1852 г. В. Кельвин исходя из принципиально иных физических явлений, теоретически установил ту же самую шкалу температур с тем же самым значением нуля, какое формально было получено ранее из законов Гей-Люссака и Шарля. Поэтому абсолютную (термодинамическую) шкалу температур и  не следует рассматривать как формальные понятия, не имеющие физического смысла. Нуль этой шкалы (абсолютный нуль температур), как показал В. Кельвин, самая низкая из возможных температур вещества. Так, например, при
не следует рассматривать как формальные понятия, не имеющие физического смысла. Нуль этой шкалы (абсолютный нуль температур), как показал В. Кельвин, самая низкая из возможных температур вещества. Так, например, при  полностью прекращается хаотическое движение молекул в веществе. Однако это совсем не означает, что в нём вообще прекращается всякое движение. Сохраняется, например, движение электронов в атомах и молекулах. Более ста лет учёные упорно продвигались к естественной нижней границе температур – абсолютному нулю. Открытия, сделанные на этом пути, оказались настолько своеобразными, а свойства вещества – такими необычными, что получение низких температур, специфическая техника эксперимента и сами исследования фундаментальных свойств вещества в этих условиях получили право на выделение в самостоятельную научно – техническую область – физику и технику низких температур. Физику низких температур можно назвать «физикой квантования энергии в конденсированном состоянии вещества, поскольку именно при понижении температуры затухает хаос тепловых колебаний атомов и молекул и на сцену выступает истинная – квантовая – сущность твёрдых тел в виде совершенно новых явлений, из которых два – сверхтекучесть жидкого гелия и сверхпроводимость металлов – являются наиболее яркими и необычными». Действительно, может возникнуть резонный вопрос: можно ли заморозить молекулу? Вопрос сам по себе интересный, но с позиции классической механики и термодинамики на него ответить не представляется возможным. Ответ на этот вопрос можно получить только с позиции квантовой механики, рассматривая в качестве удобных модельных объектов модель квантования осциллятора и рассмотрении колебательных степеней свободы молекулы:
полностью прекращается хаотическое движение молекул в веществе. Однако это совсем не означает, что в нём вообще прекращается всякое движение. Сохраняется, например, движение электронов в атомах и молекулах. Более ста лет учёные упорно продвигались к естественной нижней границе температур – абсолютному нулю. Открытия, сделанные на этом пути, оказались настолько своеобразными, а свойства вещества – такими необычными, что получение низких температур, специфическая техника эксперимента и сами исследования фундаментальных свойств вещества в этих условиях получили право на выделение в самостоятельную научно – техническую область – физику и технику низких температур. Физику низких температур можно назвать «физикой квантования энергии в конденсированном состоянии вещества, поскольку именно при понижении температуры затухает хаос тепловых колебаний атомов и молекул и на сцену выступает истинная – квантовая – сущность твёрдых тел в виде совершенно новых явлений, из которых два – сверхтекучесть жидкого гелия и сверхпроводимость металлов – являются наиболее яркими и необычными». Действительно, может возникнуть резонный вопрос: можно ли заморозить молекулу? Вопрос сам по себе интересный, но с позиции классической механики и термодинамики на него ответить не представляется возможным. Ответ на этот вопрос можно получить только с позиции квантовой механики, рассматривая в качестве удобных модельных объектов модель квантования осциллятора и рассмотрении колебательных степеней свободы молекулы:

Действительно, имеем:

или учитывая, что:


будем иметь соответственно:

откуда соответственно:

и аналогично получаем:
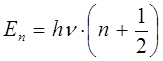

Рис.4. Ангармонизм колебаний осциллятора
Спектр квантового осциллятора, описываемый уравнениями вида:


или

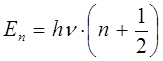
называется эквидистантным или равноотстоящим. Необходимо отметить, что наименьшая энергия  начинается с ненулевого значения:
начинается с ненулевого значения:

тогда как в классической механике 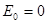 (состояние покоя
(состояние покоя  и
и 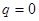 ). Таким образом, квантовый осциллятор, в отличие от своего классического аналога, никогда не находится в состоянии покоя. Даже в состоянии с наименьшей энергией
). Таким образом, квантовый осциллятор, в отличие от своего классического аналога, никогда не находится в состоянии покоя. Даже в состоянии с наименьшей энергией  частица колеблется (что находится в полном соответствии с принципом неопределённости Гейзенберга):
частица колеблется (что находится в полном соответствии с принципом неопределённости Гейзенберга):
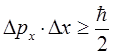


если бы такого не происходило (отсутствовала энергия нулевых колебаний  ), тогда в силу вступали бы законы классической механики, т.е. существовала бы возможность одновременного измерения двух физических величин – координаты и импульса частицы. Существование ненулевого значения энергии
), тогда в силу вступали бы законы классической механики, т.е. существовала бы возможность одновременного измерения двух физических величин – координаты и импульса частицы. Существование ненулевого значения энергии  находит своё отражение в физических явлениях, возникающих при низких температурах (в том числе и при
находит своё отражение в физических явлениях, возникающих при низких температурах (в том числе и при  ). Так, рассеяние света кристаллами обусловлено колебаниями атомов кристаллической решётки. При понижении температуры, амплитуда колебаний понижается, однако сами колебания как показали экспериментальные данные, не прекращаются и вблизи абсолютного нуля. Это в свою очередь приводит к соответствующему рассеянию света. Другой важный пример – нулевые колебания вакуума. Так, электромагнитное поле описывается набором осцилляторов, представляющих колебания векторов напряжённости электрического
). Так, рассеяние света кристаллами обусловлено колебаниями атомов кристаллической решётки. При понижении температуры, амплитуда колебаний понижается, однако сами колебания как показали экспериментальные данные, не прекращаются и вблизи абсолютного нуля. Это в свою очередь приводит к соответствующему рассеянию света. Другой важный пример – нулевые колебания вакуума. Так, электромагнитное поле описывается набором осцилляторов, представляющих колебания векторов напряжённости электрического  и магнитного
и магнитного  поля. Квантование осцилляторов поля позволяет правильно интерпретировать основное его состояние – вакуум. Так, в вакууме
поля. Квантование осцилляторов поля позволяет правильно интерпретировать основное его состояние – вакуум. Так, в вакууме  , но из-за нулевых колебаний электромагнитное поле флуктуирует, т.е.
, но из-за нулевых колебаний электромагнитное поле флуктуирует, т.е. 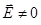 . Это, в свою очередь, приводит к флуктуациям координаты электрона в атомах и молекулах, а, следовательно, к смещению всех энергетических уровней (так называемый лэмбовский сдвиг). Хотя сам сдвиг и незначителен (например, в атоме кислорода
. Это, в свою очередь, приводит к флуктуациям координаты электрона в атомах и молекулах, а, следовательно, к смещению всех энергетических уровней (так называемый лэмбовский сдвиг). Хотя сам сдвиг и незначителен (например, в атоме кислорода  эВ), он имеет принципиальное значение, подтверждая, таким образом, существование наличия нулевых колебаний и таким образом основные концепции квантовой механики. В настоящее время удаётся охладить малые объёмы вещества до температуры, близкой к
эВ), он имеет принципиальное значение, подтверждая, таким образом, существование наличия нулевых колебаний и таким образом основные концепции квантовой механики. В настоящее время удаётся охладить малые объёмы вещества до температуры, близкой к  , не достигая последнего лишь на несколько тысячных долей кельвина. Возвратимся теперь к законам Шарля и Гей-Люссака. Итак, как мы говорили выше, введение абсолютной шкалы температур с чисто формальной точки зрения, позволяет дать наглядную, физическую интерпретацию коэффициентов объёмного расширения
, не достигая последнего лишь на несколько тысячных долей кельвина. Возвратимся теперь к законам Шарля и Гей-Люссака. Итак, как мы говорили выше, введение абсолютной шкалы температур с чисто формальной точки зрения, позволяет дать наглядную, физическую интерпретацию коэффициентов объёмного расширения 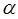 и термического давления
и термического давления  газов. Используя понятие термодинамической температуры, а также численное значения данных коэффициентов, формулам:
газов. Используя понятие термодинамической температуры, а также численное значения данных коэффициентов, формулам:


где

можно будет придать более простой вид. Так, по определению имеем:

тогда соответственно:
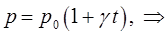
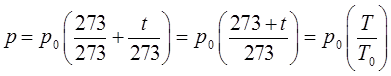
откуда:

и далее после преобразования:

откуда соответственно:

и таким образом:

или что то же самое:

здесь:

Из полученного выражения хорошо прослеживается линейная зависимость давления газа  от температуры
от температуры  . Беря произвольные значения температур и давления для одного и того же газа, можно получить бесконечное множество графиков линейных функций, называемых также изохорами идеального газа в координатах
. Беря произвольные значения температур и давления для одного и того же газа, можно получить бесконечное множество графиков линейных функций, называемых также изохорами идеального газа в координатах  . Для различных значений этих параметров очевидно справедливо:
. Для различных значений этих параметров очевидно справедливо:
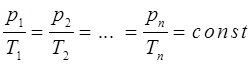
или отбросив индексы, при условии, что 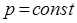 , можно будет записать:
, можно будет записать:
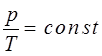
Рассмотрим теперь формулу:

Так, учитывая, что:

а также:

будем иметь соответственно:

откуда:
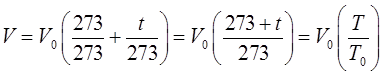
откуда имеем соответственно:
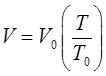
и далее после преобразования:

откуда соответственно:
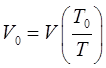
и таким образом:

или что то же самое:
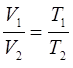
здесь:

Из полученного выражения хорошо прослеживается линейная зависимость объёма газа  от температуры
от температуры  . Беря произвольные значения температур и объёма для одного и того же газа, можно получить бесконечное множество графиков линейных функций, называемых также изобарами идеального газа в координатах
. Беря произвольные значения температур и объёма для одного и того же газа, можно получить бесконечное множество графиков линейных функций, называемых также изобарами идеального газа в координатах  . Для различных значений этих параметров очевидно справедливо:
. Для различных значений этих параметров очевидно справедливо:
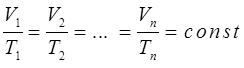
или отбросив индексы, при условии, что 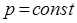 , можно будет записать:
, можно будет записать:

Полученные нами выше уравнения для изобарического (1) и изохорического (2) расширения идеального газа:
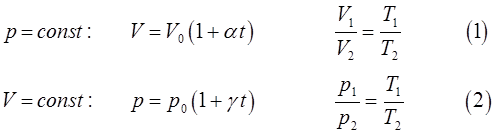
представляют собой математические выражения законов Гей-Люссака. Если же учесть, что для изохорического процесса  закон расширения идеального газа был высказан в предположительной форме французским учёным и воздухоплавателем Шарлем, то тогда очевидно формула (2) будет представлять собой математическое выражение закона Шарля.
закон расширения идеального газа был высказан в предположительной форме французским учёным и воздухоплавателем Шарлем, то тогда очевидно формула (2) будет представлять собой математическое выражение закона Шарля.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...