
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Закон Авогадро и следствия из него.
Закон Авогадро, открытый в 1811 г., сыграл большую роль в развитии хими. Прежде всего он способствовал признанию атомно-молекулярного учения, сформулированного впервые в середине XVIII в. М.В. Ломоносовым. Так, например, пользуясь числом Авогадро:

оказалось возможным вычислять не только абсолютные массы атомов и молекул, но и собственно линейные размеры этих частиц. Согласно закону Авогадро:
«В равных объёмах различных газов при постоянном давлении и температуре содержится одинаковое число молекул, равное  »
»
Из закона Авогадро вытекает ряд важных следствий касающихся молярного объёма и плотности газов. Так, из закона Авогадро непосредственно следует, что одинаковое число молекул различных газов будут занимать одинаковый объём, равный 22,4 литра. Такой объём газов получил название молярного объёма 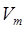 . Верно и обратное – молярный объём
. Верно и обратное – молярный объём 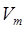 различных газов одинаков и равен 22,4 л:
различных газов одинаков и равен 22,4 л:
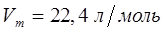
Действительно, поскольку 1 моль любого вещества содержит одинаковое число молекул, равное  , то очевидно и их объёмы в газообразном состоянии при одинаковых условиях будут одинаковыми. Таким образом, при нормальных условиях (н.у.), т.е. при давлении
, то очевидно и их объёмы в газообразном состоянии при одинаковых условиях будут одинаковыми. Таким образом, при нормальных условиях (н.у.), т.е. при давлении  и температуре
и температуре  молярный объём различных газов
молярный объём различных газов 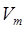 будет составлять
будет составлять  . Количество вещества
. Количество вещества  , объём
, объём  и молярный объём
и молярный объём 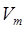 газов могут быть связаны между собой в общем случае соотношением вида:
газов могут быть связаны между собой в общем случае соотношением вида:
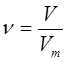
откуда соответственно:

В общем случае различают нормальные условия (н.у.):


к стандартным условиям относят:

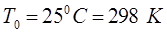
Для того чтобы перевести температуру по шкале Цельсия в температуру по шкале Кельвина, используют следующее соотношение:

Массу собственно газа можно вычислить по значению его плотности  , т.е.
, т.е.
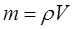
Поскольку как было показано выше:

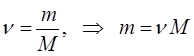
тогда очевидно:
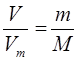
откуда соответственно:

а также

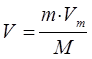
где
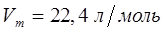
Из приведенных нами выше соотношений вида:


после подстановки в выражение:
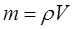
также следует, что:

откуда соответственно:
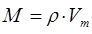
и таким образом имеем:
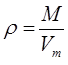
Поскольку при нормальных условиях 1 моль любого занимает объём равный:
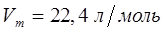
тогда соответственно:

Полученное таким образом соотношение достаточно важно для понимания 2-го следствия из закона Авогадро, которое в свою очередь непосредственно связано с таким понятием как относительная плотность газов  . В общем случае, относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее или легче другого, т.е. во сколько раз плотность одного газа больше или меньше плотности другого, т.е. имеем соотношение вида:
. В общем случае, относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее или легче другого, т.е. во сколько раз плотность одного газа больше или меньше плотности другого, т.е. имеем соотношение вида:

Так, для первого газа имеем:

соответственно для второго газа:

тогда очевидно:

и таким образом:
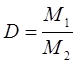
Другими словами, относительная плотность газа  есть отношение молекулярной массы исследуемого газа к молекулярной массе газа, с которым производится сравнение. Относительная плотность газа – безразмерная величина. Таким образом, для того чтобы вычислить относительную плотность одного газа по другому, достаточно знать молекулярные относительные молекулярные массы этих газов. Для того чтобы было понятно, с каким газом проводят сравнение, ставят индекс. Например,
есть отношение молекулярной массы исследуемого газа к молекулярной массе газа, с которым производится сравнение. Относительная плотность газа – безразмерная величина. Таким образом, для того чтобы вычислить относительную плотность одного газа по другому, достаточно знать молекулярные относительные молекулярные массы этих газов. Для того чтобы было понятно, с каким газом проводят сравнение, ставят индекс. Например,  обозначает, что сравнение проводят с водороду и тогда говорят о плотности газа по водороду, не употребляя уже слово «относительная», принимая это как бы по умолчанию. Аналогично измерения проводят, беря в качестве газа сравнения – воздух. В этом случае указывают, что сравнение исследуемого газа проводят с воздухом
обозначает, что сравнение проводят с водороду и тогда говорят о плотности газа по водороду, не употребляя уже слово «относительная», принимая это как бы по умолчанию. Аналогично измерения проводят, беря в качестве газа сравнения – воздух. В этом случае указывают, что сравнение исследуемого газа проводят с воздухом  . При этом средняя молекулярная масса воздуха принимается равной 29
. При этом средняя молекулярная масса воздуха принимается равной 29  , а поскольку относительная молекулярная масса и молярная масса численно совпадают, тогда:
, а поскольку относительная молекулярная масса и молярная масса численно совпадают, тогда:

Химическая формула исследуемого газа ставится рядом в скобках, например:

и читается как – плотность хлора по водороду. Зная относительную плотность одного газа по отношению к другому, можно вычислить молекулярную, а также молярную массу газа, даже если формула вещества неизвестна. Все приведенные выше соотношения относятся к так называемым нормальным условиям.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...