
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Уравнение Менделеева-Клайперона.
Состояние идеального газа характеризуется тремя величинами: давлением  , объёмом
, объёмом  и температурой
и температурой  . Эти три величины связаны между собой уравнением, которое получило название уравнения состояния идеального газа. Оно может быть выведено путём объединения законов Бойля-Мариотта, Гей-Люссака и Авогадро. Так, например, если взять 1 моль любого газа при нормальных условиях, характеризуемых параметрами
. Эти три величины связаны между собой уравнением, которое получило название уравнения состояния идеального газа. Оно может быть выведено путём объединения законов Бойля-Мариотта, Гей-Люссака и Авогадро. Так, например, если взять 1 моль любого газа при нормальных условиях, характеризуемых параметрами 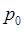 ,
, 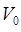 и
и  и нагреть этот газ до определённой температуры
и нагреть этот газ до определённой температуры  при том же давлении, то согласно закону Гей-Люссака:
при том же давлении, то согласно закону Гей-Люссака:

объём газа при этой температуре  , очевидно, будет равен:
, очевидно, будет равен:

или после преобразования:
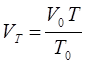
Если при постоянной температуре  изменить давление газа от
изменить давление газа от 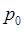 до любого другого значения
до любого другого значения  , то очевидно объём газа также изменится и станет равным
, то очевидно объём газа также изменится и станет равным  . Тогда очевидно на основании закона Бойля-Мариотта:
. Тогда очевидно на основании закона Бойля-Мариотта:

будем иметь соответственно:

или после подстановки значения:
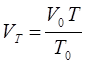
получим:


откуда соответственно:

и далее:


или в окончательном виде:

Полученное нами выше уравнение представляет собой аналитическое выражение так называемого объединённого газового закона Бойля-Мариотта и Гей-Люссака, которое можно также представить в виде:
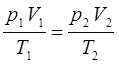
Для различных значений этих параметров очевидно справедливо:

Поскольку 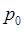 ,
, 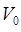 и
и  – величины постоянные, то и отношение их есть также величина постоянная для всех газов, независимо от их химической природы:
– величины постоянные, то и отношение их есть также величина постоянная для всех газов, независимо от их химической природы:

Такую постоянную величину обозначают через 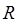 и называю универсальной газовой постоянной. С учётом этого, полученное нами выше уравнение объединённого газового закона может быть переписано и представлено к виду:
и называю универсальной газовой постоянной. С учётом этого, полученное нами выше уравнение объединённого газового закона может быть переписано и представлено к виду:

или

Однако такая запись уравнения состояния справедлива для 1 моль идеального газа. Для того чтобы данное уравнение было применимо к 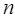 моль газа, в данное выражение, исходя из закона Авогадро, вводят количество вещества, отвечающее соответственно уже
моль газа, в данное выражение, исходя из закона Авогадро, вводят количество вещества, отвечающее соответственно уже 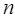 молям идеального газа, т.е. имеем:
молям идеального газа, т.е. имеем:

Поскольку по определению:

тогда соответственно:

Полученное таким образом уравнение состояния, путём объединения соответствующих газовых законов (Бойля-Мариотта, Гей-Люссака и Авогадро), носит название уравнение Менделеева-Клайперона. Данное уравнение было впервые получено в 1834 г. Клайпероном и является основным уравнением газового состояния. Д.И. Менделеев в своих работах в 1874 г. Указал, что благодаря закону Авогадро, уравнение Клайперона:

приобретает наибольшую общность, когда оно относится не к обычной весовой единице (грамму или килограмму), а к единице количества вещества – 1 моль газа. Так, в уравнении Клайперона величина 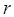 представляет собой постоянную, зависящую от природы газа и его количества. По этой причине Д.И. Менделеев заменил постоянную
представляет собой постоянную, зависящую от природы газа и его количества. По этой причине Д.И. Менделеев заменил постоянную 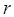 в уравнении Клайперона на постоянную
в уравнении Клайперона на постоянную 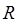 , которая относится уже к 1 моль газа, т.е.
, которая относится уже к 1 моль газа, т.е.

тогда соответственно из выражения вида:

непосредственно следует, что:

В данном уравнении значение постоянной 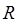 уже не будет зависеть от природы и количества газа. Данный коэффициент называется универсальной газовой постоянной. Величина и размерность
уже не будет зависеть от природы и количества газа. Данный коэффициент называется универсальной газовой постоянной. Величина и размерность 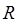 определяется теми же единицами, которыми измеряют давление и объём. Выясним теперь физический смысл универсальной газовой постоянной
определяется теми же единицами, которыми измеряют давление и объём. Выясним теперь физический смысл универсальной газовой постоянной 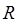 и вычислим её значения (СИ), а также посмотрим, как она может быть связана с другой фундаментальной физической постоянной – константой Больцмана
и вычислим её значения (СИ), а также посмотрим, как она может быть связана с другой фундаментальной физической постоянной – константой Больцмана 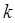 . Так, имеем соответственно:
. Так, имеем соответственно:

относя данное соотношение к 1 моль идеального газа, имеем:

откуда соответственно:

Относя значение универсальной газовой постоянной 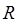 к нормальным условиям:
к нормальным условиям:

а также учитывая:

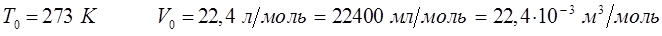
и размерность величин:

вычислим значения универсальной газовой постоянной 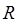 :
:

Действительно, после проверки размерности 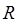 , будем иметь соответственно:
, будем иметь соответственно:

Аналогично имеем:

Действительно, после проверки размерности 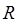 , будем иметь соответственно:
, будем иметь соответственно:

Аналогично получаем ещё одно значение универсальной газовой постоянной 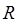 :
:

Действительно, после проверки размерности 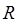 , будем иметь соответственно:
, будем иметь соответственно:

Таким образом, в ходе проделанных вычислений приходим к следующим значениям универсальной газовой постоянной 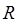 :
:



или для последнего значения постоянной 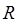 , можно использовать без особой потери в точности расчётов её приближённое значение:
, можно использовать без особой потери в точности расчётов её приближённое значение:

Вернёмся к рассмотренному нами уже выше уравнению Менделеева-Клайперона:

или что то же самое:

Преобразуем данное уравнение к виду:

Так, поскольку по определению:
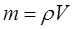
откуда:

тогда очевидно из выражения вида:

следует, что:

откуда:

Если обе части уравнения:

разделить на  , получим:
, получим:
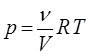
или с учётом того, что отношение количества вещества к объёму есть не что иное, как концентрация газа, т.е.

тогда после подстановки будем иметь соответственно:


Физический смысл универсальной газовой постоянной 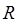 станет ясным, если учесть, что при постоянном давлении
станет ясным, если учесть, что при постоянном давлении  с повышением температуры
с повышением температуры  увеличивается объём газа
увеличивается объём газа  . Следовательно, в данном случае в уравнении состояния:
. Следовательно, в данном случае в уравнении состояния:

или для 1 моль газа:

будет изменяться только значение температуры и объёма. Обозначим изменение объёма газа через 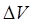 , а повышение температуры через
, а повышение температуры через  , тогда очевидно уравнение состояния идеального газа примет вид:
, тогда очевидно уравнение состояния идеального газа примет вид:

или после преобразования:

однако учитывая, что:

тогда соответственно:

откуда:

или в окончательном виде:
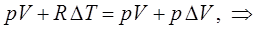


откуда:

или при  будем иметь соответственно:
будем иметь соответственно:

Можно было поступить проще, рассматривая процесс расширения идеального газа при повышении температуры на  . Так, начальное и конечное состояние идеального газа может быть описано на основании уравнения:
. Так, начальное и конечное состояние идеального газа может быть описано на основании уравнения:

а также:

тогда, соответственно:

откуда:
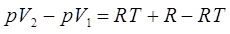
или в окончательном виде:

откуда:

или

Произведение давления на изменение его объёма есть работа, которую обозначим через  , тогда можно будет записать, что:
, тогда можно будет записать, что:
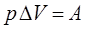
поэтому исходя из полученных нами выше уравнений:

или в общем виде:

будем иметь соответственно:

или при  :
:

откуда:

т.е. если изменение температуры  , тогда соответственно
, тогда соответственно  . Отсюда вытекает, что универсальная газовая постоянная
. Отсюда вытекает, что универсальная газовая постоянная 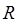 будет равна той работе против внешнего давления, которую будет производить 1 моль идеального газа при повышении температуры на
будет равна той работе против внешнего давления, которую будет производить 1 моль идеального газа при повышении температуры на  . Убедимся теперь, что универсальная газовая постоянная
. Убедимся теперь, что универсальная газовая постоянная 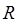 по своему физическому смыслу будет соответствовать работе расширения идеального газа. Для этого рассмотрим обратимое расширение 1 моля идеального газа, находящегося в цилиндре с подвижным поршнем и сечением
по своему физическому смыслу будет соответствовать работе расширения идеального газа. Для этого рассмотрим обратимое расширение 1 моля идеального газа, находящегося в цилиндре с подвижным поршнем и сечением  . Пусть поршень при расширении газа движется без трения и, преодолевая внешнее давление, смещается на величину
. Пусть поршень при расширении газа движется без трения и, преодолевая внешнее давление, смещается на величину 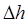 , или при бесконечно малом смещении поршня, изменяется на величину
, или при бесконечно малом смещении поршня, изменяется на величину  . Поскольку работа, в общем случае, численно равняется произведению вектора силы
. Поскольку работа, в общем случае, численно равняется произведению вектора силы  на перемещение тела
на перемещение тела 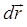 в направлении действующей на него силы и по определению не является полным дифференциалом или функцией состояния, тогда для бесконечно малого (элементарного) процесса, можно будет в общем случае записать вместо уравнения:
в направлении действующей на него силы и по определению не является полным дифференциалом или функцией состояния, тогда для бесконечно малого (элементарного) процесса, можно будет в общем случае записать вместо уравнения:

выражение вида:

Очевидно, что элементарная работа  , которая при этом будет выполняться, учитывая, что
, которая при этом будет выполняться, учитывая, что 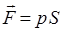 и
и 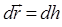 , определится выражением вида:
, определится выражением вида:

т.к.

имеем соответственно:

или в интегральной форме:

Поскольку как было показано выше:

и соответственно:
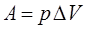
тогда:

Универсальная газовая постоянная 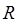 , отвечающая работе расширения 1 моль идеального газа, связана с другой фундаментальной постоянной – константой или постоянной Больцмана
, отвечающая работе расширения 1 моль идеального газа, связана с другой фундаментальной постоянной – константой или постоянной Больцмана 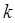 :
:

которая уже будет отвечать работе, производимой одной молекулой газа против внешнего давления. Подставив в последнее выражение значение числа Авогадро:

будем иметь соответственно:

Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...