
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Механизм и скорость электродной реакции. Равновесный и стационарный потенциалы. Ток обмена. Простые и смешанные электроды. Поляризация и перенапряжение. Их типы
Скорость электродных процессов следует рассматривать, используя общие закономерности обычных гетерогенных химических реакций, совершающихся на поверхности раздела твердой и жидкой фаз.
Назовем электродным процессом сумму всех изменений, происходящих во времени на поверхности электрода при потенциале, отличном от равновесного. Легко видеть, что электродный процесс, являясь процессом сложным, может быть расчленен на несколько стадий.
Из химической кинетики известно, что скорость наиболее медленной стадии оказывает решающее влияние на скорость процесса в целом. Если взять в пример двустадийный процесс (стадия 1 – диффузия иона из раствора к границе двойного слоя и далее к поверхности электрода; стадия 2 – электродная реакция, в которой участвуют ионы плотной части двойного слоя), то в стационарном состоянии обе стадии процесса будут протекать с одинаковой скоростью. При этом одна из них (в данном примере диффузия) имеет наибольшую возможную в данных условиях скорость; скорость второй стадии снижена недостатком реагирующего вещества, т.е. очень низкой концентрацией его у наружной границы двойного слоя.
В случае медленной электродной реакции и быстрой диффузии скорость последней оказывается снижена, так как медленный расход реагирующего вещества не создает достаточно большой разности концентраций, необходимой для развития диффузии.
В зависимости от того, какая из стадий является более медленной, можно различать электрохимическую или диффузионную кинетику электрохимического процесса.
Скорость диффузии зависит от температуры, от природы растворенного вещества и растворителя и от движения раствора, омывающего электрод. Чтобы избавиться от случайных причин, влияющих на скорость диффузии, и сделать ее постоянной, часто ведут исследование кинетики при перемешивании раствора с постоянной скоростью. Меняя скорость перемешивания раствора, т.е. скорость диффузии, иногда можно один и тот же процесс перевести из области диффузионной кинетики в область электрохимическую, и наоборот.
Рассмотрим электрохимическую кинетику, предполагая, что диффузия может протекать значительно быстрее, чем электродная реакция. Данного условия можно добиться за счет достаточно быстрого перемешивания раствора.
Для примера рассмотрим скорость электрохимической реакции, происходящей на металлическом электроде, погруженном в раствор его собственной соли.
При равновесном потенциале не прекращается протекание реакций окисления и восстановления. Ионы металла переходят с поверхности электрода в раствор и из раствора возвращаются на поверхность электрода. Но скорости этих двух противоположных процессов равны. При этом не происходит макроскопических изменений состава и массы отдельных фаз системы. Протекание процесса, приводящего к макроскопическим изменениям, возможно лишь при потенциале, отличном от равновесного, когда скорости окисления и восстановления не равны друг другу. Разность этих скоростей и будет общей скоростью процесса, которая тем больше, чем больше смещен потенциал от равновесного значения [5].
При установлении равновесия состав фаз, образующихся на электродах, остается неизменным во времени. Однако такое равновесие является динамическим, т.е. абсолютные значения анодного (  ) и катодного (
) и катодного (  ) плотностей тока равны и представляют собой ток обмена
) плотностей тока равны и представляют собой ток обмена  . Измеряемый при этом электродный потенциал соответствует равновесному потенциалу (
. Измеряемый при этом электродный потенциал соответствует равновесному потенциалу (  ). В случае простых электродов условие равновесия можно представить в виде
). В случае простых электродов условие равновесия можно представить в виде
 (1.4.1)
(1.4.1)
Однако очень часто на металле, погруженном в раствор электролита, протекает несколько самопроизвольных электродных реакций, т.е. речь идет о смешанном электроде. В таких случаях на электроде устанавливается более или менее постоянный во времени компромиссный потенциал  (равновесный и компромиссный потенциалы часто называют стационарным потенциалом, указывая тем самым на отсутствие тока от внешнего источника). В этом случае суммы катодных и анодных токов отдельных реакций (т.е. скорости этих реакций) также равны друг другу:
(равновесный и компромиссный потенциалы часто называют стационарным потенциалом, указывая тем самым на отсутствие тока от внешнего источника). В этом случае суммы катодных и анодных токов отдельных реакций (т.е. скорости этих реакций) также равны друг другу:
 (1.4.2)
(1.4.2)
где n>1.
Равенство (1.4.2) может быть выполнено при условии, что 1)  или 2)
или 2)  .
.
При условии 1 состав образующихся на электроде фаз меняется во времени, т.е. в системе отсутствует равновесие. При условии 2 на смешанном электроде устанавливается равновесие.
Для того чтобы скорости анодных и катодных процессов на электроде различались, необходимо изменить значение стационарного потенциала. При таком изменении через электрод начинает протекать электрический ток. Это можно сделать, замкнув каким-либо проводником два электрода гальванического элемента или включив исследуемый электрод в соответствующую цепь с помощью вспомогательного электрода. При этом стационарный потенциал электрода начинает изменяться под действием электрического тока. Такое явление называется поляризацией.
Разность между электродным потенциалом поляризованного электрода (  ) и равновесным потенциалом (
) и равновесным потенциалом (  ) называется перенапряжением
) называется перенапряжением  :
:
 (1.4.3)
(1.4.3)
Отсюда перенапряжение – это разность между потенциалом электрода и равновесным потенциалом, необходимая для протекания заданного тока через электрод. Когда рассматривают смешанный электрод, стационарный потенциал которого не совпадает с равновесным, разность между потенциалом поляризованного электрода и компромиссным потенциалом (  ) называют потенциалом поляризации
) называют потенциалом поляризации  электрода:
электрода:
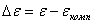 (1.4.4)
(1.4.4)
Если процесс окисления является единственной или преобладающей электродной реакцией на поляризованном электроде, то электрод называют анодом, а соответствующую поляризацию – анодной. Если же единственной или преобладающей реакцией является процесс восстановления, то электрод считается катодом, а поляризация называется катодной. В первом случае  и
и  положительны, во втором – отрицательны.
положительны, во втором – отрицательны.
В соответствии с выдвинутыми ранее положениями, когда  и
и  не равны нулю, анодная и катодная плотности тока (
не равны нулю, анодная и катодная плотности тока (  и
и  соответственно) также неодинаковы и суммарная плотность тока
соответственно) также неодинаковы и суммарная плотность тока  , протекающего через электрод, будет равна
, протекающего через электрод, будет равна
 (1.4.5)
(1.4.5)
где  - положительная, а
- положительная, а  - отрицательная величина.
- отрицательная величина.
Поляризация, как правило, бывает обусловлена затруднением («замедленностью») одной из последовательных стадий электродного процесса. Некоторые стадии представляют собой физические процессы (диффузия, образование новой фазы), а другие являются химическими или электрохимическими реакциями (например, стадия переноса заряда).
Основываясь на характере лимитирующей стадии процесса, обычно выделяют следующие типы поляризации и перенапряжения.
Диффузионное перенапряжение (концентрационная или диффузионная поляризация) возникает в том случае, когда затрудненной оказывается диффузия к электроду участвующего в электродной реакции исходного вещества (веществ) или диффузия продукта (продуктов) электродной реакции от электрода в объем раствора. Вследствие медленной диффузии при протекании тока происходит обеднение приэлектродного слоя исходными компонентами, а концентрация продуктов возрастает в сравнении с объемной (т.е. в отсутствие тока) концентрацией. Поскольку диффузия всегда участвует в электродных процессах, часто возникает и диффузионная поляризация. В таких случаях кинетика суммарного электродного процесса определяется законами диффузии (диффузионной кинетикой, диффузионным режимом).
Перенапряжение кристаллизации (кристаллизационная поляризация) также по существу обусловлено диффузионными затруднениями. Это явление возникает в том случае, когда продуктом электродной реакции является металл, а его ион не может встроиться в кристаллическую решетку металла, превратившись в соответствующий атом. Следовательно, ион металла вынужден мигрировать до места, энергетически выгодного для встраивания в решетку. При этом кристаллизация оказывается наиболее затрудненным процессом.
Перенапряжение образования центров кристаллизации, или зародышей (поляризация зародышеобразования), как правило, возникает в начальный момент пропускания тока, поскольку для образования новой фазы необходимо затратить некоторую избыточную энергию. Новая фаза образуется при осаждении металла (сплава) на электрод из другого материала или, например, при электролитическом выделении ртути или газа. В последних двух случаях, когда ртуть не смачивает электрод или когда выделяется газ, зародыши должны формироваться непрерывно: в этих условиях перенапряжение образования зародышей существует только в начальный момент пропускания тока. При выделении металла на электроде в микрокристаллическом или аморфном состоянии перенапряжение образования зародышей новой фазы может быть постоянным.
Перенапряжение переноса заряда (поляризация переноса заряда) наблюдают в том случае, когда лимитирующей стадией оказывается перенос заряда, т.е. электрохимическая реакция. При этом перенапряжение переноса можно рассматривать как разность электрических потенциалов, уменьшающую энергию активации переноса заряда до такой степени, что этот процесс становится возможным при заданной плотности тока. Поэтому такой вид поляризации часто называют активационной поляризацией.
Перенапряжение реакции (поляризация реакции) обнаруживают в том случае, когда в электродную реакцию кроме электрохимических стадий (перенос заряда) последовательно включается замедленная химическая реакция (реакции). Если последняя протекает до электрохимической стадии, то при пропускании тока концентрации участвующих в электрохимической стадии исходных компонентов окажутся ниже их равновесных значений. Если замедленная химическая реакция протекает после электрохимической стадии, то последнюю можно считать равновесной. Необходимо указать, что сложные электродные реакции состоят из нескольких стадий, среди которых может быть ряд химических и электрохимических.
Диффузионную поляризацию и поляризацию реакции часто объединяют под общим названием «концентрационная поляризация», поскольку появление этих типов поляризации сопровождается изменением концентрации участвующих в электрохимической реакции частиц относительно их равновесных концентраций. Однако электрохимическую стадию можно считать по-прежнему равновесной, но уже с изменившимися концентрациями.
Все упомянутые выше типы перенапряжения обусловлены наличием в электродном процессе лимитирующей стадии. В литературе еще имеется термин «омическое перенапряжение». Последнее, как правило, связано с измерением электродного потенциала относительно электрода сравнения с помощью солевого мостика. При протекании тока в слое жидкого электролита (или в другом поверхностном слое) между концом солевого мостика и поверхностью электрода происходит омическое падение потенциала, которое складывается с измеренным значением электродного потенциала. Таким образом, омическое перенапряжение обусловлено просто ошибкой при измерении. Эту ошибку можно уменьшить, выполнив мостик в виде капилляра, конец которого вплотную подходит к исследуемому электроду (так называемый капилляр Луггина). При этом также возможно искажение величины электродного потенциала вследствие экранирования доли поверхности электрода концом капилляра. Во избежание омического перенапряжения (когда оно весьма вероятно, например, в случае раствором с высоким сопротивлением или при образовании поверхностного слоя) в электрохимических измерениях используют потенциостаты с компенсацией омического падения напряжения.
Кинетика процесса растворения металла обычно определяется диффузионной, электрохимической и химической стадиями реакции и соответствующими типами поляризации. На практике на кинетику электродных процессов может оказывать влияние одновременно каждая из этих стадий реакции [4].
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...