
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Изменение энтропии в различных процессах (изменение температуры, объема, давления, фазовый переход, химическая реакция).
ΔS = ∫T1T2 cp/T dT (p=const); ΔS = ∫V1V2 (∂p/∂T)V dV; ΔS = Δфаз.перH / Tфаз.пер; ΔrSoT= 2SoT(CO2) – 2*SoT(CO) – SoT(O2).
Билет 8.
Теория МО. Электронные конфигурации молекул и молекулярных ионов водорода и гелия.
Сечения простейших фазовых диаграмм «температура – состав». Типичные диаграммы «жидкость – пар» (с азеотропом и без).

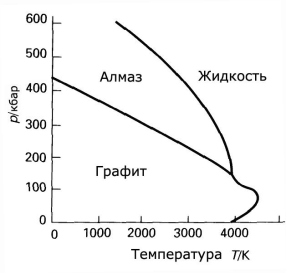
Фазовые диаграммы для воды и углерода.
На фазовых диаграммах однокомпонентных систем поля, по правилу фаз, соответствуют однофазным состояниям, линии, разграничивающие их — двухфазным, точки пересечения линий — трёхфазным (эти точки называют тройными точками).
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость-газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает.

Уравнение кривой т.кип. – состав:

Состав насыщенного пара определяется ур-ем Дальтона:


Высококипящий азеотроп (смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз): более низкое давление пара по сравнению с идеальным раствором. Отрицательное отклонение от идеальности, DGex < 0. Примеры: HNO3 – H2O, хлороформ (CHCl3) – ацетон.
Низкокипящий азеотроп: более высокое давление пара по сравнению с идеальным раствором. Положительное отклонение от идеальности, DGex > 0. Примеры: диоксан (C4H8O2) – H2O, C2H5OH – H2O.
Энтальпия химической связи. Зависимость теплового эффекта реакции от температуры и давления.
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота совпадает с изменением функции состояния. При постоянном объеме теплота равна изменению внутренней энергии: δQV = dU, QV = ΔU, а при постоянном давлении – изменению энтальпии:
δQp = dH, Qp = ΔH.
Эти равенства в применении к химическим реакциям составляют суть закона Гесса: Теплота химической реакции при постоянном объеме или давлении (тепловой эффект химической реакции) не зависит от пути проведения процесса, а определяется только состоянием реагентов и продуктов реакции при условии, что единственной работой, совершаемой системой, является механическая работа.
Тепловой эффект относят к Т = const.
Для обозначения изменения любой термодинамической функции при протекании химической реакции используют оператор химической реакции Δr, например, ΔrU, ΔrH, ΔrCp и т.д. Тепловой эффект химической реакции записывают как ΔrU или ΔrH в зависимости от условий проведения (V = const или p = const).
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т.е. для экзотермической реакции ΔrH < 0 или ΔrU < 0.
Если реакция протекает в растворе или в твердой фазе, где изменение объема незначительно, то ΔrH = ΔrU + Δr(pV) ≈ ΔrU.
Если же в реакции участвуют идеальные газы, то при постоянной температуре ΔrH = ΔrU + Δr(pV) = ΔrU + Δν RT, где Δν – изменение числа молей газов в реакции.
Тепловые эффекты зависят, в общем случае, от температуры и давления, поэтому для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям, т.е. стандартизованы. Стандартные состояния обозначают надстрочным индексом «°».
Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, называют стандартной энтальпией реакции и обозначают ΔrHTo .

Константы скорости в параллельных реакциях.
CA(t) = CA(0)*exp[(-k1+k2)*t]
Билет 9.
Межмолекулярные взаимодействия и их классификация. Сравнение межмолекулярных
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...