
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Ионное произведение воды. Водородный показатель.
РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Сильные и слабые электролиты. Степень и константа электролитической диссоциации.Вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, называются электролитами.Гипотезу электролитической диссоциации разработал Аррениус в 1887 году. Согласно этой гипотезе молекулы солей, кислот и оснований при растворении их в воде претерпевают диссоциацию на соответствующие ионы. Это дало возможность объяснить многие особенности в химических свойствах растворов электролитов (реакции гидролиза, значение концентрации водородных ионов и т.д.) Вытекающие из этой гипотезы количественные соотношения между различными свойствами растворов (электропроводностью, t˚ замерзания, кипения и др.) – оказались в согласии с опытными данными. Это способствовало правильности гипотезы Аррениуса. Однако, в гипотезе Аррениуса раствор электролита рассматривался как механическая смесь из молекул растворителя и ионов и молекул электролита. А взаимодействие между ними оставалась без изменений.Большое значение в формировании правильного представления о взаимодействии между частицами в растворах электролитов имели работы Каблукова и Нернста.Основываясь на труды Менделеева, который писал, что ионы могут вступать во взаимодействие с водой, образуя гидраты, он в 1891 году (Каблуков) утверждал, что вода, разлагая частицы растворенного тела, входит с ионами в непрочные соединения.Явление электролитической диссоциации наблюдается не только в водных растворах, но и в других растворителях, обладающих высокой диэлектрической проницаемостью.(в том числе и в органических) Неводные растворы изучали К.П. Мищенко, Крестова Т.А., Кесслер Ю.М. и др.). Мы будем изучать с вами водные растворы электролитов в связи с более широким их практическим использованиемРассмотрим причины электролитической диссоциации:Например, NaCl состоит из ионов Na+ и Cl– в любом состоянии:

и в кристаллическом, и в водном, и в паре. Переход ионов в раствор происходит в результате взаимодействия их с молекулами растворителя, в результате образования связей между ионом и молекулами растворителя (сольватация ионов) и, в частности, молекулами воды (гидратация ионов).Работа разъединения ионов при растворении производится главным образом за счет их сольватации (сопровождающейся уменьшением энергии Гиббса системы). Сильному ослаблению могут подвергаться только сильно полярные связи.По способности к диссоциации электролиты разделяются на сильные и слабые. К сильнымпринадлежат сильные кислоты, сильные основания и большая часть солей. Сюда относятся соли, образованные сильным основанием или сильной кислотой, но большей частью и соли, образованные слабым основанием и слабой кислотой.Большинство сильных электролитов кристаллизуется в кристаллах с ионной решеткой, и такие вещИо́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.ества и называют сильными электролитами.
Вывод значения ионного произведения водыВода, хотя и является слабым электролитом, в небольшой степени диссоциирует:

Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:

где:
[H+] — концентрация ионов
гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л.
Уравнение (1) можно переписать как:
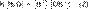
Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...