
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Молекулярность и порядок реакций
Молекулярность и порядок реакций
1. Задание {{ 168 }} ТЗ № 168
К мономолекулярным реакциям относятся
R Cl2 = 2Cl
R CaCo3 = CaO+CO2
£ H2 + Cl2 = 2HCl
£ 2H2O2 = 2H2O + O2
2. Задание {{ 169 }} ТЗ № 169
К бимолекулярным реакциям относятся
£ Cl2=2Cl
£ CaCO3 = CaO + CO2
R H2 + Cl2 = 2HCl
R 2H2O2 = 2H2O + O2
3. Задание {{ 170 }} ТЗ № 170
Порядок реакции H2 + Cl2 = 2HCl равен
£ 1
R 2
£ 3
£ 4
4. Задание {{ 171 }} ТЗ № 171
Порядок реакции 2H2O2 = 2H2O + O2 равен
R 1
£ 2
£ 3
£ 4
5. Задание {{ 172 }} ТЗ № 172
Порядок реакции СO2 + С = 2СO равен
R 1
£ 2
£ 3
£ 4
6. Задание {{ 173 }} ТЗ № 173
 Порядок реакции С12 H22 O11 + H2O C6 H12 O6 + C6 H12 O6 равен
Порядок реакции С12 H22 O11 + H2O C6 H12 O6 + C6 H12 O6 равен
R 1
£ 2
£ 3
£ 4
7. Задание {{ 174 }} ТЗ № 174
Молекулярность реакции CaCO3 =CaO+CO2 равна
R 1
£ 2
£ 3
£ 4
8. Задание {{ 175 }} ТЗ № 175
Молекулярность реакции 2N2O5 = 4NO2 + O2 равна
£ 1
R 2
£ 3
£ 4
9. Задание {{ 176 }} ТЗ № 176
Порядок реакции в многостадийных реакциях определяется
£ самой быстрой стадией
R самой медленной стадией
£ любой стадией
£ всеми стадиями
10. Задание {{ 177 }} ТЗ № 177
Самая медленная стадия многостадийной реакции определяет её
£ молекулярность
R порядок
£ молекулярность и порядок
11. Задание {{ 178 }} ТЗ № 178
Порядок реакции может быть
R нулевым
R первым
R дробным
R вторым
R третьим
£ четвертым
12. Задание {{ 179 }} ТЗ № 179
Порядок реакции не может быть
R отрицательным
£ нулевым
£ дробным
£ первым
£ вторым
13. Задание {{ 180 }} ТЗ № 180
В реакции 2H2O2 = 2H2O + O2 медленной стадией является
£ O + O = O2
R 2H2O = 2H2 + O2
£ 2H2 + O2 = 2H2O
14. Задание {{ 181 }} ТЗ № 181
Лимитирующей стадией процесса является
£ самая быстрая
R самая медленная
£ конечная
£ первая
Химическая связь.
1. Задание {{ 73 }} ТЗ № 73
Валентность азота в N2O5 равна
£ 3
R 4
£ 5
£ 2
2. Задание {{ 74 }} ТЗ № 74
Наиболее правильно отображает строение молекулы аммиака схема
£ 
R 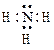
£ 
£ 
3. Задание {{ 75 }} ТЗ № 75
Электронную конфигурацию благородного газа имеют частицы
R Mg2+
R S2-
£ Fe2+
R Ca2+
£ P3+
4. Задание {{ 76 }} ТЗ № 76
Частицы Ar0, K+ и Cl- имеют одинаковые
£ число протонов
£ число нейтронов
R число электронов
£ массовое число
5. Задание {{ 77 }} ТЗ № 77
Наименьший радиус имеет ион
£ Se2-
£ Br -
£ Rb+
R Sr 2+
6. Задание {{ 78 }} ТЗ № 78
Валентные орбитали атома бора в молекуле BCl3 гибридизованы по типу
£ sp3
£ sp
R sp2
£ d2 sp3
7. Задание {{ 79 }} ТЗ № 79
Наибольший радиус имеет ион
£ Ca2+
£ K+
£ F -
R Cl -
8. Задание {{ 80 }} ТЗ № 80
Молекула хлорида бериллия имеет структуру
R линейную
£ плоскую
£ тетраэдрическую
£ октаэдрическую
9. Задание {{ 81 }} ТЗ № 81
Валентность азота в азотной кислоте
£ 2
£ 3
R 4
£ 5
10. Задание {{ 82 }} ТЗ № 82
Ковалентная связь, образованная по донорно-акценторному механизму имеется в веществе
£ NaNO3
£ NO
£ KCl
R NH4Cl
11. Задание {{ 83 }} ТЗ № 83
При переходе  имеет место превращение типа
имеет место превращение типа
£ Испускание протона
£ α - распад
R электронный захват
£ β - распад
12. Задание {{ 84 }} ТЗ № 84
Молекула метана имеет структуру
£ линейную
£ плоскую
R тетраэдрическую
£ октаэдрическую
13. Задание {{ 85 }} ТЗ № 85
При образовании молекулы HBr перекрываются орбитали типа
£ p и p
R s и p
£ s и s
£ d и p
14. Задание {{ 86 }} ТЗ № 86
π- связи имеют молекулы
R CO
£ Cl2
R O2
R H2SO4
15. Задание {{ 87 }} ТЗ № 87
В молекуле азота связь
R тройная
R ковалентная неполярная
R очень прочная
£ двойная
16. Задание {{ 88 }} ТЗ № 88
Валентность атома азота равна трем в молекулах
R азота
R аммиака
£ азотной кислоты
R азотистой кислоты
17. Задание {{ 89 }} ТЗ № 89
Связь образована тремя общими электронными парами в молекулах
£ Cl2
£ O2
R N2
£ CO
18. Задание {{ 90 }} ТЗ № 90
Валентность, равную номеру группы имеют элементы
R углерод
£ азот
R фосфор
R сера
£ кислород
19. Задание {{ 91 }} ТЗ № 91
Высшая валентность равна четырем в атомах элементов
R B
£ P
R N
£ Cl
20. Задание {{ 92 }} ТЗ № 92
Число ковалентных полярных связей в ионе аммония равно
£ 1
£ 2
£ 3
R 4
22. Задание {{ 93 }} ТЗ № 93
При взаимодействии двух атомных р-орбиталей образуются связи типа
£ s
R 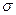
£ d
£ π
23. Задание {{ 94 }} ТЗ № 94
Все связи  - типа в молекулах
- типа в молекулах
R аммиака
R этана
£ азота
R водорода
24. Задание {{ 95 }} ТЗ № 95
При взаимодействии двух атомных s-орбиталей образуется химическая связь типа
£ s
R 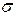
£ d
£ 
25. Задание {{ 99 }} ТЗ № 99
Молекулу воды правильно отображает схема
£ 
R 
£ 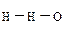
26. Задание {{ 100 }} ТЗ № 100
Ковалентную неполярную связь отображает формула
£ NaCl
£ HCl
R Cl2
£ NH3
27. Задание {{ 101 }} ТЗ № 101
В молекуле азота
£ 1 π и 2  связи
связи
R 2 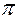 и 1
и 1  связи
связи
£ 3 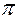 связи
связи
£ 3  связи
связи
28. Задание {{ 102 }} ТЗ № 102
Водородные связи образуются в жидком состоянии между молекулами
£ фтора
R фтороводорода
£ водорода
R воды
Учения о растворах
Учения о растворах
Гидролиз солей.
1. Задание {{ 304 }} ТЗ № 304
Среда кислая в водных растворах солей
£ K2CO3
£ KCl
R CuCl2
R Fe (NO3)3
£ NaNO3
2. Задание {{ 305 }} ТЗ № 305
Кислые соли образуются при гидролизе солей
£ NaCl
R K2CO3
£ AlCl3
R Na3PO4
£ KNO2
3. Задание {{ 306 }} ТЗ № 306
Щелочная среда в водных растворах солей
R Na3PO4
R K2СO3
R Na2S
£ NaCl
£ KNO3
4. Задание {{ 307 }} ТЗ № 307
В водном растворе гидролизу подвергаются соли
£ NaNO3
R MgCl2
R FeCl3
R (NH4)2SO4
5. Задание {{ 308 }} ТЗ № 308
Нейтральная или близкая к нейтральной среда в водных растворах солей
R KNO3
R CH3COONH4
£ Na2CO3
£ CuCl2
6. Задание {{ 309 }} ТЗ № 309
Фенолфталеин малиновый в водных растворах солей
£ KCl
R K2CO3
R KHCO3
£ KNO3
£ Cu(NO3)2
7. Задание {{ 310 }} ТЗ № 310
Основные соли образуются при гидролизе солей
£ NH4NO3
R CuCl2
£ Na2CO3
R Al(NO3)3
8. Задание {{ 311 }} ТЗ № 311
Гидролизу по катиону в водном растворе подвергаются соли
£ NaCl
R (NH4)2SO4
R CuCl2
£ K2CO3
9. Задание {{ 312 }} ТЗ № 312
Гидролизу по аниону в водном растворе подвергается соль
£ AlCl3
R Na2S
£ (NH4)2S
£ Al2S3
£ CuCl2
10. Задание {{ 313 }} ТЗ № 313
В водном растворе и по катиону и по аниону гидролизуются соли
£ NaNO3
R CH3COONH4
R (NH4)2CO3
£ KCl
£ CuCl2
11. Задание {{ 314 }} ТЗ № 314
Гидролиз хлорида алюминия можно усилить
R повышением температуры
£ увеличением концентрации соли
£ подкислением раствора
R подщелачиванием раствора
 12. Задание {{ 315 }} ТЗ № 315
12. Задание {{ 315 }} ТЗ № 315
Равновесие реакции гидролиза S2- + HOH HS- + OH- можно сместить вправо, если
R добавить кислоты
£ добавить щелочи
£ охладить раствор
R нагреть раствор
R добавить воды
13. Задание {{ 316 }} ТЗ № 316
Наиболее сильно гидролизу подвергается соль калия
£ KNO3
R K2S
£ K2Se
£ K2Te
£ KCl
14. Задание {{ 317 }} ТЗ № 317
Концентрация гидроксидных ионов наибольшая в водном растворе соли
£ NaNO3
R Na2CO3
£ CuSO4
£ BaCl2
15. Задание {{ 318 }} ТЗ № 318
Подкисление раствора ослабляет гидролиз солей
R CuSO4
£ Na2CO3
£ Na2S
R NH4Cl
16. Задание {{ 319 }} ТЗ № 319
В водном растворе NaCl реакция среды
£ кислая
£ щелочная
R нейтральная
17. Задание {{ 320 }} ТЗ № 320
В водном растворе Na2CO3 pH
R >7
£ <7
£  7
7
18. Задание {{ 321 }} ТЗ № 321
К щелочной среде приведет добавление к воде
£ NaCl
£ AlCl3
£ HCl
R K2CO3
£ CO2
19. Задание {{ 322 }} ТЗ № 322
При растворении в воде слабощелочную реакцию дает
£ H2S
£ SO2
£ CO2
R NH3
£ NaCl
20. Задание {{ 323 }} ТЗ № 323
Раствор нитрата железа (III) имеет реакцию среды
R кислую
£ щелочную
£ нейтральную
21. Задание {{ 324 }} ТЗ № 324
Ослабить или прекратить гидролиз раствора хлорида аммония можно добавив немного
£ KOH
£ NaCl
R HCl
£ H2O
£ KNO3
22. Задание {{ 325 }} ТЗ № 325
Чтобы ослабить или прекратить гидролиз раствора Na2СO3 необходимо добавить немного
R KOH
£ NaCl
£ HCl
£ H2O
£ KNO3
23. Задание {{ 326 }} ТЗ № 326
В водном растворе (NH4)2S
R pH  7
7
£ pH>7
£ pH<7
24. Задание {{ 327 }} ТЗ № 327
В водном растворе CuCl2
£ pH  7
7
£ pH>7
R pH<7
25. Задание {{ 328 }} ТЗ № 328
Щелочной раствор получают при растворении в воде
£ SO2
£ CO2
£ CaCl2
R K2SO3
£ CuSO4
26. Задание {{ 329 }} ТЗ № 329
Гидролиз раствора FeCl3 усилится при добавлении
£ NH4Cl
R H2O
£ HCl
£ ZnCl2
£ NaCl
27. Задание {{ 330 }} ТЗ № 330
Степень гидролиза можно рассчитать по формулам
R 
£ 
£ h= 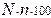
R N= 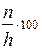
28. Задание {{ 331 }} ТЗ № 331
Лакмус синий в водном растворе
£ KCl
R K2SO3
£ CuCl2
£ NH4Cl
£ HCl
29. Задание {{ 332 }} ТЗ № 332
Лакмус красный в водных растворах
£ KCl
£ K2SO3
R CuCl2
R NH4Cl
R HCl
30. Задание {{ 333 }} ТЗ № 333
Лакмус фиолетовый в водном растворе
R KCl
£ K2SO3
£ CuCl2
£ NH4Cl
£ HCl
31. Задание {{ 334 }} ТЗ № 334
Гидролиз Al2S3 протекает
£ обратимо
R необратимо
£ ступенчато
32. Задание {{ 335 }} ТЗ № 335
Гидролизу не подвергаются соли
£ CuSO4
R NaCl
R KNO3
£ K2CO3
£ (NH4)2S
33. Задание {{ 336 }} ТЗ № 336
Гидролиз хлорида меди усиливается при
£ подкислении раствора
R добавлении воды
R нагревании раствора
R подщелачивании раствора
34. Задание {{ 337 }} ТЗ № 337
Для солей образованных слабым основанием и слабой кислотой константа гидролиза рассчитывается по формуле
£ Кг = 
£ Кг = 
R Кг = 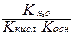
35. Задание {{ 338 }} ТЗ № 338
Для солей образованных слабым основанием и сильной кислотой константа гидролиза рассчитывается по формуле
£ Кг = 
R Кг = 
£ Кг = 
36. Задание {{ 339 }} ТЗ № 339
Для солей образованных сильным основанием и слабой кислотой константа гидролиза рассчитывается по формуле
R Кг = 
£ Кг = 
£ Кг = 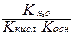
Учения о растворах
Химическая термодинамика
Химическая термодинамика.
Принцип Ле-Шателье.
 1. Задание {{ 340 }} ТЗ № 340
1. Задание {{ 340 }} ТЗ № 340
При понижении температуры равновесие реакции 2SO2 + O2 2 SO3 + 192 кДж сместится
вправо
£ влево
£ не сместится
2. Задание {{ 341 }} ТЗ № 341
 При добавлении катализатора равновесие реакции N2 + 3H2 2NH3 + 90 кДж
При добавлении катализатора равновесие реакции N2 + 3H2 2NH3 + 90 кДж
£ вправо
£ влево
R не сместится
3. Задание {{ 342 }} ТЗ № 342
Изменение давления смещает равновесие реакции
 £ H2(г) + Cl2(г) 2HCl(г)
£ H2(г) + Cl2(г) 2HCl(г)
 R H2(г) + I2(к) 2HI (г)
R H2(г) + I2(к) 2HI (г)
 £ C(к) + O2(г) CO2(г)
£ C(к) + O2(г) CO2(г)
 £ H2(г) + S(к) H2S(г)
£ H2(г) + S(к) H2S(г)
4. Задание {{ 343 }} ТЗ № 343
 Равновесие в реакции Fe2+ + HOH FeOH+ + H+ - Q смещается вправо при
Равновесие в реакции Fe2+ + HOH FeOH+ + H+ - Q смещается вправо при
R повышение температуры
£ понижение температуры
R уменьшение концентрации ионов H+
£ увеличение концентрации ионов H+
5. Задание {{ 344 }} ТЗ № 344
 Равновесие реакции H2S(ж) H+(ж) + HS-(ж) – Q смещается влево при
Равновесие реакции H2S(ж) H+(ж) + HS-(ж) – Q смещается влево при
£ повышение температуры
R понижение температуры
£ уменьшение концентрации ионов H+
R увеличение концентрации ионов H+
6. Задание {{ 345 }} ТЗ № 345
 Равновесие реакции 2CO + O2 2CO2 + Q смещает вправо при
Равновесие реакции 2CO + O2 2CO2 + Q смещает вправо при
£ увеличении температуры
R уменьшении температуры
R увеличении давления
£ уменьшении давления
R уменьшении объема
£ увеличении концентрации CO2
7. Задание {{ 346 }} ТЗ № 346
 При повышении давления в системе N2+O2 2NO равновесие сместится
При повышении давления в системе N2+O2 2NO равновесие сместится
£ вправо
£ влево
R не сместится
8. Задание {{ 347 }} ТЗ № 347
 Чтобы равновесие в системе 2CO + O2 2CO2 сместить вправо следует давление
Чтобы равновесие в системе 2CO + O2 2CO2 сместить вправо следует давление
R повысить
£ понизить
£ не изменять
9. Задание {{ 348 }} ТЗ № 348
 Чтобы сместить равновесие 2СO CO2 + C вправо концентрацию CO2 следует
Чтобы сместить равновесие 2СO CO2 + C вправо концентрацию CO2 следует
R понизить
£ повысить
£ не изменять
10. Задание {{ 349 }} ТЗ № 349
 При понижении температуры равновесие системы 2CO + O2 2CO2 + 568,5 кДж смещается
При понижении температуры равновесие системы 2CO + O2 2CO2 + 568,5 кДж смещается
R вправо
£ влево
£ не смещается
11. Задание {{ 350 }} ТЗ № 350
 При увеличении концентрации CO2 в системе 2CO + O2 2CO2 + 568,5 кДж равновесие смещается
При увеличении концентрации CO2 в системе 2CO + O2 2CO2 + 568,5 кДж равновесие смещается
£ вправо
R влево
£ не смещается
12. Задание {{ 351 }} ТЗ № 351
 Если увеличить концентрацию водорода в системе 2HBr H2 + Br2-70 кДж равновесие сместится
Если увеличить концентрацию водорода в системе 2HBr H2 + Br2-70 кДж равновесие сместится
£ вправо
R влево
£ не сместится
13. Задание {{ 352 }} ТЗ № 352
 Равновесие системы 2HCl H2 + Cl2 –Q при повышении давления сместится
Равновесие системы 2HCl H2 + Cl2 –Q при повышении давления сместится
£ вправо
£ влево
R не сместится
14. Задание {{ 353 }} ТЗ № 353
 Равновесие NH3 + H2O NH4+ + OH- при добавлении к раствору щелочи сместится
Равновесие NH3 + H2O NH4+ + OH- при добавлении к раствору щелочи сместится
£ вправо
R влево
£ не сместится
15. Задание {{ 354 }} ТЗ № 354
 Чтобы сместить равновесие реакции CO2(г) + С(тв) 2CO-173 кДж вправо необходимо
Чтобы сместить равновесие реакции CO2(г) + С(тв) 2CO-173 кДж вправо необходимо
R повысить температуру
£ понизить температуру
£ повысить давление
£ уменьшить концентрацию CO2
R увеличить концентрацию CO2
£ увеличить концентрацию CO
16. Задание {{ 523 }} ТЗ № 523
 При сжатии равновесной системы H2(г)+I2(г) 2HI(г) равновесие сместится
При сжатии равновесной системы H2(г)+I2(г) 2HI(г) равновесие сместится
£ вправо
£ влево
R не сместится
17. Задание {{ 524 }} ТЗ № 524
 При повышении давления равновесие системы 2СО+О2 2СО2 сместится
При повышении давления равновесие системы 2СО+О2 2СО2 сместится
R вправо
£ влево
£ не сместится
18. Задание {{ 525 }} ТЗ № 525
 При повышении температуры равновесие обратимой реакции СО+Н2О СО2+Н2+10 ккал сместится
При повышении температуры равновесие обратимой реакции СО+Н2О СО2+Н2+10 ккал сместится
£ вправо
R влево
£ не сместится
 19. Задание {{ 526 }} ТЗ № 526
19. Задание {{ 526 }} ТЗ № 526
При повышении температуры равновесие обратимой реакции N2+O2 2NO-43 ккал сместится
R вправо
£ влево
£ не сместится
 20. Задание {{ 527 }} ТЗ № 527
20. Задание {{ 527 }} ТЗ № 527
При понижении температуры равновесие системы PCl5 PCl3 + Cl2 -31 ккал сместится
£ вправо
R влево
£ не сместится
21. Задание {{ 528 }} ТЗ № 528
 При понижении температуры равновесие системы N2+3H2 2NH3 +22 ккал сместится
При понижении температуры равновесие системы N2+3H2 2NH3 +22 ккал сместится
R вправо
£ влево
£ не сместится
 22. Задание {{ 529 }} ТЗ № 529
22. Задание {{ 529 }} ТЗ № 529
Чтобы повысить выход SO3 по реакции 2SO2+O2 2SO3 + 45 ккал надо
£ повысить температуру
R понизить температуру
R увеличить концентрацию SO2
R понизить концентрацию SO3
R повысить давление
£ понизить давление
 23. Задание {{ 530 }} ТЗ № 530
23. Задание {{ 530 }} ТЗ № 530
Чтобы сместить равновесие реакции СО2(г) + С(тв) 2СО(г)-173 кДж вправо надо
R повысить температуру
£ повысить давление
£ понизить температуру
R понизить давление
£ уменьшить концентрацию СО2
R уменьшить концентрацию СО
24. Задание {{ 531 }} ТЗ № 531
При повышении температуры равновесие экзотермической реакции смещается
£ вправо
R влево
£ не смещается
25. Задание {{ 532 }} ТЗ № 532
При повышении температуры равновесие эндотермической реакции смещается
R вправо
£ влево
£ не смещается
26. Задание {{ 533 }} ТЗ № 533
При понижении температуры равновесие экзотермической реакции смещается
R вправо
£ влево
£ не изменяется
27. Задание {{ 534 }} ТЗ № 534
При понижении температуры равновесие эндотермической реакции смещается
£ вправо
R влево
£ не смещается
28. Задание {{ 535 }} ТЗ № 535
 При повышении давления в системе 2HCl H2+ Cl2 – Q равновесие сместится
При повышении давления в системе 2HCl H2+ Cl2 – Q равновесие сместится
£ вправо
£ влево
R не сместится
29. Задание {{ 536 }} ТЗ № 536
Отметьте правильный ответ.
 При увеличении концентрации водорода равновесие системы 2HBr H2+ Br2 – 70кДж сместится
При увеличении концентрации водорода равновесие системы 2HBr H2+ Br2 – 70кДж сместится
£ вправо
R влево
£ не сместится
Костанта равновесия.
1. Задание {{ 515 }} ТЗ № 515
 Константа равновесия для реакции A+B C+D выражается формулой
Константа равновесия для реакции A+B C+D выражается формулой
R 
£ 
£ 
£ 
 2. Задание {{ 516 }} ТЗ № 516
2. Задание {{ 516 }} ТЗ № 516
Выражение константы равновесия для реакции N2 + O2 2NO
£ 
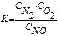
£ 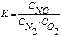
R 
£ 
3. Задание {{ 517 }} ТЗ № 517
 Равновесие реакции 2NO + O2 2NO2 при некоторой температуре установилось при следующих концентрациях реагирующих веществ: СNO=0,2,
Равновесие реакции 2NO + O2 2NO2 при некоторой температуре установилось при следующих концентрациях реагирующих веществ: СNO=0,2, 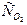 =0,1 и
=0,1 и 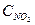 =0,1 моль/л. Константа равновесия этой реакции равна
=0,1 моль/л. Константа равновесия этой реакции равна
£ 0,5
£ 1
R 2,5
£ 5
4. Задание {{ 518 }} ТЗ № 518
 Равновесие реакции 2NO + O2 2NO2 установилось при следующих концентрациях веществ: СNO=0,2,
Равновесие реакции 2NO + O2 2NO2 установилось при следующих концентрациях веществ: СNO=0,2,  =0,1 и
=0,1 и 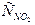 =0,1 моль/л. Первоначальная концентрация оксида азота (II) равна
=0,1 моль/л. Первоначальная концентрация оксида азота (II) равна
£ 0,1
£ 0,2
R 0,3
£ 0,4
5. Задание {{ 519 }} ТЗ № 519
 Константа равновесия системы 2N2+O2 2N2O равна 1,21. Равновесные концентрации
Константа равновесия системы 2N2+O2 2N2O равна 1,21. Равновесные концентрации 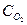 =0,72 и
=0,72 и  =0,84 моль/л. Равновесная концентрация
=0,84 моль/л. Равновесная концентрация 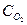 равна (моль/л).
равна (моль/л).
£ 0,96
R 1,12
£ 2,24
£ 3,36
6. Задание {{ 520 }} ТЗ № 520
 Константа равновесия реакции N2+3H2 2NH3 равна 0,1 при (400
Константа равновесия реакции N2+3H2 2NH3 равна 0,1 при (400 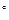 С). Равновесные концентрации
С). Равновесные концентрации  =0,2 и
=0,2 и  =0,08 моль/л. Равновесная концентрация азота равна (моль/л)
=0,08 моль/л. Равновесная концентрация азота равна (моль/л)
£ 2
£ 4
£ 6
R 8
7. Задание {{ 521 }} ТЗ № 521
 Константа равновесия термической диссоциации N2O4 2NO2 равна 0,16. Равновесная концентрация NO2 равна 0,08 моль/л. Равновесная концентрация N2O4 равна
Константа равновесия термической диссоциации N2O4 2NO2 равна 0,16. Равновесная концентрация NO2 равна 0,08 моль/л. Равновесная концентрация N2O4 равна
£ 0,02
R 0,04
£ 0,06
£ 0,08
 8. Задание {{ 522 }} ТЗ № 522
8. Задание {{ 522 }} ТЗ № 522
Константа равновесия термической диссоциации N2O4 2NO2 равна 0,16. Равновесная концентрация NO2 равна 0,08 моль/л. Первоначальная концентрация N2O4 равна (моль/л)
£ 0,02
£ 0,04
£ 0,06
R 0,08
Молекулярность и порядок реакций
1. Задание {{ 168 }} ТЗ № 168
К мономолекулярным реакциям относятся
R Cl2 = 2Cl
R CaCo3 = CaO+CO2
£ H2 + Cl2 = 2HCl
£ 2H2O2 = 2H2O + O2
2. Задание {{ 169 }} ТЗ № 169
К бимолекулярным реакциям относятся
£ Cl2=2Cl
£ CaCO3 = CaO + CO2
R H2 + Cl2 = 2HCl
R 2H2O2 = 2H2O + O2
3. Задание {{ 170 }} ТЗ № 170
Порядок реакции H2 + Cl2 = 2HCl равен
£ 1
R 2
£ 3
£ 4
4. Задание {{ 171 }} ТЗ № 171
Порядок реакции 2H2O2 = 2H2O + O2 равен
R 1
£ 2
£ 3
£ 4
5. Задание {{ 172 }} ТЗ № 172
Порядок реакции СO2 + С = 2СO равен
R 1
£ 2
£ 3
£ 4
6. Задание {{ 173 }} ТЗ № 173
 Порядок реакции С12 H22 O11 + H2O C6 H12 O6 + C6 H12 O6 равен
Порядок реакции С12 H22 O11 + H2O C6 H12 O6 + C6 H12 O6 равен
R 1
£ 2
£ 3
£ 4
7. Задание {{ 174 }} ТЗ № 174
Молекулярность реакции CaCO3 =CaO+CO2 равна
R 1
£ 2
£ 3
£ 4
8. Задание {{ 175 }} ТЗ № 175
Молекулярность реакции 2N2O5 = 4NO2 + O2 равна
£ 1
R 2
£ 3
£ 4
9. Задание {{ 176 }} ТЗ № 176
Порядок реакции в многостадийных реакциях определяется
£ самой быстрой стадией
R самой медленной стадией
£ любой стадией
£ всеми стадиями
10. Задание {{ 177 }} ТЗ № 177
Самая медленная стадия многостадийной реакции определяет её
£ молекулярность
R порядок
£ молекулярность и порядок
11. Задание {{ 178 }} ТЗ № 178
Порядок реакции может быть
R нулевым
R первым
R дробным
R вторым
R третьим
£ четвертым
12. Задание {{ 179 }} ТЗ № 179
Порядок реакции не может быть
R отрицательным
£ нулевым
£ дробным
£ первым
£ вторым
13. Задание {{ 180 }} ТЗ № 180
В реакции 2H2O2 = 2H2O + O2 медленной стадией является
£ O + O = O2
R 2H2O = 2H2 + O2
£ 2H2 + O2 = 2H2O
14. Задание {{ 181 }} ТЗ № 181
Лимитирующей стадией процесса является
£ самая быстрая
R самая медленная
£ конечная
£ первая
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...