
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Предмет и методы молекулярной физики (статический и термодинамический). Термодинамическая система. Параметры системы. Уравнение состояния, обратимые и необратимые процессы.
Предметом изучения являются физические свойства макроскопических объектов, их строение, а так же совершающихся в них процессах, обусловленных тепловым движением и взаимодействием микрочастиц. Методы:
- молекулярно – кинетический (статический) – молекулярная физика изучается на основе микроструктуры вещества, при этом усредненное значение характеристик микрочастиц увязывается с макрохарактеристиками вещ-ва.
- термодинамический – изучает свойство макротел на основе зависимости свойств тел от энергии. В основе этого метода лежат законы сохранения энергии в тепловых процессах, называемые 1 и 2 закон термодинамики. В основе 1 закона лежит МКТ.
Термодинамическая система — это физическая система, состоящая из большого количества атомов и молекул, способная обмениваться с окружающей средой энергией и веществом. Рассматривают термодинамические системы:
*закрытые, не обменивающиеся веществом с др. системами;
*открытые, обменивающиеся веществом и энергией с др. системами;
*адиабатные, в которых отсутствует теплообмен с др. системами;
*изолированные, не обменивающиеся с др. системами ни энергией, ни веществом.
Параметры системы:
Давление— отношение силы, нормальной к поверхности взаимодействия между телами, к площади этой поверхности или в виде формулы: P = F/S.
Температура—это мера средней кинетический энергии хоатического движения молекул
Объём— количественная характеристика пространства, занимаемого телом или веществом 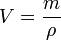
Масса— физическая величина тела, являющаяся мерой его инерционных и гравитационных свойств.
Молярная масса вещества — масса одного моля вещества.
Уравнение состояния: Термическое уравнение состояния связывает макроскопические параметры системы. Для системы с постоянным числом частиц его общий вид можно записать так:  То есть, задать термическое уравнение состояния значит конкретизировать вид функции.
То есть, задать термическое уравнение состояния значит конкретизировать вид функции.
Обратимые и необратимые процессы, пути изменения состояния термодинамич. системы. Процесс называется обратимым, если он допускает возвращение системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называются необратимым. Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и др.
4.Экпериминтальные газовые законы. Абсолютная шкала температур. Простейшими процессами в идеальном газе являются изопроцессы. Это процессы, при которых масса газа и один из его параметров состояния (температура, давление или объем) остаются постоянными.
*Изотермический процесс — это изопроцесс изменения давления газа в зависимости от объема, происходящий при постоянной температуре: Τ = const. Закон экспериментально открыли независимо друг от друга английский химик и физик Бойль (1662) и французский физик Мариотт (1676). Закон изотермического процесса (Бойля-Мариотта): для данной массы газа при постоянной температуре произведение давления на объем есть величина постоянная: p⋅V=const или для двух состояний p1⋅V1=p2⋅V2
*Изобарный процесс – это изопроцесс изменения объема газа в зависимости от температуры, протекающей при неизменном давлении. Зависимость объема газа от его температуры при постоянном давлении была установлена Л. Гей-Люссаком, который показал, что объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры (закон Гей-Люссака) : V = V 0 ·(1 + a*t), где V – объем газа при температуре t , ° С ; V 0 – его объем при 0 ° С. а - температурным коэффициентом объемного расширения . Для всех газов a = (1/273 ° С –1 ).
*Изохорический процесс – процесс изменения давления газа в зависимости от температуры, протекающей при неизменном объеме
Исследования зависимости давления данной массы газа от температуры при неизменном объеме были впервые проведены французским физиком Шарлем. Им было установлено, что давление газа данной массы при постоянном объеме возрастает линейно с увеличением температуры (закон Шарля, Гей-Люссака) : P = P 0 (1+ а* t). Здесь P – давление газа при температуре t , °С ; P 0 – его давление при 0 °С .
Д.Дальтон установил соотношение между давлением газовой смеси и парциальным давлениями входящих в нее газов. Парциальное давление — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Р = р1+р2+р3+р4….
Закон Авогадро:при одинаковых температуре и давлении моли любых газов занимают одинаковые объемы или в равных объёмах V различных газов при одинаковых давлении p и температуре Т содержится одинаковое число молекул.
Абсолютная шкала температур Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию. Абсолютный ноль определён как 0 K, что равно −273.15 °C (точно). Шкала температур Кельвина, в которой начало отсчёта ведётся от абсолютного нуля. Абсолютный нуль температуры (реже — абсолютный ноль температуры) — минимальный предел температуры, которую может иметь физическое тело во Вселенной.
5.Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температуройидеального газа
. Уравнение имеет вид:
где
-
 — давление,
— давление, -
 — молярный объём,
— молярный объём, -
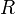 — универсальная газовая постоянная
— универсальная газовая постоянная -
 — абсолютная температура,К.
— абсолютная температура,К.
Физический смысл газовой постоянной - она показывает сколько Дж нужно сообщить 1 моль газа что бы температура изменилась на 1 К
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...