
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Длина свободного пробега молекулы — это среднее расстояние, которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега λ.Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
λ =1/2dn-средняя длина свободного пробега. Частицы движутся, причем после каждого столкновения изменяется направление движения частицы.За 1 секунду молекула пройдет путь, равный ее скорости, но траектория этого движения будет не прямая, а ломаная линия.
*как было описано ранее,эффективный диаметр молекул убывает с ростом температуры. Поэтому при заданной концентрации молекул средняя длина свободного пробега увеличивается с ростом температуры. Λ=kT/корент из2 Пd*dP
Внутренняя энергия - это энергия движения и взаимодействия частиц, из которых состоит энергия характеризует тепловое состояние тела. Мерой изменения энергии в процессе теплопередачи является количество теплоты.
*Теплота и работа-2 формы изменения внутренней энергии. Теплота — это энергия, полученная в результате изменения температуры.. работа — это физическая величина, являющаяся скалярной количественной мерой действия силы или сил на тело или систему, зависящая от численной величины, направления силы (сил) и от перемещения точки (точек) тела или системы
* ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ - невозможность существования вечного двигателя 1-го рода, к-рый совершал бы работу, не черпая энергию из к--л. источника.
Согласно П. н. т., теплота Q, сообщаемая системе, равна сумме приращения внутр. энергии U и работы, производимой системой против внеш. сил: Q=DU+A
Q = U2-U1 + A; при бесконечно малом изменении состояния системы:бQ=dU+бА,где бQ- - бесконечно малое кол-во теплоты, передаваемой системе, a бA- работа, совершаемая системой против внеш. сил, dU - изменение её внутр. энергии. Первое начало термодинамики утверждает, что U является функцией состояния системы, то есть каждое состояние термодинамической системы характеризуется определённым значением U, независимо от того, каким путём система приведена в данное состояние (в то время как значения Q и А зависят от процесса, приведшего к изменению состояния системы). При исследовании термодинамических свойств физической системы первое начало термодинамики обычно применяется совместно со вторым началом термодинамики.
* из математического выражения первого начала термодинамики следует:
Qv = ΔE.
Из вышеуказанного соотношения вытекает термо–динамическое определение: внутренняя энергия – функция состояния, приращение которой равно теп–лоте QV , полученной системой в изохорном процессе. Следовательно, изменение внутренней энергии в не–котором процессе может быть измерено при проведе–нии этого процесса в калориметре при постоянном объеме. Следует, что при ρ = const приращения внут–ренней энергии и энтальпии связаны соотношением:
ΔH = ΔE + ρΔV.
* Термодинамическая система – это совокупность тел, способных обмениваться энергией между собой и с другими системами. Замкнутая термодинамическая система не обменивается энергией с другими системами.
Термодинамическое равновесие – это состояние, при котором параметры системы имеют определенные, не меняющиеся со временем значения. Свойства термодинамической системы в равновесном состоянии характеризуют не только непосредственно задаваемыми параметрами состояния, но и так называемыми функциями состояния.
Термодинамическая система может взаимодействовать со своим окружением, и это взаимодействие можно обнаружить по переносу тепла или совершению работы. В том случае, когда взаимодействие системы со средой полностью отсутствует, система называется изолированной. Если состояние термодинамической системы остается неизменным и причиной этого не является какой-либо внешний стационарный процесс, говорят, что система находится в равновесии. Если система состоит из одной фазы, то она гомогенная, в противном случае - гетерогенная.
Переход вещества из одного состояния в другое, называется процессом
Состояние системы, в котором ее свойства не изменяются во времени, называется равновесным состоянием. В настоящем курсе в качестве термодинамической системы часто будет рассматриваться рабочее тело – вещество, посредством которого осуществляются рабочие процессы теплоэнергетических установок.
Если единственным результатом обратного процесса в изолированной системе является возвращение системы из конечного состояния в исходное, то такой процесс называют обратимым. Если в результате прямой или обратной реакции в системе или в ее окружении имеют место длительные изменения, то процесс называют необратимым.
Параметры-физические величины,характеризующие процесс состояние,определяющее его и позволяющее отличить от подобного
Кинети́ческая эне́ргия — энергия механической си
Кинети́ческая эне́ргия — энергия механической системы, зависящая от скоростей движения её точек. Часто выделяют кинетическую энергию поступательного и вращательного движения.
Потенциальная энергия — скалярная физическая величина, характеризующая способность некого тела (или материальной точки) совершать работу за счет своего нахождения в поле действия сил.
Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу

где S — площадь поршня, Sdl=dV— изменение объема системы. Таким образом,

Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы:
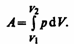
Работа газа в изопроцессах.
| Изопроцесс | Работа газа | |||
| Изохорный V=const, V=P/T |   P
A=0 P
A=0
 V V
| |||
   Изобарный
P=const, P=V/T Изобарный
P=const, P=V/T
| Р А=р(V2-V1)= pΔV
V | |||
 Изотермический
T=const, T=PV, ΔU = 0 Изотермический
T=const, T=PV, ΔU = 0
| P
A>0
 V V
| |||
  Адиабатный
Q=const Адиабатный
Q=const
|  P
A>0
V P
A>0
V
|
| |
|
Теплоемкость идеального газа — это свойство вещества принимать тепловую энергию; это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.

Молярная теплоемкость
Молярная теплоемкость — теплоемкость 1 моля идеального газа.


Уде́льная теплоёмкость - физическая величина, численно равная количеству теплоты, которое необходимо передать телу массой 1 кг для того, чтобы его температура изменилась на 1 Кельвин. Удельная теплоемкость обозначается буквой c и измеряется в Дж/кг*Кельвин.
Единицей СИ для удельной теплоёмкости является джоуль на килограмм-кельвин. Следовательно, удельную теплоёмкость можно рассматривать как теплоёмкость единицы массы вещества. На значение удельной теплоёмкости влияет температура вещества. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C.
Формула расчёта удельной теплоёмкости:  , где
, где  — удельная теплоёмкость,
— удельная теплоёмкость,  — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
— количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),  — масса нагреваемого (охлаждающегося) вещества,
— масса нагреваемого (охлаждающегося) вещества,  — разность конечной и начальной температур вещества.
— разность конечной и начальной температур вещества.
Теплоемкость идеального газа в изопроцессах
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть  . Однако, объём, давление и температура меняются, то есть
. Однако, объём, давление и температура меняются, то есть  .
.
Следовательно, теплоемкость идеального газа в адиабатическом процессе равна нулю:  .
.
Изотермический
В изотермическом процессе постоянна температура, то есть  . При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности:
. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: 
Изохорный
В изохорном процессе постоянен объем, то есть  . Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение (  ). Первое Начало Термодинамики для изохорного процесса имеет вид:
). Первое Начало Термодинамики для изохорного процесса имеет вид:
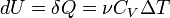
А для идеального газа

Таким образом,

где 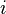 — число степеней свободы частиц газа.
— число степеней свободы частиц газа.
Изобарный
В изобарном процессе (  ):
):

CP=δQ/νΔT=CV+R=((i+2)/2)*R
Вывод формулы для теплоемкости в данном процессе
Согласно 1 началу термодинамики существует 2 способа изменить внутреннюю энергию тела (в нашем случае идеального газа): передать ему тепло или совершить над ним работу.
dU=δQ+δA, где δA — работа окр. среды над газом.
δAокр.среды=-δAгаза
δQ=dU+δAгаза
В расчете на 1 моль:
С=δQ/ΔT=(ΔU+pΔV)/ΔT
ΔU=CV*ΔT C=CV+(pΔV/ΔT)в данном процессе
Соотношение Майера
Для любого идеального газа справедливо соотношение Майера:
 ,
,
где 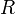 — универсальная газовая постоянная,
— универсальная газовая постоянная,  — молярная теплоёмкость при постоянном давлении,
— молярная теплоёмкость при постоянном давлении,  — молярная теплоёмкость при постоянном объёме.
— молярная теплоёмкость при постоянном объёме.
Уравнение Майера вытекает из первого начала термодинамики, примененного к изобарному процессу в идеальном газе:
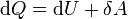 ,
,
в рассматриваемом случае:

 .
.
Очевидно, уравнение Майера показывает, что различие теплоёмкостей газа равно работе, совершаемой одним молем идеального газа при изменении его температуры на 1 K, и разъясняет смысл универсальной газовой постоянной  — механический эквивалент теплоты.
— механический эквивалент теплоты.
Физический смысл - универсальной постоянная R, входящая в уравнение состояния 1 моля идеального газа: pv = RT (см.Клапейрона уравнение), где р - давление, v - объём, Т - абсолютная температура. Г. п. имеет физический смысл работы расширения 1 моля идеального газа под постоянным давлением при нагревании на 1°. С другой стороны, разность молярных теплоёмкостей (См. Теплоёмкость) при постоянном давлении и постоянном объёме ср - cv = R (для всех сильно разреженных газов). Г. п. обычно численно выражается в следующих единицах:
дж/град-моль..8,3143 ± 0,0012(1964 год)
Универсальная Г. п., отнесённая не к 1 молю, а к 1 молекуле, называется Больцмана постоянной
Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении (  ) к теплоёмкости при постоянном объёме (
) к теплоёмкости при постоянном объёме (  ). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой
). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой 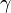 (гамма) или
(гамма) или  (каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква
(каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква 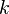 [1].
[1].
Уравнение:
 ,
,
где
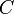 — теплоёмкость газа,
— теплоёмкость газа,
 — удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
— удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
индексы  и
и  обозначают условие постоянства давления или постоянства объёма, соответственно.
обозначают условие постоянства давления или постоянства объёма, соответственно.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...

 Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:
Из первого начала термодинамики (δQ=dU+δA) для изохорного процесса следует, что вся теплота, которая сообщается газу, идет на увеличение его внутренней энергии:  т.к. CV=dUm/dt,
т.к. CV=dUm/dt,  (1) Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна
(1) Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, которая параллельна оси V. При изобарном процессе работа газа при увеличения объема от V1 до V2 равна  откуда
откуда 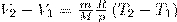 Тогда выражение (2) для работы изобарного расширения примет вид
Тогда выражение (2) для работы изобарного расширения примет вид 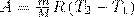 (3) Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
(3) Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
 Рис.1
В изобарном процессе при сообщении газу массой m количества теплоты
Рис.1
В изобарном процессе при сообщении газу массой m количества теплоты  его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)
его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)  При этом газ совершит работу, определяемую выражением (3). Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
При этом газ совершит работу, определяемую выражением (3). Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта: 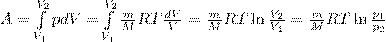 Так как при Т=const внутренняя энергия идеального газа не изменяется:
Так как при Т=const внутренняя энергия идеального газа не изменяется:  то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса
то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса  т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:  (4) Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.
(4) Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.