
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Определение ферментативной активности
В солоде определяют активность амилолитических, декстринолитических и осахаривающих ферментов.
Колориметрический метод определения амилолитйческой (декстриногенной) активности (метод ВНИИФСа)
Амилолитическую (или декстриногенную) активность определяют по скорости ферментативного гидролиза крахмала, которую устанавливают по количеству крахмала, превращенного в процессе этой реакции. Декстриногенная активность характеризует способность ферментов солода катализировать расщепление 1 г крахмала в основном на декстрины с очень небольшим образованием сахаров, Эта активность в основном обусловлена присутствием, а-амилазы.
Активность солода характеризуется числом единиц, амилолитической активности (АС), содержащихся в 1 г или 100 мл исследуемого материала. За единицу амилолитической активности принимают такое количество фермента, которое катализирует гидролиз 1 г растворимого крахмала в строго определенных стандартных условиях (температура реакции 30° С; рН раствора 4,7—4,9; продолжительность 60 мин; постоянное соотношение фермент — субстрата в реакционной среде, обеспечивающее гидролиз крахмала на 30% за 10 мин).
В основу определения амилолитической активности , полупродуктов спиртового производства положена зависимость степени гидролиза крахмала от числа единиц фермента, взятого на анализ для проведения ферментативной реакции.
Степень гидролиза крахмала определяют колориметрические йодометрическим методом.
Активность ферментного материала подсчитывают по уравнению, составленному на основе изучения зависимости степени гидролиза крахмала от количества ферментного материала, взятого на реакцию.
Ход определения. Приготовление ферментного раствора. Для определения амилолитической активности отбирают среднюю пробу солода, измельчают и определяют влажность.
Одновременно берут навеску солода 5 г для проведения ферментативной реакции, помещают ее в стакан, заливают 10 мл фосфатного буфера с рН 4,7—4,9 и 90 мл дистиллированной воды. Полученную смесь для полного извлечения ферментов выдерживают в термостате при 30° С в течение часа, периодически перемешивая ее стеклянной палочкой. Затем смесь фильтруют, и фильтрат используют в качестве основного раствора для определения амилолитической активности солода.
Для проведения ферментативной реакции используют рабочий раствор, который готовят из основного путем разбавления (табл. 2).
Таблица 2. Приготовление рабочих растворов
| Просяной солод | Ржаной, ячменный и овсяный солод | ||||
| предполагаемая активность, ед./г. | расход основного раствора на приготовление рабочего, мл/100 мл | Масса солода в реакционной среде n, мг | предполагаемая активность, ед./г. | расход основного раствора на приготовление рабочего, мл/100 мл | Масса солода в реакционной среде n, мг |
| 5—10 11-15; 16—20 | 30,0 20,0 10,0 | 16—20 21—30 31—50 | 20,0 10,0 7,5 |
Проведение ферментативного гидролиза крахмала. Реакцию проводят в строго определенных, стандартных условиях с использованием фосфатного, буфера, продолжительность 10 мин; объем реакционной среды 15 мл (10 мл субстрата и 5 мл ферментного раствора).
Для анализа берут две пробирки высотой 180 мм и диаметром 18 мм, наливают в каждую по 10 мл субстрата и ставят в ультратермостат. Пользоваться воздушным термостатом не рекомендуется. Предпочтительно пользоваться ультратермостатом (или водяной баней) с постоянной температурой 30±0,2°С. В термостате пробирки выдерживают 5—10 мин, чтобы растворы приняли необходимую температуру, затем, не вынимая пробирок из термостата, наливают в первую из них 5 мл дистиллированной воды (контрольная проба), а во вторую — 5 мл рабочего раствора фермента (испытуемая проба). Смеси быстро перемешивают и выдерживают в ультратермостате в течение 10 мин, после чего вынимают пробирки из термостата и отбирают от контрольного и испытуемого растворов по 0,5 мл, переносят их в одну из колбочек с предварительно налитыми туда 50 мл рабочего раствора йода в 0,1 н. растворе соляной кислоты и взбалтывают. В растворах под действием соляной кислоты происходит инактивация ферментов — действие их прекращается. Продукты реакции вступают во взаимодействие с йодом, и растворы окрашиваются: первый (из контрольной пробы) — в синий цвет, второй (из опытной пробы)— в фиолетово-коричневый различной интенсивности в зависимости от количества прогидролизованного крахмала.
Непосредственно после смешивания растворов проводят определение их оптической плотности на фотоэлектроколориметре ФЭК-Н-60 или другой марки, в кюветах с длиной грани 1 см при красном светофильтре (λ—656 нм). Колориметрирование проводят по инструкции, прилагаемой к прибору, снимая показания по красной шкале левого барабана.
Оптическая плотность контрольного раствора показывает количество исходного крахмала в субстрате. Оптическая плотность опытного раствора соответствует количеству «крахмала», оставшегося непрогидролизованным после действия фермента. Этот крахмал следует понимать условно, так как фактически в растворе крахмала нет, он превратился в декстрины, которые и дают фиолетово-коричневую окраску. Разница оптических плотностей обоих растворов соответствует тому количеству крахмала, которое подверглось гидролизу под действием ферментов исследуемого материала.
Содержание прогидролизованного крахмала определяют по формуле
C= 
где D1 и D2 — оптические плотности соответственно контрольного и опытного растворов; 0,1 — количество крахмала, взятое на анализ, г.
Если окажется, что количество прогидролизованного крахмала меньше 0,020 или больше 0,075 г, то анализ повторяют. Готовят рабочий раствор с большим или меньшим количеством основного раствора.
Если в результате ферментативной реакции количество превращенного крахмала находится в указанных пределах, полученные данные используют для определения амилолитической активности по специальному уравнению, подставляя в него найденную величину. Вследствие специфичности комплекса ферментов солодов определение их активности проводится по специальным уравнениям, характерным и применимым только для анализа этого рода ферментов.
Уравнение для расчета амилолитической активности солода имеет вид:
АС= 
где С — количество превращенного крахмала, г;
6,889 и 0,029388 — коэффициенты, полученные при математической обработке экспериментальных данных изучения зависимости количества прогидролизованного крахмала от количества фермента, взятого на анализ (в коэффициенты введен пересчет на 60 мин действия фермента);
п — масса солода в реакционной среде, мг.
Пример.Для анализа взят ячменный солод. Приготовлен основной раствор: 5 г солода в 100 мл дистиллированной воды с фосфатным буфером. Солод предположительно обладает высокой активностью—порядка 30 ед/г. По табл. 13 находим количество основного раствора солода, необходимое для приготовления рабочего. Оно равно 4 мл/100 мл.
Тогда в 5 мл рабочего раствора солода будет содержаться 10 мг (n=10).
При колориметрировании получены следующие значения оптических плотностей: D1=0,725, D2=0,388.
Количество прогидролизованного крахмала:
C=  =0,04648 г
=0,04648 г
Подставляя значения С и п в уравнение определяем АС исследуемого солода:
АС=  =29,08 ед/г
=29,08 ед/г
или АС в пересчете на абсолютно сухое вещество при влажности солода 38%
 =46,9 ед/г
=46,9 ед/г
Химический метод определения декстринолитической активности (ДС) (метод ВНИИСПа)
Декстринолитическая активность характеризуется способностью ферментов катализировать гидролиз конечных декстринов (фосфодекстринов) со связью 1—6. Солод и культуры плесневых грибов характеризуются количеством единиц декстринолитической активности (ДС), содержащихся в 1 г или в 100 мл исследуемого материала. За единицу декстринолитической активности принимается такое количество фермента, которое катализирует гидролиз 1 г конечных декстринов до редуцирующих сахаров за 1 ч в строго стандартных условиях (температура реакции 30°С; продолжительность 60 мин; рН среды 4,7—4,9; концентрация, субстрата 1%; объем реакционной среды 15 мл; объем субстрата 10 мл; постоянное соотношение фермент — субстрат в реакционной жидкости, обеспечивающее гидролиз декстринов на 30% за 60 мин).
В основу определения декстринолитической активности ферментных материалов положена зависимость количества сахара, образовавшегося в процессе ферментной реакции, от числа единиц фермента, взятого на анализ.
Количество сахара, образовавшегося в процессе ферментной реакции, определяют йодометрическим методом. Количество взятого на анализ фермента устанавливают по графику (или соответствующему ему расчетному уравнению), где по оси абсцисс откладывается число единиц фермента, взятое на анализ, а по оси ординат— количество сахара, образовавшегося в процессе ферментативной реакции.
Относя полученную величину к 1 г или 1 мл исследуемого ферментного материала, определяют его декстринолитическую активность в условных единицах (ДС).
Ход определения.Приготовление исследуемого ферментного раствора солода. Берут 5 г солода (ячменного, просяного или овсяного) из расчета на абсолютно сухое вещество, растирают в ступке с кварцевым песком или измельченным стеклом, прибавляют 5 мл фосфатного буферного раствора с рН 4,85 и 45 мл дистиллированной воды. Полученную смесь перемешивают и выдерживают в термостате 30 мин при 30° С, затем раствор фильтруют и фильтрат используют для анализа.
Приготовление реактивов для проведения анализа описано в приложении.
Проведение ферментативной реакции. В две пробирки (длиной 180 мм и диаметром 18 мм) вводят пипеткой точно по 10 мл 1%-ного раствора субстрата. Пробирки с субстратом помещают на 10 мин в термостат с температурой 30° С, чтобы субстрат приобрел эту температуру. Затем в пробирки с субстратом вводят по 5 мл ферментного раствора, перемешивают и выдерживают реакционную смесь в термостате в течение часа при 30° С для проведения ферментной реакции.
По истечении этого времени реакцию приостанавливают добавлением в реакционную смесь 1 мл 1 н. раствора соляной кислоты. Затем в растворе определяют количество образовавшегося сахара. Для этого содержимое пробирок количественно переносят в коническую колбу на 300 мл, пробирки ополаскивают водой, промывные воды приливают в колбу с реакционной смесью и добавляют 20 мл 0,1 н. раствора йода и сразу же по каплям при перемешивании приливают 60 мл 0,1 н. раствора едкого натра или кали. Колбу накрывают часовым стеклом и оставляют стоять в течение 15 мин. Затем в раствор вводят 2 мл разбавленной серной кислоты (1:4) и оттитровывают избыток йода 0,1. н. раствором гипосульфита. Одновременно ставят контрольный опыт, необходимый для определения содержания сахаров в самом субстрате. Для проведения контрольного опыта в колбочку на 300, мл вводят 10 мл субстрата, 1 мл 1 н. раствора соляной кислоты, 5 мл ферментной вытяжки. Добавляют воды до 100 мл и проводят определение сахара таким же образом, как и в основном опыте. Количество образовавшегося сахара определяют по разности между объемом гипосульфита, пошедшим на титрование контрольной и исследуемой проб. Эта разность должна быть в пределах 1—6 мл. Если она больше 6 мл или меньше 1 мл, то анализ повторяют, соответственно уменьшая или увеличивая навеску исследуемого продукта.
Если разность между контрольным и исследуемым опытами находится в указанных пределах, полученные данные используют для определения декстринолитической активности.
Для расчета декстринолитической активности берут среднее значение объема гипосульфита, пошедшего на титрование двух параллельных проб. Для определения сахара, образовавшегося в процессе реакции, полученную разность умножают на 17,1 мг, так как 1 мл 0,1 н. раствора йода или 1 мл 0,1 н. раствора гипосульфита эквивалентны 17,1 мг мальтозы.
Декстринолитическая активность определяется по расчетному уравнению, которое составлено на основе экспериментально выявленной зависимости между образовавшимся сахаром и количеством фермента в исследуемом материале, взятом для анализа.
Уравнение для расчета ДС солодов имеет вид (в ед,/г):
ДС=  ед/г
ед/г
где 1,240; 7,5 — коэффициенты, определенные экспериментальным путем;
b— разность в объеме гипосульфита при основном и контрольном титровании;
17,1 - количество мальтозы, эквивалентное 1 мл 0,1 н. раствора йода или 1 мл 0,1 н. раствора гипосульфита, мг;
а — количество исследуемого солода в вытяжке, взятой на анализ, г.
Пример.Взята навеска солода 5 г. На анализ взято 5 мл ферментной вытяжки. В ней содержится 0,5 г солода. Следовательно, а = 0,5. На титрование исследуемой пробы пошло 13,35 мл 0,1 н. раствора гипосульфита. На титрование контрольной пробы — 15,35 мл. Разность, в количестве раствора гипосульфита, пошедшего на титрование контрольной и исследуемой проб, b= 15,35- 13,35 = 2 мл.
Декстринолитическая активность солода будет равна
ДС=  =65,58x10;3 ед/г
=65,58x10;3 ед/г
Колориметрический метод определения осахаривающей активности ОС (метод ВНИИПрБ)
Осахаривающая активность характеризует способность ферментов катализировать гидролиз крахмала до сахаров.
Активность солода и культур плесневых грибов характеризуется числом единиц осахаривающей активности ОС, содержащихся в 1 г исследуемого материала. В основу определения осахаривающей активности положена зависимость количества крахмала, превращающегося в сахара в процессе ферментативного гидролиза, от числа единиц активности фермента, взятого на анализ.
Количество взятых на определение единиц фермента узнают по выведенному графику (или соответствующему ему уравнению), где по оси ординат отложена оптическая плотность, пропорциональная количеству образовавшегося сахара, а по оси абсцисс — число единиц фермента. Относя полученную величину к 1 г исследуемого ферментного материала, определяют его активность в условных единицах.
За единицу осахаривающей активности (ОС) принимается такое количество фермента, которое катализирует гидролиз 1 г растворимого крахмала до спирторастворимых сахаров, определяемых в ед. глюкозы, в строго определенных стандартных условиях (температура реакции 30° С; рН раствора 4,85 и время 10 мин; постоянное соотношение фермент — субстрат в реакционной жидкости, обеспечивающее превращение крахмала за 10 мин в глюкозу на 10%).
Для определения осахаривающей активности используют ту же реакционную среду, в которой определяют амилолитическую активность. Устанавливают в ней содержание спирторастворимых сахаров (в ед. глюкозы), образовавшихся в процессе ферментативной реакции, которое определяют в фильтрате после осаждения высокомолекулярных углеводов спиртом, с применением антронового колориметрического метода.
Для определения берут 3 мл реакционной жидкости в мерную колбу на 25 мл, добавляют для осаждения непрогидролизованного крахмала и декстринов 22 мл спирта-ректификата (96% об.), осадок отфильтровывают, от фильтрата отбирают 25 мл и разбавляют его водой в 2 раза. В разбавленном фильтрате непосредственно определяют сахар. Для этого берут 5 мл антронового реактива, помещают его в пробирку из тугоплавкого стекла с притертой пробкой и осторожно по стенке пробирки доливают к реактиву 2,5 мл разбавленного спиртового фильтрата с таким расчетом, чтобы жидкости не смешивались, а образовали два слоя, после чего пробирки закрывают притертой пробкой.
Параллельно готовят холостую пробу путем добавления таким же способом к 5 мл реактивов 25 мл разбавленного спирта (3 мл воды и 22 мл спирта) с последующим разбавлением раствора водой в 2 раза. Содержимое пробирок энергично встряхивают в течение 10 с, ставят в штатив и погружают в бурно кипящую водяную баню, замечают начало кипения воды в бане, которое должно возобновиться через 0,5 мин, и выдерживают раствор в бане 5,5 мин. Общее время выдержки проб в бане должно быть 6 мин. Затем штатив с пробирками вынимают, помещают в баню с проточной водой (температурой 8—10° С) и охлаждают жидкость до 20° С.
Раствор после реакции приобретает сине-зеленую окраску. В окрашенных растворах определяют оптическую плотность на фотоэлектроколориметре по инструкции, прилагаемой к прибору, в кювете с длиной грани 0,5 см и при длине световой волны λ= 610 нм, снимая показания по красной шкале левого барабана. Если окажется, что оптическая плотность раствора больше 0,800 или меньше 0,150, то анализ повторяют, уменьшая или увеличивая количество основного раствора для приготовления рабочего. Если при анализе оптическая плотность будет находиться в указанных пределах, полученные данные используют для определения осахаривающей активности по следующему уравнению:
ОС= 
Пример. Для анализа взят ячменный солод влажностью 42,0%. Приготовлена вытяжка 5 г солода на 100 мл воды с фосфатным буфером; для вторичного разбавления взято 2 мл вытяжки на 100 мл воды.
В 5 мл разбавленного раствора находилось
 =0,005 г
=0,005 г
солода (n=5). При колориметрировании получили значение оптической плотности 0,652.
Осахаривающая активность солода
ОС=  =19,36 ед/г
=19,36 ед/г
или на абсолютно сухое вещество солода при влажности его 42%

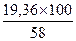 =33,38 ед/г
=33,38 ед/г
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...