
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Аналитическое выражение первого начала термодинамики
Основные соотношения процесса истечения.
Уравнение распределения потенциальной работы:
 .
.
Так как рассматриваются обратимые потери, то 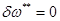 .
.
Так как рассматривается чистое движение, то  .
.
Следовательно:  .
.

Так как рассматриваются короткие каналы, то  ,
,  .
.
Выражение для линейной скорости:  .
.
Выражение для массовой скорости: 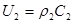 .
.
Выражение для массового расхода:  .
.
Основные исходные соотношения.
Уравнение для линейной скорости:  .
.
Уравнение для массовой скорости:  .
.
Уравнение для массового расхода:  .
.
Истечение несжимаемой (капельной) жидкости.
Условия не сжимаемости жидкости:  ,
,  .
.
Рассматриваем изохорный процесс. Потенциальную работу можно найти по следующей формуле:  .
.
Подставив это в уравнение для линейной скорости, получим:  .
.
Графическое представление зависимости скорости то перепада давления:

Подставив это в уравнение для массовой скорости, получим:  .
.
Подставив это в уравнение для массового расхода, получим:  .
.
Действительная линейная скорость отличается от теоретической, поэтому вводят коэффициент скорости  , где
, где  - действительная линейная скорость,
- действительная линейная скорость,  - теоретическая линейная скорость. Поэтому действительную линейную скорость можно найти по формуле:
- теоретическая линейная скорость. Поэтому действительную линейную скорость можно найти по формуле:  .
.
 При течении жидкости в трубе с переменным сечением наблюдается отрыв струи от стенок и площадь сечения течения становится меньше площади сечения трубопровода. В связи с этим вводят коэффициент сжатия струи
При течении жидкости в трубе с переменным сечением наблюдается отрыв струи от стенок и площадь сечения течения становится меньше площади сечения трубопровода. В связи с этим вводят коэффициент сжатия струи  , при этом он лежит в пределах от 0.6 до 1. Если профиль канала параболический, то
, при этом он лежит в пределах от 0.6 до 1. Если профиль канала параболический, то  .
.
Действительный массовый расход можно найти по формуле:  , где
, где 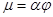 - коэффициент расхода.
- коэффициент расхода.
Дросселирование.
Дросселирование – процесс движения паров, жидкостей и газов через внезапное сужение(местное сопротивление).


Для быстро протекающего процесса можно теплотой внешнего теплообмена пренебречь, то есть  , также
, также  ,
,  .
.
Первое начало термодинамики:  , следовательно,
, следовательно,  , или
, или  , то есть процесс изоэнтальпийный, но он реальный, то есть протекает с необратимыми потерями давления.
, то есть процесс изоэнтальпийный, но он реальный, то есть протекает с необратимыми потерями давления.
Явление изменения температуры газа или жидкости при адиабатном дросселировании называется эффектом Джоуля – Томсона  .
.
Для характеристики дроссельного процесса вводится коэффициент Джоуля-Томпсона:  , который можно найти по следующей формуле
, который можно найти по следующей формуле  . Если
. Если  , то
, то  . Если
. Если  , то
, то  . Если
. Если 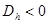 , то
, то  .
.

Дросселирование является изоэнтальпийным процессом, при котором 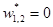 .
.
Для идеального газа  , тогда
, тогда  , следовательно
, следовательно  .
.
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела однозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
 ;
;
 .
.
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
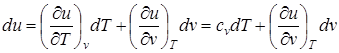 ; (1)
; (1)
 . (2)
. (2)
Для изохорного процесса (  ) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
) частная производная внутренней энергии по температуре равна истинной изохорной теплоемкости
 , (3)
, (3)
а для изобарного процесса (  ) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
 . (4)
. (4)
В результате подстановки выражений (1) и (2) в уравнение  и разделения переменных получим:
и разделения переменных получим:
 . (5)
. (5)
Данное соотношение (5) называется первым началом термодинамики для простых тел в аналитической форме.
5. Теплоёмкость–количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная теплоемкость:  , где
, где  - какой-то процесс.
- какой-то процесс.  . При изохорном процессе
. При изохорном процессе  , следовательно, получаем изохорную теплоёмкость -
, следовательно, получаем изохорную теплоёмкость -  . При изобарном процессе
. При изобарном процессе  , следовательно, получаем изобарную теплоёмкость
, следовательно, получаем изобарную теплоёмкость  .
.
Объёмная теплоёмкость  :
:
· Объемная изобарная теплоёмкость -  .
.
· Объёмная изохорная теплоёмкость -  .
.
Молярная теплоёмкость 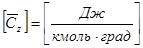 :
:
· Молярная изобарная теплоёмкость -  .
.
· Молярная изохорная теплоёмкость -  .
.
Средняя теплоёмкость  .
.
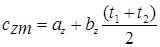 -первая сред.теплоемкость-численно равна истинной теплоемкоти при среднеарифм.температуре процесса.
-первая сред.теплоемкость-численно равна истинной теплоемкоти при среднеарифм.температуре процесса.
Ср=Сv+R – уравнение Майера.
6. Энтропия  ,
,  .
.
Удельная энтропия  ,
,  .
.


Энтропия, как и время, всё время возрастает. Только в изолированной системе энтропия может оставаться постоянной.

При давлении  и температуре
и температуре 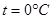 удельная энтропия
удельная энтропия  .
.
 , где
, где  - вторая средняя теплоёмкость или логарифмическая теплоёмкость.
- вторая средняя теплоёмкость или логарифмическая теплоёмкость.
 Так как
Так как  , то если энтропия растёт, то есть
, то если энтропия растёт, то есть  , то тепло подводится, то есть
, то тепло подводится, то есть  .
.
Уравнение, определяющее энтропию:

7. Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где величина  называется показателем политропы.
называется показателем политропы.
В зависимости от процесса можно определить значение n:
1. Изотермический процесс: n = 1, так как PV1 = const, значит PV = const, значит T = const.
2. Изобарный процесс: n = 0, так как PV0 = P = const.
3. Адиабатный процесс: n = γ, это следует из уравнения Пуассона.
4. Изохорный процесс:  , так как
, так как  , значит P1 / P2 = (V2 / V1)n, значит V2 / V1 = (P1 / P2)(1 / n), значит, чтобы V2 / V1 обратились в 1, n должна быть бесконечность.
, значит P1 / P2 = (V2 / V1)n, значит V2 / V1 = (P1 / P2)(1 / n), значит, чтобы V2 / V1 обратились в 1, n должна быть бесконечность.
8. Работа политропного процесса определяется аналогично как при адиабатном процессе:
l = R·(T1 – T2) / (n – 1); (4.25)
l = R·T1·[1 – (n 1/ n 2) n-1] /(n – 1); (4.26)
l = R·T2·[1 – (P2/P1) (n-1)/ n] /(n – 1). (4.27)
Теплота процесса:
q = cn ·(T2 – T1), (4.28)
где cn = cv ·(n - l)/(n – 1) – массовая теплоемкость политропного процесса.

9. Изохорный процесс. (V=const)

Изобарный процесс. (Р=const)

Изохорный процесс — это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Из определения работы следует, что изменение работы при изохорном процессе равна:

Чтобы определить полную работу процесса проинтегрируем данное выражение. Поскольку объем неизменен, то:
 ,
,
Но такой интеграл равен нулю. Итак, при изохорном процессе газ работы не совершает:
 .
.
Графически доказать это намного проще. С математической точки зрения, работа процесса — это площадь под графиком. Но график изохорного процесса является перпендикуляром к оси абсцисс. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле:
 ,
,
где i — число степеней свободы, которое зависит от количества атомов в молекуле (3 для одноатомной (например, неон), 5 для двухатомной (например, кислород) и 6 для трёхатомной и более (например, молекула водяного пара)).
Из определения и формулы теплоёмкости и, формулу для внутренней энергии можно переписать в виде:
 ,
,
где  — молярная теплоёмкость при постоянном объёме.
— молярная теплоёмкость при постоянном объёме.
Используя первое начало термодинамики можно найти количество теплоты при изохорном процессе:

Но при изохорном процессе газ не выполняет работу. То есть, имеет место равенство:
 ,
,
то есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует:

Выше была выведена формула для определения количества теплоты. Перепишем ее в дифференциальном виде:
 ,
,
где ν — количество вещества,  — молярная теплоемкостью при постоянном объеме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле:
— молярная теплоемкостью при постоянном объеме. Итак, микроскопическое изменение энтропии при изохорном процессе можно определить по формуле:

Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе:

В данном случае выносить выражение молярной теплоемкости при постоянном объеме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — термодинамический процесс, происходящий в системе при постоянном давлении.
Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе  .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV.
Изменение энтропии при квазистатическом изобарном процессе равно  . В случае, если изобарный процесс происходит в идеальном газе, то dU = d(νCvT + νRT) = ν(Cv + R)dT = νCpdT, следовательно, изменение энтропии можно выразить как
. В случае, если изобарный процесс происходит в идеальном газе, то dU = d(νCvT + νRT) = ν(Cv + R)dT = νCpdT, следовательно, изменение энтропии можно выразить как  . Если пренебречь зависимостью Cp от температуры, то
. Если пренебречь зависимостью Cp от температуры, то  .
.
10. Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.

Несколько изотерм для идеального газа нa p-V диаграмме
В идеальном газе при изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах p,V — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (см. рисунок).
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа, совершенная идеальным газом в изотермическом процессе, равна  , где
, где  — число частиц газа,
— число частиц газа,  — температура,
— температура,  и
и  — объём газа в начале и конце процесса,
— объём газа в начале и конце процесса,  — постоянная Больцмана .
— постоянная Больцмана .
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса в идеальном газе записывается в виде:


Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии.
Для адиабатического процесса первое начало термодинамики в силу отсутствия теплообмена (ΔQ = 0) системы со средой имеет вид

где:
-
 — изменение внутренней энергии тела,
— изменение внутренней энергии тела, -
 — работа, совершаемая системой
— работа, совершаемая системой -
 — теплота, полученная системой
— теплота, полученная системой
Основное уравнение термодинамики применительно к адиабатическому процессу записывается в дифференциалах как
 ,
,
где  — дифференциальное выражение для работы, ai — внешние параметры, Ai — соответствующие им внутренние параметры. В частном случае, когда работа совершается через изменение объёма
— дифференциальное выражение для работы, ai — внешние параметры, Ai — соответствующие им внутренние параметры. В частном случае, когда работа совершается через изменение объёма
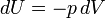 , где p — давление.
, где p — давление.
Энтропия системы в адиабатическом процессе не меняется:
 .
.
11. Изохорный процесс. (V=const)

Изобарный процесс. (Р=const)

Изотермический процесс. (T=const)

Изоэнтропийный процесс (Q=const)

Адиабатный процесс(ΔQ = 0)

график адиабаты (жирная линия) на  диаграмме для газа.
диаграмме для газа.
p — давление газа;
V — объём.
13. Истечение паров, жидкостей и газов.
Процесс истечения – процесс переноса вещества из области с одним давлением в область с другим.
Действительный процесс истечения характеризуется необратимыми потерями и неравномерностью распределения скоростей в потоке. В теории истечение рассматривается, как обратимый процесс, а переход к реальным характеристикам осуществляется с помощью двух коэффициентов: коэффициента скорости - 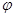 и коэффициента расхода -
и коэффициента расхода - 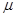 , причём эти коэффициенты определяются экспериментальным путём. Оба коэффициента показывают различия между теоретическими и действительными величинами.
, причём эти коэффициенты определяются экспериментальным путём. Оба коэффициента показывают различия между теоретическими и действительными величинами.
Нас интересуют следующие величины:
1. Линейная скорость -  ,
,  .
.
2. Массовая скорость -  ,
,  .
.
3. Массовый расход -  ,
,  .
.
Задача решается на базе следующих уравнений:
1. Первое начало термодинамики:  .
.
2. Уравнение процесса:
a. Политропный процесс:  .
.
b. Адиабатный процесс:  .
.
3. Уравнение неразрывности в интегральном виде:  .
.
4. Уравнение состояние.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...