
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Раздел 2. Приобретение компетенций и закрепление навыков
САМОСТОЯТЕЛЬНАЯ РАБОТА № 2 по ХИМИИ
Раздел 1. Обучающие примеры с алгоритмами решения по теме
«Энергетические эффекты химических процессов. Термохимические расчёты»
Пример 1. Вычисление энтальпий образования веществ и тепловых эффектов химических процессов
1.Стандартная энтальпия образования газообразного озона равна 142,3 кДж/моль. Укажите, в какой из перечисленных ниже реакций тепловой эффект ΔH0обр будет соответствовать стандартной энтальпии образования О3(г):
а) 3О(г) = О3(г); б) 1,5О2(г) = О3(г); в) О2(ж) + О(г) = О3(г); г) 2О2(г) = О(г) + О3(г).
Напишите термохимическое уравнение этого процесса.
Решение. По определению, ΔH0 показывает тепловой эффект реакции образования 1 моль вещества О3(г) прямым синтезом из простых веществ, устойчивых при 298К и давлении 101кПа. Случай г) не подходит под данное определение, т.к. не соответствует реакции синтеза. Случай в) не отвечает требованию стандартных условий, т.к. при 298К и давлении 101кПа кислород не может находиться в жидком состоянии. Случай а) также должен быть исключен, т.к. атомарный кислород О(г) не является устойчивой формой существования простого вещества кислорода. Таким образом, требованиям определения соответствует только реакция б). Термохимическое уравнение будет выглядеть следующим образом:
О2(г) + ½О2(г) = О3(г); ΔH0обр[О3(г)] = 142,3 кДж/моль.
Ответ: условиям задачи соответствует уравнение б); ΔH0обр[О3(г)] = 142,3 кДж/моль.
2. При сгорании кальция массой 8г количество выделившейся энергии составило 127кДж. Составьте термохимическое уравнение этой реакции.
Решение. Составим вначале химическое уравнение реакции горения металла в кислороде: 2Са + О2 = 2СаО. Термохимическое уравнение отличается от химического тем, что в нем указаны агрегатные состояния реагентов и продуктов, а также тепловой эффект процесса. Следовательно, нашему случаю будет соответствовать термохимическое уравнение следующего вида:
2Са(т) + О2(г) = 2СаО(т), ΔH = Х кДж.
В этом уравнении искомому тепловому эффекту соответствуют 2 моль кальция.
А по условию задачи, в реакцию вступили 8 г кальция, что соответствует количеству вещества nСа = m(Ca)/M(Ca); nCa = 8г/40г/моль = 0,2 моль. Вычисляем количество энергии, которое выделится при сгорании 2 моль кальция, используя пропорцию: 0,2 моль Са ― –127 кДж
2 моль Са ― Х кДж Х = 2моль·(–127кДж)/0,2моль = –1270кДж.
Таким образом, при сгорании 2 моль металлического кальция выделяется 1270 кДж энергии.
Ответ: 2Са(т) + О2(г) = 2СаО(т), ΔH = –1270 кДж.
3.Вычислите стандартную энтальпиюобразования бензола С6Н6(ж), если энтальпии сгорания водорода, углерода и бензола равны соответственно (кДж/моль):
-285,84; -393,51; -3267,70.
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить. Образование бензола из простых веществ можно представить следующим термохимическим уравнением:
6С(т) + 3Н2(г) = С6Н6(ж), ΔH0обр[С6Н6(ж)]=Х кДж/моль.
Для определения энтальпии образования бензола составим цикл Гесса, используя данные задачи:
Н2(г) + ½О2(г) = Н2О(ж), ΔH01 = -285,84 кДж/моль; (1)
С(т) + О2(г) = СО2(г), ΔH02 = -393,51 кДж/моль; (2)
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(ж), ΔH03 = -3267,70 кДж/моль. (3)
Чтобы получить искомое уравнение образования бензола из простых веществ, достаточно сложить в цикле Гесса уравнения (1) и (2), умножив их на соответствующие коэффициенты 3 и 6, и вычесть из них уравнение (3):
3Н2(г)+3/2О2(г)+6С(т)+6О2(г)-С6Н6(ж)-15/2О2(г) =3Н2О(ж)+6СО2(г)-6СО2(г)-3Н2О(ж).
Сократим однородные члены и перенесем -С6Н6(ж) в правую часть равенства с противоположным знаком. Получим искомое уравнение: 6С(т) + 3Н2(г) = С6Н6(ж).
Аналогичные действия проделаем с тепловыми эффектами:
ΔH0обр[С6Н6(ж)] = 3ΔH01 + 6ΔH02 – ΔH03,
ΔH0обр[С6Н6(ж)] =3·(-285,84) кДж/моль + 6·(-393,51) кДж/моль – (-3267,70) кДж/моль =
(-857,52 -2361,06 + 3267,70) кДж/моль = 49,12 кДж/моль.
Ответ: ΔH0обр[С6Н6(ж)]=49,12 кДж/моль.
4.Используя значение стандартных энтальпий образования участников химического процесса, определите количество энергии, выделяющейся при восстановлении оксидом углерода 100кг диоксида свинца до оксида с образованием диоксида углерода.
Решение. Запишем термохимическое уравнение реакции, тепловой эффект которой необходимо определить:
PbO2(т) + CO(г) = PbO(т) + CO2(г), ΔH0 = Х кДж/моль.
Согласно 3-му следствию из закона Гесса, тепловой эффект процесса определяется по разности сумм энтальпий образования продуктов и реагентов. Используя данные таблицы 1 Приложения, найдем значения искомых энтальпий (кДж/моль):
ΔH0обр[PbO2(т)] = -276,86; ΔH0обр[CO(г)] = -110,50; ΔH0обр[PbO(т)] = - 217,86;
ΔH0обр[CO2(г)] = -393,51.
Составим цикл Гесса для расчета теплового эффекта реакции восстановления диоксида свинца монооксидом углерода:
ΔH0 = {ΔH0обр[PbO(т)] + ΔH0обр[CO2(г)]} – {ΔH0обр[PbO2(т)] + ΔH0обр[CO(г)]}
и, подставив известные значения, рассчитаем его:
ΔH0 = [(- 217,86) кДж/моль + (-393,51) кДж/моль] – [(-276,86) кДж/моль + (-110,50) кДж/моль] = -224,01 кДж/моль.
Расчеты показали, что при восстановлении 1 моля PbO2 выделяется 224,01 кДж энергии. Определим, какой массе диоксида свинца соответствует это количество вещества:
m(PbO2) = n·M(PbO2) = 1моль·(207 + 2·16)г/моль = 239г.
Теперь вычислим количество энергии, которое выделится при сгорании 100кг PbO2, используя пропорцию:
239·10-3кг ― -224,01 кДж
100кг ― Х кДж, Х =  = -93728 кДж.
= -93728 кДж.
Ответ: при восстановлении 100кг диоксида свинца выделяется 93728 кДж энергии.
5.Энергия связи С―Н в метане равна 435 кДж/моль, связи С―Cl в хлорметане – 350 кДж/моль. Зная, что ЕCl―Cl = 240 кДж/моль, а ЕH―Cl = 430 кДж/моль, рассчитайте тепловой эффект (ΔH0) реакции: CH4 + Cl2 → CH3Cl + HCl.
Решение. Энтальпии образования химических веществ можно рассчитать по энергиям связей, которые в этих веществах образуются. Например, в молекуле метана образуется 4 ковалентные связи С―Н, следовательно,
ΔH0обр(СН4) = 4·[EC―H], и ΔH0обр(СН4) = 4·435 кДж/моль = 1740 кДж/моль. Аналогичные расчеты проведем и для всех остальных молекул:
ΔH0обр(Сl2) = 3·[ЕCl―Cl] = 3·240 кДж/моль = 720 кДж/моль (см. теорию образования дативной связи, в молекуле Cl2 – тройная связь);
ΔH0обр(HCl) = ЕH―Cl = 430 кДж/моль;
ΔH0обр(СН3Cl) = 3·[EC―H] + EC―Cl = 3·435 кДж/моль + 350 кДж/моль = 1655 кДж/моль.
Теперь по 3-му следствию из закона Гесса рассчитаем тепловой эффект искомой реакции: ΔH0 = [ΔH0обр(СН3Cl) + ΔH0обр(HCl)] - [ΔH0обр(СН4) + ΔH0обр(Сl2)] и
ΔH0 = (1655 + 430) – (1740 + 720) кДж/моль = -375 кДж/моль.
Ответ: тепловой эффект экзотермического процесса хлорирования метана с образованием хлорметана равен ΔH0 = -375 кДж/моль.
Пример 2. Определение взаимосвязи между внутренней энергией и энтальпией термодинамических процессов
1.Изменение внутренней энергии системы Fe(т) + Cl2(г) = FeCl2(т) равно -334,0 кДж. Определите тепловой эффект этой реакции при стандартных условиях.
Решение. Согласно первому закону термодинамики, тепловой эффект химической реакции при постоянной температуре ΔHT связан с изменением внутренней энергии системы ΔU уравнением ΔHT = ΔU ± RTΔn. В этом уравнении изменение количества вещества Δn определяется только по веществам, находящимся в наименее конденсированной фазе, в нашем случае – в газообразной фазе. Поскольку в продуктах реакции нет газообразных веществ, то Δn = 0 – 1моль(Cl2) = -1моль.
В стандартных условиях Т0 = 298 К, R = 8,31·10-3 кДж/моль·К. Подставив эти и найденное значения в уравнение для ΔH0Т, найдем тепловой эффект реакции синтеза железа (2) хлорида:
ΔH0х.р. = -334 кДж – (8,31·10-3 кДж/моль·К)·298 К·1 моль = -336,5 кДж.
Ответ: ΔH0х.р. = -336,5 кДж.
2.Вычислите изменение внутренней энергии при испарении 50г этилового спирта при температуре кипения, если удельная теплота испарения его равна 857,7 Дж/г, а удельный объем пара при температуре кипения равен 607·10-3 л/г. Объемом жидкости можно пренебречь.
Решение. Процесс испарения (переход жидкого вещества в газообразное состояние) является физическим, он происходит при постоянном давлении и постоянной температуре (если вещество химически чистое). Для такого процесса (происходящего, как правило, при постоянном давлении) связь между изменением полной ΔHP и внутренней ΔU энергии термодинамической системы, согласно первому закону термодинамики, подчиняется уравнению ΔHP = ΔU ± PΔV. Поскольку при этом объем системы увеличивается, то ΔV > 0 и уравнение упрощается: ΔHP = ΔU + PΔV.
Изменение объема системы ΔV будет равно объему образовавшегося пара, с учетом условия задачи. Если удельный объем газообразного спирта v при температуре кипения равен 607·10-3 л/г, то изменение объема при парообразовании 50 г спирта легко вычислить по уравнению ΔV=v·m; ΔV = 607·10-3(л/г)·50(г) = 3035·10-2(л) = 30,35 л.
Энтальпийный эффект ΔH0 при фазовом переходе в стандартных условиях определяется по формуле ΔH0=L·m, где L – удельная теплота парообразования. Подставив значения из условия задачи, произведём соответствующие расчеты ΔH0:
ΔH0= 857,7(Дж/г)·50(г) = 42885 Дж = 42885кПа·л.
Преобразовав термодинамическое уравнение для ΔH0 относительно ΔU0, и решив его, получим: ΔU0 = ΔH0 - PΔV; ΔU0 = 42885кПа·л – 101кПа·30,35л = 39820кПа·л = 39820Дж = 39,82кДж.
Ответ: внутренняя энергия термодинамической системы увеличилась на 39,82кДж.
3. Вычислите тепловой эффект и изменение внутренней энергии реакционной системы при восстановлении оксида железа (2) водородом, если известны тепловые эффекты следующих реакций: FeO(т) + CO(г) = Fe(т) + CO2(г), ΔH1 = - 13,18 кДж; (1)
СО(г) + ½О2(г) = СО2(г), ΔH2 = -283,00 кДж; (2)
Н2(г) + ½О2(г) = Н2О(г), ΔH3 = -241,83 кДж (3).
Решение. Согласно закону Гесса, для получения нужного уравнения реакции можно производить арифметические действия с данными в задаче уравнениями. То же можно совершать и с тепловыми эффектами.
Следовательно, чтобы получить уравнение
FeO(т) + Н2(г) = Fe(т) + Н2О(г), ΔH = Х кДж,
нужно суммировать уравнения (1) и (3) и вычесть из этой суммы уравнение (2). То же действие мы совершаем и с тепловыми эффектами. Тогда тепловой эффект реакции восстановления оксида железа (2) водородом определится по формуле:
ΔH = ΔH1 + ΔH3 - ΔH2.
Подставив в эту формулу известные значения и произведя расчеты, получим:
ΔH = - 13,18 кДж + (-241,83 кДж) – (-283,00 кДж) = 27,99кДж.
Для определения изменения внутренней энергии системы при заданном процессе применим первый закон термодинамики ΔH = ΔU ± RTΔn. Расчет изменения количества вещества газообразных продуктов после (Н2О) и до (Н2) реакции показывают, что Δn = 0. Тогда уравнение, связывающее ΔU и ΔH упрощается: ΔH = ΔU. А это означает, что процесс восстановления является эндотермическим и при этом внутренняя энергия системы увеличивается на 27,99 кДж.
Ответ: ΔH = ΔU = 27,99 кДж.
4.Внутренняя энергия при испарении 90 г воды при 1000 С возросла на 188,1 кДж. Удельный объем водяного пара равен 1,699 л/г, давление 1,01·105 Па. Определите теплоту парообразования воды (кДж/моль).
Решение. Для процесса парообразования
Н2О(ж) <=> Н2О(г), ΔH = Х кДж/моль,
связь между теплотой парообразования ΔH и изменением внутренней энергии ΔU системы при постоянном давлении (Р = Const) выражается уравнением ΔH = ΔU ± PΔV, где ΔV = VН2О(г) – VН2О(ж) > 0, т.к. VН2О(г)> VН2О(ж). С учетом этого вывода, уравнение упростится: ΔH = ΔU + PΔV.
Зная удельный объём водяного пара при заданных условиях (v) и массу воды (m) найдем: VН2О(г) = vm; VН2О(г) = 1,699(л/г)·90(г) = 152,91 л. Поскольку плотность жидкой воды также известна (ρН2О(ж) = 1·10-3г/л), найдем объем жидкой воды по формуле
VН2О(ж) = ρm и VН2О(ж) = 1·10-3(г/л)·90(г) = 0,09 л.
С учетом этих величин, изменение объема при испарении 90 г воды ΔV составит:
ΔV = 152,91л – 0,09л = 152,82л.
Подставив найденное значение ΔV, а также данные условия задачи в выражение для ΔH определим теплоту испарения 90г воды:
ΔHP = 188,1 кДж + 1,01·105(10-3 кПа)·152,82(10-3 м3) = 188,1 кДж + 15,43 кДж = 203,53 кДж.
В расчете на 1 моль образующегося пара эта величина составит: ΔH = ΔHP·M/m, где М – молярная масса воды. Тогда ΔH =  = 40,71 кДж/моль.
= 40,71 кДж/моль.
Ответ: Теплота парообразования воды при температуре её кипения составляет 40,71 кДж/моль.
5.Растворение 130 г металлического цинка в разбавленной серной кислоте при 200С сопровождается выделением 286,2 кДж энергии. Выделяющийся при этом газообразный водород совершает работу против внешнего давления. Определите изменение внутренней энергии этого процесса.
Решение. Для химической реакции Zn + H2SO4 = ZnSO4 + H2↑
связь между тепловым эффектом процесса (ΔH) и изменением внутренней энергии системы (ΔU) подчиняется уравнению первого закона термодинамики ΔH = ΔU ± RTΔn. Поскольку в этом процессе работа совершается над окружающей средой, значит, внутренняя энергия системы уменьшается, т.е.
ΔH = ΔU – RTΔn или ΔU = ΔH + RTΔn.
В этом уравнении Δn соответствует количеству вещества выделившегося газообразного водорода nН2, определяемого по количеству вещества вступившего в реакцию с кислотой металлического цинка nZn. И тогда nН2 = nZn = mZn/MZn, где m и M – масса и молярная масса цинка, соответственно. Произведя расчеты, получим:
nН2 = 130(г)/65(г/моль) = 2моль. Следовательно, Δn = 2 моль.
Теперь рассчитаем изменение внутренней энергии процесса, помня о том, что в экзотермических процессах ΔH < 0, т.е. ΔH = -286,2 кДж; Т = 273 + 20 = 293 К;
R = 8,31·10-3 кДж/моль·К. И тогда:
ΔU = -286,2 кДж + 8,31·10-3(кДж/моль·К)·293 К·2 моль = -281,3 кДж.
Ответ: во время реакции внутренняя энергия системы уменьшится на 281,3 кДж.
Пример 3. Вычисление энтропии, её связи с энтальпией химического процесса
И температурой
1.Удельная теплота испарения бромбензола при температуре 156,80 С равна 241,0 Дж/г. Определите изменение энтропии фазового перехода при испарении 1,25 моль бромбензола.
Решение. Изменение энтропии в равновесном процессе перехода вещества из одного агрегатного состояния в другое определяется по второму закону термодинамики как
ΔS =  , где ΔH – теплота испарения (или энтальпия процесса фазового перехода из жидкого состояния в газообразное), Т – температура фазового перехода.
, где ΔH – теплота испарения (или энтальпия процесса фазового перехода из жидкого состояния в газообразное), Т – температура фазового перехода.
Для определения теплового эффекта процесса ΔH необходимо вначале рассчитать молярную массу исходного вещества бромбензола С6Н5Br, она будет равна: М(С6Н5Br) = 6·12 + 5·1 + 1·80 = 157 (г/моль). Зная количество вещества бромбензола n, участвующего в фазовом переходе, определяем его массу: m(С6Н5Br) = М·n;
m(С6Н5Br) = 157 г/моль·1,25 моль = 196,25 г.
Для данной массы вещества, с учетом удельной теплоты испарения (L), рассчитаем тепловой эффект процесса по формуле: ΔH = L·m, ΔH = 241(Дж/г)·196,25 (г) = 47296,25 Дж.
Температура фазового перехода Т = t0C + 273 = 156,8 + 273 = 429,8 К.
Подставив полученные значения в уравнение 2-го закона термодинамики, получим:
ΔS =  = 110,04
= 110,04  .
.
Ответ: при испарении 1,25 моль бромбензола энтропия системы возрастает на 110,04 Дж/К.
2.Определите изменение энтропии в стандартных условиях для следующего химического процесса: Al(к)+ Cr2O3(к) → Cr(к) + Al2O3(к).
Решение. Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции.
Учитывая это обстоятельство, схему процесса необходимо привести к химическому уравнению, расставив соответствующие коэффициенты. Тогда получим:
2Al(к)+ Cr2O3(к) = 2Cr(к) + Al2O3(к).
Для этой реакции составим уравнение расчета изменения энтропии в стандартных условиях: ΔS0 = [2·S0Cr(к) + S0Al2O3(к)] – [2·S0Al(к) + S0Cr2O3(к)].
По данным таблицы Приложения №7 установим значения энтропий (S0) участников процесса (Дж/моль·К):
S0Al(к) = 28,32; S0Cr2O3(к) = 81,10; S0Cr(к) = 23,76; S0Al2O3(к) = 50,94.
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим: ΔS0 = (2·23,76 + 50,94) – (2·28,32 + 81,10) = -39,28 (Дж/моль·К).
Заметим при этом, что отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Ответ: ΔS0 = -39,28 Дж/моль·К. При стандартных условиях такой процесс невозможен.
3.Реакция разложения магния нитрата по уравнению
2Mg(NO3)2(т) = 2MgO(т) + 4NO2(г) + O2(г)
сопровождается увеличением энтропии системы на 891 Дж/К и изменением энтальпии на 510 кДж. Рассчитайте стандартную энтальпию образования и энтропию образования магния нитрата. Определите, какой из факторов – энтальпийный или энтропийный – способствует самопроизвольному протеканию этого процесса.
Решение. Расчеты ΔH0обр[Mg(NO3)2(т)] и S0обр[Mg(NO3)2(т)] произведем на основании 3-го следствия из закона Гесса, согласно которому:
а) ΔH0х.р. = 2·ΔH0обр[MgO(т)] + 4·ΔH0обр[NO2(г)] - 2·ΔH0обр[Mg(NO3)2(т)];
отсюда ΔH0обр[Mg(NO3)2(т)] = ΔH0обр[MgO(т)] + 2·ΔH0обр[NO2(г)] -½ΔH0х.р.
б) ΔS0х.р. = 2·S0обр[MgO(т)] + 4·S0обр[NO2(г)] + S0обр[O2(г)]- 2·S0обр[Mg(NO3)2(т)]; отсюда S0обр[Mg(NO3)2(т)] = S0обр[MgO(т)] + 2·S0обр[NO2(г)] + ½ S0обр[O2(г)] - ½ ΔS0х.р.
Используя данные таблицы Приложения № 1, найдем значения энтальпий образования и энтропий продуктов реакции:
ΔH0обр[MgO(т)] = -601,24 кДж/моль; ΔH0обр[NO2(г)] = 33,50 кДж/моль; S0обр[MgO(т)] = 26,94 Дж/моль·К; S0обр[NO2(г)] = 240,45 Дж/моль·К; S0обр[O2(г)] = 205,04 Дж/моль·К.
Подставив найденные значения в уравнения а) и б), рассчитаем искомые величины:
ΔH0обр[Mg(NO3)2(т)] = 1моль·(-601,24кДж/моль) + 2 моль·33,50кДж/моль -½(510кДж) =
= - 789,24 кДж;
S0обр[Mg(NO3)2(т)] = 1моль·26,94Дж/моль·К + 2моль·240,45Дж/моль·К + ½моль·205,04 Дж/моль·К - ½·891 Дж/К = -164,87 Дж/К.
Как известно, самопроизвольному протеканию реакции способствует уменьшение её энтальпийного фактора (ΔH0х.р.< 0) и увеличение энтропийного фактора (Т·ΔS0х.р. > 0). Согласно данным условия задачи, энтропия во время процесса возрастает, и, следовательно, возрастает и произведение Т·ΔS0х.р., что способствует его самопроизвольному протеканию. С другой стороны, возрастает и энтальпия реакции, что не способствует самопроизвольности процесса в прямом направлении.
Ответ: ΔH0обр[Mg(NO3)2(т)] = - 789,24 кДж; S0обр[Mg(NO3)2(т)] = -164,87 Дж/К. Самопроизвольности процесса разложения магния нитрата способствует энтропийный фактор этой реакции.
4. При плавлении 100 г меди энтропия системы увеличивается на 1,28 Дж/К. Рассчитайте удельную теплоту плавления меди при температуре 10830С.
Решение. Между удельной теплотой (L, Дж/кг) и энтальпией плавления (ΔH, Дж) существует соотношение L = ΔH/m. Связь между энтальпией процесса и изменением его энтропии выражается уравнением 2-го закона термодинамики ΔH = Т·ΔS. Объединив два выражения, получим:
L =  .
.
Подставим в найденное соотношение данные из условия задачи, произведем соответствующие расчеты и получим:
L = 
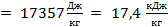 .
.
Ответ: удельная теплота плавления меди равна 17,4  .
.
5. Реакция горения ацетилена протекает по уравнению
С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж).
Вычислите изменение энтропии системы в стандартных условиях и объясните причины её уменьшения.
Решение. Согласно следствию из закона Гесса, изменение энтропии определяется как разность сумм энтропий продуктов и реагентов процесса с учетом стехиометрических коэффициентов реакции. Тогда
ΔS0х.р. = [2·S0обрСО2(г) + S0обрН2О(ж)] – [S0обрС2Н2(г) + (5/2)·S0обрО2(г)].
В таблице Приложения № 1 найдем значения требуемых энтропий:
S0обрСО2(г) = 213,65Дж/моль·К; S0обрН2О(ж) = 69,94Дж/моль·К; S0обрС2Н2(г) = 219,45Дж/моль·К; S0обрО2(г) = 205,03Дж/моль·К.
Подставив эти значения в уравнение изменения энтропии процесса, и произведя расчеты, получим:
ΔS0х.р. = (2·213,65 + 69,94 - 219,45 – (5/2)·205,03)Дж/моль·К = -234,79 Дж/моль·К.
Уменьшение энтропии процесса объясняется ростом упорядоченности системы, так как количество вещества газов в продуктах реакции в 2,7 раза меньше, чем в реагентах (5,5/2).
Ответ: ΔS0х.р. = -234,79 Дж/моль·К; ΔS0х.р<0 т.к. Δn(г) < 0.
Пример 4. Вычисление изменения энергии Гиббса, определение направления
Химического процесса
1. Восстановление природного минерала магнетита Fe3O4 оксидом углерода (2) осуществляется в производственных условиях по реакции
Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г).
Определите изменение энергии Гиббса и сделайте вывод о возможности самопроизвольного протекания этого процесса при стандартных условиях.
Решение. Изобарно-изотермический потенциал термодинамической системы или энергия Гиббса G отражает общую движущую силу процесса, т.е. обозначает ту часть полной энергии системы (Н), которая полностью и без остатка может превратиться в полезную работу (собственно химический процесс). Изменение энергии Гиббса ΔG (при Т = Const и P = Const) в сторону её уменьшения (ΔG < 0) указывает на меру химической активности системы: чем больше |ΔG|, тем сильнее стремление к протеканию процесса и тем дальше он отстоит от состояния равновесия. Энергия Гиббса является функцией состояния и поэтому к ней применим закон Гесса:
ΔGх.р. = ∑ΔGобр(прод) - ∑ΔGобр(реаг).
Применив данное выражение к уравнению процесса восстановления двойного оксида железа Fe3O4 при стандартных условиях, получим:
ΔG0х.р. =[ 3·ΔG0обрFeO(к) + ΔG0обрCO2(г)] – [ΔG0обрFe3O4(к) + ΔG0обрCO(г)].
Используя таблицу Приложения № 1, установим значения ΔG0обр продуктов реакции и реагентов:
ΔG0обрFeO(к) = -244,3 кДж/моль; ΔG0обрCO2(г) = -394,38 кДж/моль; ΔG0обрFe3O4(к) = -1014,20 кДж/моль; ΔG0обрCO(г) = -137,27 кДж/моль.
Подставив найденные значения в выражение для ΔG0х.р. и произведя расчеты, получим:
ΔG0х.р. = [3·(-244,3) + (-394,38)] – [(-1014,20) + (-137,27)] = 24,19 (кДж/моль).
Расчеты показали, что ΔG0х.р.> 0, это означает невозможность протекания данного процесса при стандартных условиях.
Ответ: при стандартных условиях процесс самопроизвольного восстановления двуоксида железа оксидом углерода (2) неосуществим, т.к. ΔG0х.р.> 0.
2.Объясните, почему при стандартных условиях не протекает экзотермическая реакция Н2(г) + СО2(г) = СО(г) + Н2О(ж), ΔH1 = -2,85 кДж/моль; но протекает реакция
2NO(г) + O2(г) = 2NO2(г), ΔH2 = -113,74 кДж/моль.
Решение. Согласно первому закону термодинамики связь между энтальпией и энергией Гиббса химического процесса выражается уравнением: ΔH = ΔG + ТΔS. Отсюда ΔG = ΔH – ТΔS. Рассчитаем изменение энергии Гиббса обоих процессов, используя для расчета изменения энтропий ΔS данные таблицы Приложения № 1.
Для первой реакции получим:
ΔS0х.р.(1) = S0обрСО(г) + S0обрН2О(ж) - S0обрН2(г) - S0обрСО2(г) и
ΔS0х.р.(1) = (197,91 + 69,94 – 130,59 – 213,65) Дж/моль·К = -76,39 Дж/моль·К.
Для второй реакции результат будет следующим:
ΔS0х.р.(2) = 2·S0обрNO2(г) - 2· S0обрNО(г) - S0обрО2(г) и
ΔS0х.р.(2) = (2·240,46 - 2·210,20 – 205,03) Дж/моль·К = -144,51 Дж/моль·К.
Теперь рассчитаем изменение энергии Гиббса при Т = 298К для этих реакций:
ΔG0х.р.(1) = ΔH1 - ТΔS0х.р.(1) и
ΔG0х.р.(1) = -2,85 кДж/моль – 298К·(-76,39·10-3 кДж/моль·К) = 19,91 кДж/моль;
ΔG0х.р.(2) = ΔH2 - ТΔS0х.р.(2) и
ΔG0х.р.(2) = -113,74 кДж/моль – 298К·(-144,51·10-3 кДж/моль·К) = -70,68 кДж/моль.
Как свидетельствуют результаты расчетов, ΔG0х.р.(1) > 0 и, значит, этот процесс самопроизвольно протекать не будет, зато ΔG0х.р.(2) < 0, что свидетельствует о самопроизвольности процесса при стандартных условиях.
Ответ: при стандартных условиях не протекает реакция восстановления диоксида углерода водородом, т.к. для неё ΔG0х.р. > 0, но возможна реакция окисления оксида азота (2) кислородом, сопровождающаяся уменьшением энергии Гиббса ΔG0х.р.(2) < 0.
3. Определите возможность самопроизвольного протекания процесса алюмотермии
Fe2O3(к) + 2Al(к) = Al2O3(к) + 2Fe(к)
при 298К и 500К и стандартном состоянии всех веществ. Установите минимальную температуру, выше которой указанный процесс протекает самопроизвольно.
Решение. Для расчета ΔG0х.р. используем закон Гесса:
ΔG0х.р. = [ΔG0обрAl2O3(к) + 2·ΔG0обрFe(к)] – [ΔG0обрFe2O3(к) +2·ΔG0обрAl(к)].
При этом учтем, что ΔG0обрFe(к) = ΔG0обрAl(к) = 0, а по данным таблицы Приложения № 7 ΔG0обрAl2O3(к) = -1580,00 кДж/моль; ΔG0обрFe2O3(к) = -740,98 кДж/моль. Подставив найденные значения и произведя расчеты, получим:
ΔG0х.р. = [-1580,00 – (-740,98)] кДж/моль = -839,02 кДж/моль.
Для расчета ΔG500х.р. воспользуемся первым законом термодинамики
ΔG500х.р. = ΔH500х.р. – ТΔS500х.р. При этом в соответствии указанию условия задачи (все вещества находятся в стандартном состоянии) используем табличные значения ΔH0 и ΔS0 реагентов и продуктов при 298К:
ΔH0обрAl2O3(к) = -1676,00 кДж/моль; ΔH0обрFe2O3(к) = -822,16 кДж/моль; S0обрAl2O3(к) = 50,94 Дж/моль·К; S0обрFe2O3(к) = 89,96 Дж/моль·К; S0обрAl(к) = 42,69 Дж/моль·К; S0обрFe(к) = 27,15 Дж/моль·К.
Подставим эти значения в выражения для ΔH500х.р. и ΔS500х.р. и произведем расчеты:
ΔH500х.р. = ΔH0обрAl2O3(к) - ΔH0обрFe2O3(к); ΔH500х.р. = [-1676,00 – (-822,16)] кДж/моль = -853,84 кДж/моль.
ΔS500х.р. = [S0обрAl2O3(к) + 2·S0обрFe(к)] – [S0обрFe2O3(к) + 2· S0обрAl(к)]; ΔS500х.р. = (50,94 + 2·27,15) – (89,96 + 2·42,69) Дж/моль·К = -70,10 Дж/моль·К.
Теперь находим ΔG500х.р., выражая ΔS500х.р. в кДж/моль·К:
ΔG500х.р. = [-853,84 - 500·(-70,10·10-3)] кДж/моль = -818,79 кДж/моль.
Чтобы найти минимальную температуру, выше которой процесс протекает самопроизвольно, применим к системе условие Т = 0К и тогда ΔG0х.р. = ΔН0х.р.< 0. Таким образом, даже при отрицательных значениях температуры (а такие значения практически недостижимы) реакция будет протекать самопроизвольно.
Чтобы установить верхний предел температуры, при которой процесс перестает быть самопроизвольным, применим условие состояния химического равновесия: ΔG = 0 и ΔH = ТΔS, откуда Т =  .
.
Подставим в полученное выражение найденные значения ΔH500х.р. и ΔS500х.р. и, произведя расчеты, получим: Т =  = 12180 К.
= 12180 К.
Таким образом, только при очень высокой температуре (Т≥12180 К) процесс алюмотермии невозможен.
Ответ: при 298К и 500К процесс восстановления оксида железа (3) алюминием протекает самопроизвольно, т.к. ΔG298х.р.< 0 и ΔG500х.р.< 0. Самопроизвольность процесса обеспечивается уже при температуре 0К и прекращается при температуре выше 12180К.
4.Определите стандартное изменение энергии Гиббса реакции
COCl2(г) <=> CO(г) + Cl2(г), если при температуре 885К разложилось 70% фосгена, взятого при начальном давлении 100 кПа.
Решение. Если до начала реакции парциальное давление СОСl2(г) было равно Р0 = 100 кПа, за время реакции израсходовано 70% газа, то в момент установления равновесия парциальное давление оставшегося фосгена РравнСОСl2(г) = Р0·0,3 = 30 кПа. Парциальные давления продуктов реакции в состоянии равновесия равны доле израсходованного фосгена, а значит, РравнCO(г) = РравнCl2(г) = Р0·0,7 = 70 кПа.
Согласно закону действующих масс для равновесного процесса
Кравн =  .
.
Подставим в это уравнение найденные значения парциальных равновесных давлений продуктов и реагентов и рассчитаем значение константы равновесия:
Кравн =  = 163,3.
= 163,3.
Теперь, используя уравнение изотермы Вант-Гоффа ΔG0 = –RTlnKp, рассчитаем изменение стандартной энергии Гиббса в состоянии равновесия при заданной температуре:
ΔG0 = (-8,31·885)Дж/моль·ℓn163,3 = -37434 Дж/моль = –37,4 кДж/моль.
Ответ: в состоянии равновесия при стандартных условиях изменение энергии Гиббса реакции ΔG0х.р.= –37,4 кДж/моль.
Термохимические расчёты»
(Трудоемкость задания – 10 баллов)
1. Определите энтальпию образования оксида азота (2), используя следующие термохимические уравнения:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж); ΔH1 = – 1168,80 кДж;
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж); ΔH2 = – 1530,28 кДж.
2.Разложение гремучей ртути (соединения Hg(ONC)2)при взрывесоответствует термохимическому уравнению
Hg(ONC)2(т) = Hg(ж) + 2CO(г) + N2(г), ΔH0 = – 364,2 кДж/моль.
Определите объем образовавшихся газов (н.у.) и количество энергии (ΔH), выделившейся при взрыве 1,5 кг гремучей ртути.
3. Реакция горения метилового спирта выражается термохимическим уравнением
СН3ОН(ж) + 1,5О2(г) = СО2(г) + 2Н2О(ж); ΔΗ = ?
Вычислите тепловой эффект этой реакции и количество энергии, выделяющейся при сгорании 100 мл метилового спирта (ρ = 0,796 г/л).
4. Определите изменение внутренней энергии системы при испарении 100 г жидкого бензола С6Н6 при температуре его кипения (800С), приняв, что пары бензола подчиняются законам идеальных газов. Теплота испарения бензола L = 394 Дж/г. При расчетах объемом жидкости можно пренебречь.
5. Определите тепловой эффект ΔH0х.р. и изменение внутренней энергии ΔU0 при стандартных условиях для системы, в которой происходит реакция гидрирования этина С2Н2 по уравнению
НС≡СН + 2Н2 = Н3С–СН3,
используя следующие значения энергии связей (кДж/моль): ЕС≡С = 811,7; ЕС–С = 347,7; ЕС–Н = 413,4; ЕН–Н = 436,0.
6. Рассчитав значения изменений стандартной энтропии для приведенных ниже реакций, определите, какая из них является термодинамически возможной в изолированной системе:
а) 4Н2О(г) + 3Fe(т) = 4Н2(г) + Fе3O4(т);
б) Al2(SO4)3(т) = Al2O3(т) + 3SO3(г).
7.Реакция восстановления оксида железа (3) водородом протекает по уравнению
Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г); ΔH = 96,61 кДж/моль.
Определите, возможна ли эта реакция при стандартных условиях, если изменение энтропии ΔS0х.р. = 0,1387 кДж/моль·К. Рассчитайте, при какой температуре начнётся восстановление оксида железа (3).
8.По значениямΔG0298 для приведенных ниже реакций определите более устойчивую степень окисления свинца и селена:
а) PbO2(т) + Pb(т) = 2PbO(т);
б) 2SeO2(т) + O2(г) = 2SeO3(т).
9. Определите, при какой температуре (298 или 473 К) термодинамически выгоднее проводить следующую реакцию:
Са(ОН)2(т) + 2СО2(г) = Са(НСО3)2(т),
если ΔG0298 = – 467 кДж/моль, а ΔG0473 = – 405 кДж/моль. Зависимостью ΔS0 от температуры можно пренебречь.
10. Рассчитайте стандартное изменение энергии Гиббса в реакции
АВ(г) = А(г) + В(г)
при температуре 660 К, если начальное количество вещества АВ в замкнутом объеме 10 л составляло 1,7 моль, а к моменту равновесия в системе образовалось по 0,6 моль веществ А и В.
Б) Домашнее задание № 2 для закрепления знаний теоретического материала
Термохимические расчёты»
Следует выбрать одно из трех предлагаемых заданий, их трудоемкость в
балльной оценке указана в скобках.
1. Проведите полный анализ следующих термодинамических систем, определите условия изменения их характеристических функций:
а) Вселенная; б) Солнечная система; в) доменная печь во время плавки;
г) саркофаг IV (аварийного) блока Чернобыльской АЭС;
д) химическая колба с взаимодействующими веществами.
(Трудоемкость – 7 баллов)
2. Приведите примеры конкретных экзотермических и эндотермических процессов (по 5 каждого типа) и обоснуйте, какие из них и при каких условиях могут быть обратимыми. (Трудоемкость – 3 балла)
3. Чем отличаются по своей природе свободная энергия Гиббса (ΔG) и свободная энергия Гельмгольца (ΔF)? Приведите конкретные примеры их взаимодействия с эн
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...