
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Рівновага у слабких електролітах
Можна сказати, що електроліти - це речовини, в яких в помітною концентрації присутні іони, що зумовлюють проходження електричного струму (іонну провідність). Електроліти також мають назву провідників другого роду.
У вузькому сенсі слова електроліти - речовини, молекули яких у розчині, внаслідок електролітичної дисоціації, розпадаються на іони. Серед електролітів розрізняють тверді, розчини електролітів і іонні розплави. Розчини електролітів часто також називають електроліти. Залежно від виду розчинника електроліти діляться на водні та електроліти неводні. До особливого класу належать високомолекулярні електроліти - поліелектроліти.
У відповідності з природою іонів, що утворюються при електролітичної дисоціації водних розчинів, виділяють сольові електроліти (у них відсутні іони Н + і ОН -), кислоти (переважають іони Н +) і основи (переважають іони ОН -). Якщо при дисоціації молекул електролітів число катіонів збігається з числом аніонів, то такі електроліти називають симетричними (1,1 - валентними, наприклад, КС l, 2,2-валентними, наприклад, CaSO 4, і т.д.). В іншому випадку електроліти називають несиметричними (1,2-валентні електроліти, напр. H 2 SO 4, 3,1-валентні, наприклад, А1 (ОН) 3, і т.д.). Залежно від здатності до електролітичної дисоціації електроліти умовно поділяють на сильні і слабкі. Слабкі електроліти характеризуються, перш за все, константою та ступенем дисоціації, а сильні активністю іонів.
Молекули слабких електролітів лише частково дисоційований на іони, які знаходяться у динамічній рівновазі з недіссоціірующімі молекулами. До слабких електролітів відносяться багато органічні кислоти і підстави у водних і неводних розчинниках. Ступінь дисоціації залежить від природи розчинника, концентрації розчину, температури та інших факторів (<1). Один і той же електроліт при однаковій концентрації, але в різних розчинниках утворює розчини з різним ступенем дисоціації. У розчинах слабких електролітів встановлюється рівновага між недиссоциированной молекулами та продуктами їх дисоціації - іонами. Наприклад, у водному розчині оцтової кислоти встановлюється рівновага
 СН з СООН Н + + СН 3 СОО -
СН з СООН Н + + СН 3 СОО -
константа якого (константа дисоціації) пов'язана з концентраціями відповідних часток співвідношенням:
К = [н +] [сн 3 спо -]
[Сн 3 спо]
Ступенем дисоціації а електроліту називається частка його молекул, які зазнали дисоціації, тобто відношення числа молекул, що розпалися у цьому розчині на іони, до загального числа молекул електроліту в розчині.
Константа дисоціації в хімії та біохімії — специфічний тип константи рівноваги, що описує схильність хімічного об'єкта оборотно розпадатися на компоненти, наприклад, дисоціації комплексу на окремі молекули в його складі або розпаду солі на іони. Константа дисоціації позначається  і є зворотною величиною доконстанти спорідненості. У випадку солей константа дисоціації може називатися константою іонізації. Це фізична величина, що характеризується відношенням добутку рівноважних концентрацій дисоційованих іонів до рівноважної концентрації недисоційованих молекул. Kd не виникає для сильних електролітів.
і є зворотною величиною доконстанти спорідненості. У випадку солей константа дисоціації може називатися константою іонізації. Це фізична величина, що характеризується відношенням добутку рівноважних концентрацій дисоційованих іонів до рівноважної концентрації недисоційованих молекул. Kd не виникає для сильних електролітів.
Для загальної реакції дисоціації:

де комплекс  розпадається на x субодиниць A і y субодиниць B, константа дисоціації визначається як
розпадається на x субодиниць A і y субодиниць B, константа дисоціації визначається як

де [A], [B] і [AxBy] — концентрації A, B і комплексу AxBy, відповідно.
Закон Оствальда

Де К — константа дисоціації електроліту, с — концентрація, λ і λ∞ — значення еквівалентної електропровідності відповідно при концентрації  і при нескінченному розведенні. Це співвідношення є наслідком закону діючих мас і рівності
і при нескінченному розведенні. Це співвідношення є наслідком закону діючих мас і рівності
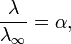
де α — ступінь дисоціації.
Закон розбавлення Оствальда виведений В. Оствальдом у 1888 і ним же підтверджений дослідним шляхом. Експериментальне встановлення правильності закону розведення Оствальда мало велике значення для обгрунтування теорії електролітичної дисоціації.
Іо́нний хімі́чний зв'язо́к, також йонний хімічний зв'язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Характерний для сполук металів з найтиповішими неметалами.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу є кам'яна сіль NaCl. До йонних кристалів належать також численні оксиди (MgO).
На відміну від ковалентного, іонний зв'язок не є направленим, тому валентні кути в сполуках з іонними зв'язками можуть коливатися в широких межах. Йонні зв'язки не характеризуються властивістю насичення, а кулонівські сили, які в них відіграють основну роль, діють на далеких віддалях, спадаючи дуже повільно. Тому при розрахунках енергії взаємодії неможливо обмежитися найближчими сусідами атомів. Будова йонних сполук.Усі йонні сполуки за звичайних умов є,як правило кристалічними речовинами. Йони сполучаються один з одним досить міцно.Для того щоб зруйнувати йонний звязок необхідно затратити чималу енергію.Під час плавлення кристали руйнуються,звязки між йонами відокремлюються один від одного і вилітають із рідини.
· Ковалентний зв'язок
· Металічний зв'язок
Гідроліз — реакція обмінного розкладу між речовиною й водою, один із видів сольволізу. При гідролізі солей утворюються кислоти та луги. Органічні сполуки гідролізуються в присутності кислот (кислотний гідроліз) або лугів (лужний гідроліз). Гідролізу піддаються частіше за все з'єднання вуглецю з галогенами.
Кислотність
1. Кислотність сполук — властивість хімічної сполуки виступати донором протонів і кількісно характеризується константою дисоціації в даному середовищі(Див.:Водневий показник)
2. Кислотність середовища — здатність протонувати стандартні основи. Кількісно виражається функцією кислотності.
Окисно-відновна реакція — хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...