
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Системи із замкнутою системою спряження
Серед циклічних спряжених систем найбільший інтерес викликає група сполук, відмінною рисою яких є підвищена термодинамічна стійкість порівняно зі спряженими відкритими системами. Ці сполуки мають й інші особливі властивості, сукупність яких визначається загальним поняттям ароматичність.
До них насамперед належить здатність таких формально ненасичених сполук вступати в реакції заміщення, а не приєднання, стійкість до дії окисників і температури. Цикли цих систем за хімічною будовою можуть бути тільки вуглецевими (арени і їх похідні) або містити ще гетероатоми (гетероциклічні сполуки), і в них може здійснюватися як π,π-, так і
р,π- спряження.
Арени та їх похідні. Особливості електронної будови ароматичних вуглеводнів (аренів) найбільш наглядно проявляються в атомно-орбітальній моделі бензолу. Каркас бензолу утворюють шість sp2-гібридизованих атомів вуглецю. Усі σ-зв'язки (С―С та С―Н) лежать в одній площині. Шість негібридизованих р-АО розташовані перпендикулярно до площини молекули і паралельно одна одній (рис.1.8, а).
Кожна р-АО однаковою мірою може перекриватися з двома сусідніми р-АО.
В результаті такого перекривання виникає єдина делокалізована π-система, найбільша електронна щільність в якій знаходиться над і під площиною σ-скелета й охоплює всі атоми вуглецю циклу (рис. 1.8, б).
π-електронна щільність рівномірно розподілена по усій циклічній системі, що позначається колом усередині циклу (мал. 1.8, в). Усі зв'язки між атомами вуглецю у бензоловому кільці мають однакову довжину (0,139 нм), проміжну між довжинами одинарного й подвійного зв'язків.

а) б) в)
Рис. 1.8. Атомно–орбітальна модель бензолу
У загальному випадку, як встановив на підставі квантово-механічних розрахунків німецький фізик Е. Хюккель, для утворення таких стабільних молекул необхідно, щоб плоска циклічна система містила (4п+2)
π-електронів, де п-1,2,3 та ін. (правило Хюккеля, 1931). З урахуванням цих даних можна конкретизувати поняття ароматичності.
Сполука ароматична, якщо вона має плоский замкнутий цикл і спряжену електронну систему, що охоплює всі атоми циклу й містить (4п+2) π-електронів.
Правило Хюккеля може бути застосоване до будь-яких плоских конденсованих систем, в яких немає атомів, що є загальними більш ніж для двох циклів. Тому такі сполуки з конденсованими бензоловими ядрами як нафталін та інші відповідають критеріям ароматичності (рис. 1.9).

нафталін
10 π-електронів (п=2)
Рис.1.9. Атомно-орбітальна модель нафталіну
Нині у зв'язку з широким впровадженням фізико-хімічних методів з'явилася можливість експериментально встановлювати наявність ароматичного характеру за здатністю сполуки утримувати індукований кільцевий струм. Це здійснюють за допомогою методу ядерно-магнітного резонансу.
Гетероциклічні ароматичні сполуки. У ряді цих сполук зустрічаються обидва види спряження – π,π- та р,π-спряження.
π,π-Спряження характерне для шестичленних гетероциклів з одним або декількома гетероатомами. Простим їх представником є піридин, що містить у циклі один атом азоту.
Атом азоту перебуває у стані sp2- гібридизації (дві з трьох sp2-гібридних орбіталей утворюють σ-зв'язки). Він постачає в ароматичний секстет один електрон. Неподільна пара електронів на sp2-гібридній орбіталі обумовлює властивості піридину як лугу. Атом азоту з такою електронною будовою прийнято називати піридиновим (рис. 1.10).
У результаті великої електронегативності порівняно з атомом вуглецю піридиновий атом азоту знижує електронну щільність на атомах вуглецю ароматичного кільця. Тому системи з піридиновим атомом азоту називають π-недостатніми. Окрім піридину, прикладом таких систем є піримідин, що містить два піридинових атома азоту.
р,π-Спряження здійснюється в п’ятичленних гетероциклах з атомами азоту, кисню, сірки. Досить часто у складі біологічно значимих сполук зустрічається гетероцикл з одним атомом азоту - пірол.
|
|

Рис. 1.10 Розподіл електронів піридинового атома азоту за орбіталями
|

пірол пірольний атом азоту
Рис. 1.11. Розподіл електронів пірольного атома азоту за орбіталями
Шестиелектронна хмара в піролі делокалізована на п'яти атомах циклу, тому пірол є π-надмірною системою.
У фурані й тіофені ароматичний секстет також включає неподільну пару електронів негібрідизованої р-АО кисню і сірки відповідно. В імідазолі два атоми азоту вносять різний вклад в утворення делокалізованої електронної хмари: пірольний атом азоту постачає пару р-електронів, а піридиновий - один р-електрон.
У пірольному й піридиновому атомах азоту електрони знаходяться на негібридизованих р-АО.
|

фуран тіофен імідазол
Ароматичний характер має також пурин, що є сконденсованою системою з двох гетероциклів - піримідину й імідазолу. Делокалізована електронна хмара в пурині включає 10π-електронів.
|
|
|
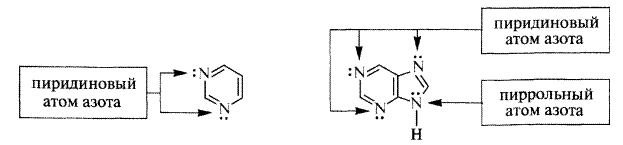
піримідин пурин
Гетероциклічні ароматичні сполуки мають високу термодинамічну стійкість. Недивно, що саме вони слугують структурними одиницями найважливіших біологічних полімерів - нуклеїнових кислот.
Електронні ефекти
Індуктивний ефект. Наявність у молекулі полярного σ-зв'язку викликає поляризацію найближчих зв'язків і зумовлює виникнення часткових зарядів на сусідніх атомах.

Таким чином, замісники викликають поляризацію не лише "свого", але й сусідніх σ-зв'язків. Цей вид передачі впливу атомів прийнято називати індуктивним ефектом (І-ефект).
Індуктивний ефект - це передача електронного впливу замісників за рахунок зміщення електронів σ-зв'язків.
Індуктивний ефект через слабку поляризованість σ-зв'язку затухає через три-чотири зв'язки в ланцюзі. Його дія найсильніше проявляється стосовно до атома вуглецю, сусіднього з тим, у якого знаходяться замісники.
Напрям індуктивного ефекту замісника прийнято якісно оцінювати шляхом порівняння з атомом водню, індуктивний ефект якого прийнятий за нуль. Графічно дію І-ефекту зображують стрілкою, що співпадає з положенням валентної риски і спрямована вістрям у бік більш електронегативного атома.
Замісник (Х), що притягує електронну щільність σ-зв'язку, і сильніше, ніж атом водню, проявляє негативний індуктивний ефект (-І).
Такі замісники в цілому знижують електронну щільність системи, і їх називають електроноакцепторними. До них належить більшість функціональних груп (галогени, OH, NO2, COOH та ін. ) і катіони.
Замісник (Y), що зміщує порівняно з атомом водню електронну щільність зв'язку в бік вуглецевого ланцюга, проявляє позитивний індуктивний ефект (+І).
Такі замісники зумовлюють підвищення електронної щільності в ланцюзі й називаються електронодонорними. До них належать алкільні (метильні, етильні та ін.) групи, метали і аніони.
Мезомерний ефект. На відмінну від неспряжених сполук, в яких електронний вплив замісників передається по σ-зв'язках (індуктивний ефект), у спряжених системах у передачі електронного впливу основну роль відіграють π-електрони делокалізованих ковалентних зв'язків. Ефект, що проявляється в зміщенні електронної щільності делокалізованої (спряженої) π-системи, називають мезомерним ефектом (М-ефект) або ефектом спряження.
Мезомерний ефект - передача електронного впливу замісників по спряженій системі.
При цьому замісник сам є учасником спряженої системи. Він може вносити в систему спряження π-зв'язок (карбонільна, карбоксильна й інші групи), неподільну пару електронів гетероатома (галогени, аміно- і гідроксигрупи), вакантну чи заповнену одним або двома електронами р-АО.
Замісники, що підвищують електронну щільність у спряженій системі, проявляють позитивний мезомерний ефект (+М).
+М-ефект мають замісники, що містять атоми з неподільною парою електронів або цілим негативним зарядом. Ці замісники здатні до передачі пари електронів у загальну зв'язану систему, тобто є електронодонорними.
Замісники, що знижують електронну щільність у спряженій системі, проявляють негативний мезомерний ефект (- М).
-М-ефект мають ненасичені угрупування й позитивно заряджені атоми, тобто електроноакцепторні замісники.
Графічно зміщення електронної щільності позначається зігнутими стрілками, початок яких показує, які р- чи π-електрони зміщуються, а кінець - зв'язок або атом, до яких вони зміщуються. На відміну від індуктивного мезомерний ефект передається за системою зв'язаних зв'язків на значно більшу відстань.
У наведених нижче прикладах показано прояв - М-ефекту карбонільної групи в акролеїні і бензальдегіді, а також +М-ефекту аміногрупи в аніліні.

акролеїн бензальдегід анілін
Таблиця 1.4. Електронні ефекти деяких замісників
| Замісник | Електронні ефекти | Характер сумісної дії | |
| індуктивний | мезомерний | ||
| Алкільні групи (R) | +I | - | Електронодонорний |
| ―O- | +I | +M | |
| ―NH2 ,―NHR,―NR2 | -I | +M | |
| ―OH | -I | +M | |
| Алкоксигрупи (―OR) | -I | +M | |
| ―NH3+ ,―NR+ | -I | - | Електроноакцепторний |
| Галогени (F, Cl, Br, I) | -I | +M | |
| ―NO2 | -I | -M | |
| ―SO3H | -I | -M | |
| ―COOH, ―COOR | -I | -M | |
| >C═O | -I | -M |
При оцінюванні впливу замісників на розподіл електронної щільності в молекулі необхідно враховувати результативну дію індуктивного й мезомерного ефектів. Електронні ефекти деяких замісників підсумовано в таблиці 1.4.
Електронні ефекти замісників є важливим чинником, що дозволяє дати якісну оцінку розподілу електронної щільності в нереагуючій молекулі й прогнозувати її властивості. Таким чином, електронні ефекти лежать в основі сучасної інтерпретації вчення А.М. Бутлерова про взаємний вплив атомів у молекулі.
´ Контрольні запитання
1. Яку електронну будову мають елементи органогени?
2. Що являє собою гібридизація орбіталей? Яка її функція?
3. Охарактеризуйте ковалентні зв’язки.
4. Дайте характеристику донорно-акцепторним зв’язкам.
5. Дайте характеристику водневим зв’язкам.
6. Які системи спряження вам відомі? Дайте характеристику поняття «ароматичність».
7. Які електронні ефекти можливі для органічних молекул?
Література
Основна: 1-3, 5; додаткова: 2,3, 5-7.
Тема 3. Стереоізомерія біоорганічних сполук
1. Конформація біоорганічних сполук.
2. Оптична ізомерія.
Основні поняття:проекційні формули,конформаційні ізомери, енантіомери, стереоспецифічні реакції.
Задача 1
Яких конформацій набуває молекула пропанолу-1 при обертанні навколо зв’язку С-1–С-2?
Розв’язання. В молекулі пропанолу-1 атоми вуглецю перебувають у
sp3-гібридному стані та мають тетраедричну конфігурацію. Відносно з’єднуючого атоми вуглецю s-зв’язку можливе обертання, в результаті якого молекула набуває різних конформацій.
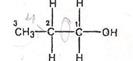
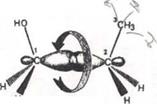
Пропанол-1 Обертання навколо s-зв’язку
При повному оберті навколо зв’язку С-1–С-2 виникає безліч конформацій, з яких беруться до уваги шість конформацій, які мають торсіонні кути кратні 60°: три заслонені (I, III и V) та три загальмовані (II, IV і VI). На площині конформації зображують за допомогою проекційних формул Н’юмена.






Заслонена Скошена(гош-) Частково заслонена Загальмована (анти-) Частково заслонена Скошена(гош-)
I II III IV V V
Конформації пропанолу-1 енергетично не рівноцінні. Заслонені конформації I, III та V термодинамічно менш вигідні, ніж загальмовані, внаслідок взаємного відштовхування електронів. З трьох загальмованих конформацій гош-конформації II і VI менш стабільні, ніж анти-конформація IV, через ван-дер-ваальсову напругу, що зумовлюється взаємним відштовхуванням об’ємних замісників.

? Завдання для самостійного вирішення
1. За допомогою проекційних формул Ньюмена покажіть конформації етанолу, що виникають у результаті обертання навколо зв’язку С–С.
2. Яких конформацій набуває молекула 2-аміноетантіолу в результаті обертання навколо зв'язку С-С? Зобразіть їх за допомогою проекційних формул Ньюмена.
3. За допомогою проекційних формул Ньюмена зобразіть конформації етиленгліколю (етандіолу-1,2) і назвіть їх.
4. Напишіть структурну формулу сполуки, конформація якої наведена нижче. Назвіть цю сполуку за замісниковою номенклатурою ІЮПАК.

5. У якій конформації знаходиться зображена у вигляді кулестрижневої моделі молекула бутанолу-1? Зобразіть цю конформацію за допомогою проекційних формул Ньюмена.

6. Якому положенню на енергетичній кривій відповідає конформація пентану, зображена у вигляді молекулярної моделі?

Т-1. Яка з наведених проекційних формул Ньюмена відповідає скошеній конформації бутанолу-1?

Т-2. Зіставте зазначені в колонці 1 поняття з проекційними формулами Ньюмена, наведеними в колонці 2.
Колонка 1
1. Гош-конформація 3-гідроксипропанової кислоти.
2. Структурний ізомер 3-гідроксипропанової кислоти.
Колонка 2

Т-3. У н-бутану гош-конформація менш стабільна, ніж анти-конформація, бо в гош-конформації відбувається відштовхування електронів супротивних
s-зв'язків.
Т-4. Які з наведених проекційних формул Ньюмена відповідають конформації 2-аміно-З-метилбутанової кислоти (валіну), що виникають при обертанні навколо зв'язку С-2 – С-3?

А. Усі Г. Лише 1 та 5
Б. Лише 1 та 2 Д. Лише 2 та 3.
В. Лише 1, 4 та 5
Задача 2
Які з перерахованих сполук можуть існувати у вигляді енантіомерів: бутанол-1, бутанол-2, амінооцтова, 2-аміно- і 2-гідроксипропанова кислоти?
Розв’язання. У вигляді енантіомерів можуть існувати тільки хіральні молекули, тобто ті, які несумісні зі своїм дзеркальним відображенням. Причиною хіральності у багатьох органічних сполук є наявність асиметричного атома вуглецю. Асиметричний атом вуглецю міститься в молекулах бутанолу-2,
2-аміно- та 2-гідроксипропанової кислот, а отже, ці сполуки існують у вигляді енантіомерів.

У структурах бутанолу-1 та амінооцтової кислоти у Sp3-гібридизованих атомів вуглецю є принаймні дві однакові ліганди, їхні молекули ахіральні й нездатні існувати у вигляді оптично активних форм.

? Завдання для самостійного вирішення
7. Яка з двох сполук - гліцерин або гліцериновий альдегід - може існувати у вигляді енантіомерів?
8. Яка з карбонових кислот, що беруть участь у циклі Кребса – яблучна (2-гідроксибутандіова) або фумарова (бутендіова) - здатна існувати у вигляді енантіомерів?
9. Чи може існувати у вигляді енантіомерів адреналін?

10. Чи мають хіральність молекули α-амінокислот – валіну
(СН3)2CH-CH(NH2)COOH і метіоніну CH3SCH2СН2СН(NH2)COOH?
11. Один з енантіомерів α-аланіну має такі фізичні константи: температура плавлення - 297 °С; розчинність у 100 г води при 25 °С - 16,6 г; питоме обертання [α] D+33° (в оцтовій кислоті). Передбачте фізичні властивості іншого енантіомеру.
12. Скільки асиметричних атомів вуглецю міститься в молекулі ментолу і молекулі камфори?

13. Позначте асиметричні атоми вуглецю у структурі аденозину.

Т-5. Яка з наведених сполук може існувати у вигляді енантіомерів?
А. НООС-СН2-СООН Г. СН3-СНОН-СН2СООН
Б. CH2OH-CH2CH2COOH Д. (СН3)2СН-СН2СООН
В. НООС-СО-СН2СН2СООН
Т-6. Лимонна кислота, що міститься в цитрусових НООССН2С(ОН)(СООН)СН2СООН, не може існувати у вигляді
енантіомерів, бо її молекула лимонної кислоти не має центрів хіральності.
Т-7. Які із запропонованих тверджень справедливі тільки стосовно до енантіомерів?
1. Енантіомери - сполуки, молекули яких відносяться один до одного як предмет і несумісне з ним дзеркальне відображення.
2. Енантіомери мають однакові температури плавлення і кипіння, однакову розчинність, але відрізняються знаком обертання площини поляризованого світла.
3. Енантіомери з різною швидкістю вступають у хімічні реакції.
4. Енантіомери відрізняються абсолютною величиною питомого обертання.
А. Тільки 1 і 3 Г. Тільки 1 і 2
Б. Тільки 2 і 3 Д. Тільки 3 і 4.
В. Тільки 1 і 4
Т-8. При дотриманні яких з перелічених умов сполука існує у вигляді енантіомерів?
1. Молекула сполуки хіральна.
2. У молекулі є один атом вуглецю, пов'язаний з чотирма різними лігандами.
3. Молекула має площину симетрії.
4. Сполука володіє оптичною активністю.
А. Тільки 1,2 і 3 Г. Тільки 1 і 4
Б. Тільки 2 і 3 Д. Тільки 1,2 і 4.
В. Усі
Задача 4
У процесі метаболізму вуглеводів відбувається стереоспецифічне окиснення L-молочної кислоти в піровиноградну за участю ферменту
L-лактатдегідрогенази. Які зі структур I-III можуть виступати в якості субстрату L-лактатдегідрогенази, тобто належати до L-ряду?

Розв’язання. Для зіставлення конфігурації сполук І та II з L-гліцериновим альдегідом необхідно перетворити їх проекційні формули, щоб схожість або відмінність стала очевидною. За правилами перетворення формул Фішера у асиметричного атома можна виконувати парну кількість перестановок лігандів, а також повертати формулу Фішера на 180° без виведення із площини. Ці операції не спотворюють стереохімічної суті формул. У формулі І слід зробити дві перестановки, а формулу II достатньо повернути на 180 °, після чого неважко переконатися у приналежності обох сполук до L-ряду.

Стереохімічну формулу III можна перетворити на формулу Фішера, а потім зіставити її з проекційними формулами D- та L-гліцеринових альдегідів. При побудові формули Фішера молекулярну модель чи стереохімічну формулу слід розташувати у просторі так, щоб зв'язки, які йдуть за площину проекції, утворювали вертикальну лінію, а зв'язки, спрямовані у простір перед площиною - горизонтальну.

Таким чином, структури I, II і III відповідають L-молочній кислоті.
? Завдання для самостійного вирішення
14. Яка з двох проекційних формул І або II відповідає L-аланіну
(L-2-амінопропановій кислоті)?

15. Побудуйте проекційні формули Фішера енантіомерів
2-гідроксибутанової кислоти.
16. Родоначальником якого стереохімічного ряду є гліцериновий альдегід, що має таку структуру?

17. Чи ідентичні α-амінокислоти, конфігурація яких зображена за допомогою проекційних формул I і II?

18. Віднесіть до стереохімічних рядів енантіомери лейцину у вигляді стереохімічних формул І і ІІ.

Т-9. З наведених проекційних формул виберіть формулу, яка відповідає
L-яблучній кислоті.

Т-10. З формул, наведених у колонці 2, виберіть ті, які відповідають сполукам, перерахованим у колонці 1.
Колонка 1
1. L-2-амінобутандіова (аспарагінова) кислота.
2. L-2-амінопентандіова (глутамінова) кислота.
Колонка 2
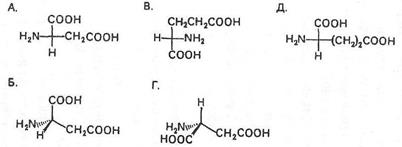
Т-11. Які з наведених пар сполук являють собою пари енантіомерів?

А. Тільки 1 та 4 Г. Тільки 2,4 та 5
Б. Усі Д. Тільки 2,3 та 5.
В. Тільки 1,2 та 5
Т-12. Які з наведених формул відповідають структурі α-амінокислот
L-ряду?
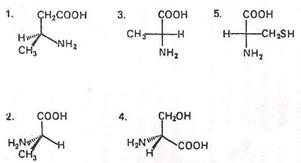
А. Тільки 2 та 5 Г. Тільки 4 та 5
Б. Усі Д. Тільки 1,3,4 та 5
В. Тільки 1,2 та 3
Задача 5
Один зі стереоізомерів 2-аміно-З-гідроксибутанової кислоти
(L-треоніну) входить до складу білків. Які конфігураційні стереоізомери можливі для треоніну?
Розв’язання. У молекулі треоніну два центри хіральності (два асиметричних атоми вуглецю). Отже, треонін може існувати у вигляді
4 конфігураційних стереоізомерів (2n=4, при n=2).

Стереоізомери I і II, а також III і IV - пари енантіомерів. У парах I і III,
I і IV, II і III, II і IV молекули не співвідносяться
як предмет і несумісне з ним дзеркальне відображення, являють собою пари діастереомерів. Діастеріомери на відміну від енантіомерів володіють різними фізичними і хімічними властивостями (величина кута обертання,
температура кипіння і плавлення, розчинність та ін.)
При віднесенні треоніну і взагалі сполук з двома і більше асиметричними атомами до D- або L-стереохімічного ряду виникає питання - за яким центром хіральності його здійснювати? У цій неоднозначності полягає один із недоліків D,L – системи. Для аміно- та гідроксикислот використовується так званий гідроксикислотний ключ, коли з конфігурацією гліцеринового альдегіду порівнюється конфігурація асиметричного атома з найменшим номером. За цим правилом стереоізомери I і IV належать до L-ряду, а II і III - до D-ряду. До складу білків входить L-треонін.
Сполуки I і II мають еритро-конфігурацію, в цьому випадку іноді використовується префікс ало-.
? Завдання для самостійного вирішення:
18. Один зі стереоізомерів 2-аміно-З-метилпентанової кислоти входить до складу білків. Напишіть проекційні формули Фішера можливих стереоізомерів цієї сполуки.
19. Напишіть проекційні формули Фішера 2-бром-З-хлор-бутану.
20. Скільки конфігураційних стереоізомерів має 2-аміно-4-гідрокси-З-метилпентанова кислота?
21. Які стереоізомери винної кислоти наведені у вигляді проекційних формул I і II? Який з них оптично неактивний і чому?

22. На одній зі стадій циклу Кребса відбуваються взаємоперетворення лимонної, ізолимонної та аконітової кислот. Яка з перерахованих кислот може існувати у вигляді трео- або еритро-форм? Напишіть їх проекційні формули Фішера.

23. Адреноміметик (-) - ефедрин ([α]D - 34,2°, т. пл. 40 °С) в кілька разів активніший, ніж його стереоізомер (+) – псевдоефедрин ([α]D +51,2°,
т. пл. 118 °C). Стереоізомерами якого типу є (-) - ефедрин і (+) - псевдоефедрин?
24. Який стереоізомер треоніну зображений у вигляді молекулярної моделі?

Т-13 Кальцієва сіль 2,3,4,5,6-пентагідроксигексанової (глюконової) кислоти використовується як лікарський засіб. Скільки стереоізомерів має 2,3,4,5,6-пентагідросигексанова кислота?
А. 8 Г. 10
Б. 32 Д. 20.
В. 16
Т-14. Знайдіть у колонці 2 формули, що відповідають сполукам, перерахованим у колонці 1.
Колонка 1
1. D-винна кислота.
2. L-винна кислота.
Колонка 2

Т-15. Слизова кислота не володіє оптичною активністю, оскільки молекула слизової кислоти ахіральна у зв’язку з наявністю площини симетрії.

Т-16. Які з наведених тверджень є правильними відносно діастереомерів?
1.Діастеріомери відрізняються фізичними властивостями.
2. У вигляді діастеріомерів можуть існувати тільки хіральні молекули.
3. Діастеріомери з різною швидкістю вступають у хімічні реакції.
4. На відміну від енантіомерів молекули діастереомерів сумісні у просторі.
5. Серед діастереомерів можуть бути оптично неактивні сполуки.
А. Тільки 1,3 та 5 Г. Тільки 1,3 та 4
Б. Тільки 2,4 та 5 Д. Тільки 2,3 та 4.
В. Усі
Задача 6
Позначте конфігурацію природної α-амінокислоти L-серину (2-аміно-3-гідроксипропанової кислоти) за R, S - системою.
Розв’язання. В основі R, S - системи позначення конфігурації лежить принцип старшинства замісників, що оточують центр хіральності. Старшинство замісників визначається атомним номером елемента, пов'язаного безпосередньо з центром хіральності. Найстаршим замісником у молекулі серину є аміногрупа (7N), наймолодшим – водень (1Н). Для визначення порядку старшинства між карбоксильною СООН та первинною спиртовою СН2ОН групами, які мають у першому шарі однакові атоми (6С), порівнюють номери елементів другого шару. Більше старшинство карбоксильної групи обумовлене тим, що кисень пов’язаний подвійним зв'язком, рахується двічі. Таким чином, замісники у хірального атома вуглецю в серині мають такий порядок зменшення старшинства:
NH1 > СООН > CH2OH > H.

При позначенні конфігурацій за R,S - системою молекулярну модель
L-серину розташовують у просторі так, щоб молодший замісник був віддалений від ока спостерігача. Зменшення старшинства при цьому відбувається проти годинникової стрілки, тому L-серину приписують
S-конфігурацію.
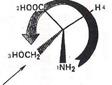
Конфігурацію хірального центру можна визначити за проекційною формулою Фішера. За допомогою парної кількості перестановок її слід перетворити, щоб молодший замісник опинився вгорі чи внизу проекції, що відповідає положенню, найбільш віддаленому від ока спостерігача. Інші замісники при цьому будуть розташовуватися в порядку зменшення старшинства. Після двох перестановок видно, що хіральний центр в L-серині має S-конфігурацію.

? Завдання для самостійного вирішення
24. Назвіть за R,S - системою L-2-аміно-З-меркаптопропанову кислоту (L-цистеїн).
25. Назвіть за R,S - системою L-2-амінопропанову кислоту (L-аланін).
26. Назвіть за R,S - системою (+)-гліцериновий і (-)-гліцериновий альдегіди.
27. У біохімічних реакціях роль метилуючого агента виконує
(S)-2-аміно-3-метилтіобутанова кислота. До якого стереохімічного ряду вона належить?
28. Одним з найважливіших метаболітів є (S)-2-гідроксипропанова кислота. До якого стереохімічного ряду вона належить?
Т-17. У якому порядку зменшується старшинство замісників у сполуці І?


Т-18. Які з наведених у колонці 2 формул сполук відповідають структурам, названим у колонці 1?
Колонка 1
8. α-амінокислота, що має R-конфігурацію.
9. α-амінокислота, що має S-конфігурацію.

Т-19. Заступник - CH(OH)CH2SH старше, ніж СН2СН(ОН)ОСН3, тому що атом сірки має більший порядковий номер, ніж атом кисню.
Т-20. Які з наведених формул відповідають (R)-2-гідроксипропановій кислоті?
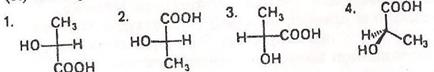
А. Усі Г. Тільки 2,3 та 4
Б. Тільки 1,3 та 4 Д. Тільки 1 та 4.
В. Тільки 1,2 та 3
Література
Основна: 2,3, 4; додаткова: 1-3, 5-7.
Тема 4. Спирти. Феноли
1. Загальна характеристика спиртів.
2. Методи синтезу та фізико-хімічні властивості спиртів.
3. Загальна характеристика фенолів.
4. Методи синтезу та фізико-хімічні властивості фенолів.
Основні поняття:класифікація та номенклатура біоорганічних сполук класу спирти та феноли,атомно-орбітальна схема будови молекули, реакція окиснення.
Спирти
¨Спирти (алкоголі) – органічні сполуки, що містять у складі своїх молекул одну або кілька гідроксильних груп – ОН біля насичених атомів карбону. Залежно від кількості гідроксильних груп, що входять до складу молекули спирту, їх класифікують на одноатомні (алкоголі), двохатомні (гліколі), трьохатомні (гліцерини) та багатоатомні. За положенням гідроксильної групи в молекулі спирту їх поділяють на первинні, вторинні й третинні. Спирти можуть бути насичені й ненасичені, ациклічні й циклічні, похідними гомологів бензолу, циклопарафінів та циклічних терпенів.
Нижчі одноатомні спирти (від СН3ОН до С4Н9ОН ) легко розчиняються у воді. Зі збільшенням довжини карбонового ланцюга розчинність спиртів зменшується. Для нижчих спиртів типовий спиртовий запах, потім зі збільшенням молекулярної маси з'являється неприємний запах (сивушний), вищі спирти не мають запаху. Густина всіх спиртів менша за одиницю.
Спирти – нейтральні сполуки. Реагують з К, Lі, АІ, Mg, Na та іншими металами з утворенням сполук типу алканолятів. Це кристалічні речовини, добре розчинні у воді. В результаті взаємодії спиртів із сильними мінеральними кислотами або кислотами Льюїса утворюються етери (прості ефіри). Етерифікація спиртів органічними й мінеральними кислотами зумовлює утворення естерів (складних ефірів). Первинні та вторинні спирти окиснюються або дегідруються за наявності металічних каталізаторів до відповідних альдегідів і кетонів. Третинні спирти стійкі до реакцій окиснення у нейтральному й кислому середовищах, за певних умов розщеплюються до кетонів і кислот з меншою кількістю атомів карбону. Спирти легко дегідратуютьcя до алкенів. Гідроксильна група молекули спирту може заміщуватися на атом галогену, реагуючи з галогеноводнями, РС15, РОС13 тощо.
Спирти добувають різними способами. Ряд низькомолекулярних спиртів (етанол, пропанол, бутаноли) добувають бродінням вуглеводів, метанол – у результаті сухої перегонки тирси. Більшість спиртів добувають синтетичними методами – з алкенів гідратацією або гідроборуванням з подальшим окисленням, гідролізом відповідних галогенопохідних вуглеводнів, відновленням альдегідів і кетонів, карбонових кислот та естерів.
Спирти дуже поширені у вигляді похідних (естерів, частково етерів) у природі. Вони відіграють важливу роль у життєдіяльності тварин і рослин, їх використовують у різних галузях промисловості (як розчинники, сировину для добування каучуку, органічних барвників, медикаментів, вибухових речовин тощо).
Лабораторні роботи
Робота 1. Визначення вмісту спирту в розчині
Вміст спиртів у воді визначають за їх густиною. Визначення здійснюють за допомогою спеціального приладу – спиртометра. Об'ємний процент спирту в розчині називають градусом. Наприклад, у 96° спирті міститься 96% абсолютного спирту і 4% води.
Хід роботи. Беруть два циліндри. В один з них наливають 300-400мл води, в інший – стільки ж етанолу. В циліндри занурюють спиртометри і за їх позначками визначають вміст спирту у відсотках, вносячи поправку на температуру за інструкцією, що додається до приладу. Покази приладу свідчать про те, що в першому циліндрі спирт не міститься.
Завдання. Замалюйте схему приладу й покажіть градусність досліджуваного етанолу.
Робота 2. Відкриття наявності води в етанолі та його зневоднення
Етиловий спирт-ректифікат містить у своєму складі 95,6% спирту і 4,4% води. Вода не може бути виділена зі спирту звичайною перегонкою, оскільки вода і спирт утворюють азеотропну суміш і в такому кількісному співвідношенні переганяються як одна речовина.
Хід роботи. У пробірку наливають 1-2 мл етанолу і додають кілька кристаликів прожареного білого порошку сульфату купруму, перемішують струшуванням. Спостерігають, як білий колір прожареного сульфату купруму поступово стає синім.
Хімізм. При взаємодії сульфату купруму з водою утворюється кристалогідрат сульфату купруму:
CuSO4 + 5H2O → CuSO4*5H2O
Робота 3. Відкриття у спирті-сирці сивушних масел
Спирт-сирець містить домішки сивушних масел (0,4-0,6%) у вигляді оліїстої рідини, що має забарвлення від світло-жовтого до червоно-бурого. Сивушні масла токсичні, мають неприємний запах, подразнюють слизові оболонки травного каналу і дихальні шляхи. У складі сивушних масел містяться 3-метилбутанол-1 і 2-метилбутанол-1 (близько 68%),
2-метилпропанол-1 (24 %), пропанол-1 (7 %) та вищі спирти (з 6-9 атомами карбону – 1 %). Іноді у складі сивушних масел є домішки альдегідів, кетонів, карбонових кислот та деяких азотистих речовин.
Хід роботи. Для виявлення в етанолі домішок сивушних масел найчастіше виконують дві якісні реакції:
а) у пробірку наливають 1 -2 мл спирту-сирцю, після чого вносять смужку фільтрувального паперу. Папір поступово змочується спиртом. Його витягують з пробірки, висушують і досліджують. У разі наявності в спирті сивушних масел на папері з'являються плями, що мають неприємний запах;
б) до 1-2 мл спирту, налитого в чисту пробірку, додають 2-3 краплі 5-7% спиртового розчину фурфуролу і 1 мл концентрованої сульфатної кислоти. Вміст пробірки струшують і перемішують. Через 3-8 хв (за наявності сивушних масел) суміш забарвлюється в червоний, фіолетовий, фіолетово-червоний або вишнево-червоний колір.
Хімізм. Перший спосіб виявлення сивушних масел ґрунтується на явищі адсорбції сивушних масел фільтрувальним папером. Взаємодія фурфуролу із сивушними маслами в умовах кислого середовища зумовлює утворення забарвлених продуктів реакції, що мають складну будову.
Робота 4. Розчинність одноатомних насичених спиртів у воді
Розчинність спиртів у воді залежить від їх молекулярної маси. Низькомолекулярні спирти (метанол, етанол, пропаноли) змішуються з водою в будь-яких співвідношеннях. Починаючи з бут<
Последнее изменение этой страницы: 2016-06-08
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...