
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Клеточная теория. Типы клеточной организации и основные положения.
БИЛЕТ № 1.
2. Основными элем. частицами, участвующими в образовании химической связи являются валентные электроны. Характером перемещений валентных электронов определяется тип химической связи.
- 1. Ковалетная неполярная и полярная связь:
ков. неполярная связь между атомами одинаковых элементов
ков. полярная связь между разными атомами.
- 2. Ионная связь – если взаимодействуют атомы, сильно отличающиеся по своей электроотрицательности.
- 3. Водороджная связь – если вещество имеет молекулярное строение. Эти связи возникают между атомами водорода и сильно электро – отрицательными атомами
( ) – вода, спирты и т.д.
- 4. Металлическая связь – существует в металлах. Валентные электроны металлов легко покидают свои орбитали.
- 5. Простые и кратные связи.
* если два атома соединены одной электронной парой – простая одинарная связь;
* если две или три электронные пары – то возникают кратные связи: двойная или тройная (например ……………………………………………………………..).
Клеточная теория. Типы клеточной организации и основные положения.
Клеточная теория — важнейшее биологическое обобщение, согласно которому все живые организмы состоят из клеток. Изучение клеток стало возможным после изобретения микроскопа. Впервые клеточное строение у растений (срез пробки) обнаружил английский ученый, физик Р. Гук, он же предложил термин «клетка» (1665 г.). Голландский ученый Антони ван Левенгук впервые описал эритроциты позвоночных, сперматозоиды, разнообразные микроструктуры растительных и животных клеток, различные одноклеточные организмы, в том числе бактерии и пр.
В 1831 г. англичанин Р. Броун обнаружил в клетках ядро. В 1838 г. немецкий ботаник М. Шлейден пришел к выводу, что ткани растений состоят из клеток. Немецкий зоолог Т. Шванн показал, что из клеток состоят и ткани животных. В 1839 г. вышла книга Т. Шванна «Микроскопические исследования о соответствии в структуре и росте животных и растений», в которой он доказывает, что клетки, содержащие ядра, представляют собой структурную и функциональную основу всех живых существ. Основные положения клеточной теории Т. Шванна можно сформулировать следующим образом.
1. Клетка — элементарная структурная единица строения всех живых существ.
2. Клетки растений и животных самостоятельны, гомологичны друг другу по происхождению и структуре.
М. Шдейден и Т. Шванн ошибочно считали, что главная роль в клетке принадлежит оболочке и новые клетки образуются из межклеточного бесструктурного вещества. В дальнейшем в клеточную теорию были внесены уточнения и дополнения, сделанные другими учеными.
Еще в 1827 г. академик Российской АН К.М. Бэр, открыв яйцеклетки млекопитающих, установил, что все организмы начинают свое развитие с одной клетки, представляющей собой оплодотворенное яйцо. Это открытие показало, что клетка является не только единицей строения, но и единицей развития всех живых организмов.
В 1855 г. немецкий врач Р. Вирхов приходит к выводу, что клетка может возникнуть только из предшествующей клетки путем ее деления.
На современном уровне развития биологии основные положения клеточной теории можно представить следующим образом.
1. Клетка — элементарная живая система, единица строения, жизнедеятельности, размножения и индивидуального развития организмов.
2. Клетки всех живых организмов сходны по строению и химическому составу.
3. Новые клетки возникают только путем деления ранее существовавших клеток.
4. Клеточное строение организмов — доказательство единства происхождения всего живого.
Типы клеточной организации
Выделяют два типа клеточной организации: 1) прокариотический, 2) эукариотический. Общим для клеток обоих типов является то, что клетки ограничены оболочкой, внутреннее содержимое представлено цитоплазмой. В цитоплазме находятся органоиды и включения. Органоиды — постоянные, обязательно присутствующие, компоненты клетки, выполняющие специфические функции. Органоиды могут быть ограничены одной или двумя мембранами (мембранные органоиды) или не ограничены мембранами (немембранные органоиды). Включения — непостоянные компоненты клетки, представляющие собой отложения веществ, временно выведенных из обмена или конечных его продуктов.
В таблице перечислены основные различия между прокариотическими и эукариотическими клетками.
| Признак | Прокариотические клетки | Эукариотические клетки |
| Структурно оформленное ядро | Отсутствует | Имеется |
| Генетический материал | Кольцевые не связанные с белками ДНК | Линейные связанные с белками ядерные ДНК и кольцевые не связанные с белками ДНК митохондрий и пластид |
| Мембранные органоиды | Отсутствуют | Имеются |
| Рибосомы | 70-S типа | 80-S типа (в митохондриях и пластидах — 70-S типа) |
| Жгутики | Не ограничены мембраной | Ограничены мембраной, внутри микротрубочки: 1 пара в центре и 9 пар по периферии |
| Основной компонент клеточной стенки | Муреин | У растений — целлюлоза, у грибов — хитин |
К прокариотам относятся бактерии, к эукариотам — растения, грибы, животные. Организмы могут состоять из одной клетки (прокариоты и одноклеточные эукариоты) и из множества клеток (многоклеточные эукариоты). У многоклеточных происходит специализация и дифференциация клеток, а также образование тканей и органов.
Методы изучения клеток: 1) световая микроскопия, 2) электронная микроскопия, 3) дифференциальное ультрацентрифугирование, 4) рентгеноструктурный анализ, 5) хроматография, 6) электрофорез, 7) микрохирургия, 8) метод культуры клеток и др.
БИЛЕТ №2.
БИЛЕТ № 3.
2. Порядковый номер элемента = заряду ядра (т.е. числу протонов или числу электронов, движущихся около ядра).
– При движении по периоду слева направо с ростом заряда атома уменьшается его размер и возрастает энергия связи электронов с ядром, т.е.металличность элемента снижается, а возрастает способность к присоединению электронов.
- В группах сверху вниз с ростом размера атома ослабевает энергия связи его электронов с ядром, т.е. растёт восстановительная способность, а снизу вверх – окислительная способность. Например, в IV – группе от Рв С.
- В группах объединены элементы, имеющие сходное строение атома на уровне внешнего электронного слоя.
- В периоде характер оксидов элементов меняется от основного ( ) кислотному ( ).
- В группах сверху вниз ослабевает кислотный характер оксидов, переходя на амфотерный или основной.
Белки.Белки составляют 10—18% от общей массы клетки. Это высокомолекулярные полипептиды. В организме человека встречается около 5 млн типов белковых молекул, отличающихся по своей массе, структуре и функциям. Несмотря на такое разнообразие и сложность строения, все белки построены всего из 20 различных аминокислот. Белки содержатся в большинстве продуктов питания. Особенно богаты белком мясо, птица, рыба, яйца, молоко, горох, орехи. Полноценная пища обязательно должна содержать белки животного и растительного происхождения. В сутки человеку необходимо 100-120г белковых веществ. Продукты распада белка – это аммиак, вода и углекислый газ.
Белки, входящие в состав живых организмов, включают сотни и тысячи аминокислот. Порядок их соединения в молекулах белков самый разнообразный, чем и определяется различие свойств белков. Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка. Однако молекула белка в виде цепи аминокислот, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров белковой молекулы (вторичная, третичная и четвертичная структуры белка). По своему составу белки делятся на простые и сложные. Простые белки состоят только из аминокислот. Сложные белки помимо аминокислот имеют в своем составе другие органические соединения (нуклеиновые кислоты, липиды, углеводы), соединения фосфора, металлы. Соответственно они носят название нуклеопротеидов, липопротеидов, гликопротеидов, фосфо- и металлопротеидов.
Функциибелков. Функции белков в клетке многообразны. Одна из. важнейших — строительная функция: белки входят в состав всех клеточных мембран и органоидов клетки7 а также внеклеточных структур. Дли обеспечения жизнедеятельности клетки исключительно важное значение имеет каталитическая, или ферментативная роль белков. Биологические катализаторы, или ферменты, — это вещества белковой природы, ускоряющие химические реакции в десятки и сотни тысяч раз. Ферментам свойственны некоторые черты, отличающие их от катализаторов неорганической природы. Во-первых, один фермент катализирует только одну реакцию или один тип реакций, т. е. биологический катализ специфичен. Во-вторых, активность ферментов ограничена довольно узкими температурными рамками (35—45 °С), за пределами которых их активность снижается или исчезает. В-третьих, ферменты активны при физиологических значениях рН, т. е. в слабощелочной среде. Еще одно важное отличие ферментов от неорганических катализаторов: биологический катализ протекает при нормальном атмосферном давлении. Все это определяет ту важную роль, которую ферменты играют в живом организме. Практически все химические реакции в клетке протекают с участием ферментов. Двигательнаяфункция живых организмов обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: мерцание ресничек и биение жгутиков у простейших, сокращение мышц у многоклеточных животных. Транспортнаяфункция белков заключается в присоединении химических элементов (например, кислорода) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела. При поступлении в организм чужеродных белков или микроорганизмов белые кровяные тельца — лейкоциты — образуют особые белки — антитела. Они связывают и обезвреживают не свойственные организму вещества — это защитная функция белков.
Белки служат также источником энергии в клетке, т. е. выполняют энергетическую функцию.При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.
БИЛЕТ № 4.
Скорость химических реакций.
Существуют медленные (коррозия металлов) и очень быстрые реакции (взрывные). Под скоростью химической реакции ( ) понимают изменение количества вещества
( ) за единицу времени ( ) в единицы объёма ( ) реакционной среды:
отношение - есть молекулярное концентрация вещества ( ), тогда расчёт скорости реакции можно вести по формуле
Зависимость скорости реакции от различных факторов:
- 1. от химической природы вещества (щелочные металлы реагируют с водой очень быстро, а другие медленно, а некоторые вообще не реагируют ( ).
-2. увеличение концентрации реагирующих веществ (чем выше концентрация, тем выше вероятность соударения частиц).
- 3. твёрдое вещество для ускорения реакции должно быть измельчено.
- 4. увеличение температуры
- 5. применение катализаторов
БИЛЕТ №5.
Общая формула
Гомологический ряд
Физические свойства. Метан - газ, без цвета и запаха, почти в 2 раза легче воздуха, практически нерастворим в воде. Входит в состав природного и попутного нефтяных газов.
Химические свойства
1. Реакция замещения
2. Реакции разложения
3. Реакции окисления (горения)
4. Реакция дегидрирования (отщепление водорода).
5. При обычных условиях на пред.углеводороды не действуют окислители (перманганат калия окраску не изменяет).
Применение
1.Метан как топливо
2. Газовая сажа (при высокой температуре)
3. Типографская краска и резина
4. Смеси предельных углеводородов (парафин в медицине)
5. Ценные химический продукты
БИЛЕТ №6.
БИЛЕТ №7.
Общая формула
Гомолог.ряд
Физические св-ва: 1) циклопропан и циклобутан – газы; 2) циклопентан и циклогексан – жидкости.
Химические свойства:
1. Малая химическая активность (как у пред.углев.)
2. Реакция замещения
3. Реакция присоединения
4. Реакция горения
Применение:
1. входят в состав нефтей – нафтены
2. можно получить ароматич. Углеводороды- арены.
3. входят в состав бензина
4. используют для многих синтезов
БИЛЕТ №8.
Общая формула
Молекулы содержат одну двойную связь.
Гомологический ряд
Физические свойства. Этилен – газ, без цвета, почти без запаха немного легче воздуха, плохо растворим в воде.
Химические свойства. Химически активнее, чем пред. углеводороды.
1. Реакции присоединения
2. Реакция полимеризации
3. Реакция окисления (фиолетовая окраска перманганата калия быстро исчезает)
4. Реакция изомеризации (изменяют положение двойной связи в углеродной цепи) – высокая температура + катализатор.
5. Реакция горения
Применение
1. Этилен – сырьё для получения синтетического спирта
2. Для получения галогенопроизводных
3. Для получения полиэтилена, уксусной кислоты.
4. Этилен ускоряет созревание плодов
БИЛЕТ №9.
Общая формула
Первый представитель – бензол
Особенности этого класса углеводородов определяются строением бензольного кольца. Оно является химически устойчивым объединением 6-ти атомов углерода. Каждый атом углерода находится под углом 120° и образуют три связи с соседними атомами углерода и с одним атомом водорода. Формально бензольное кольцо является ненасыщенным  реакции присоединения и хзамещения.
реакции присоединения и хзамещения.
Физические свойства: Бензол – бесцветная, нерастворимая в воде жидкость с характерным запахом и температуры кипения = 80,1 С. Ядовит, действует через органы дыхания и кожу.
Химические свойства:
1. Реакция замещения.
2. Реакция присоединения
(УФ – излучение, высокая температура и катализаторы)
3. Реакция окисления. Бензол горит сильно коптящим пламенем.
Получение:1. из каменного угля путём коксования;2. в процессе крекинга нефти.
Присутствие в бензинах ароматических углеводородов повышает качество нефти
Применение:1. В органическом синтезе для производства пластмасс,2. красителей, лекарств, взрывчатых веществ, резины, каучука и др.
БИЛЕТ №10.
1. Коррозия металлов, условия происхождения. Коррозией металла называют его разрушение под воздействием различных факторов: окружающей среды (кислород, влага, растворы кислот и солей). Различают два вида коррозии: химическую и электрохимическую. Химическая - обусловлена взаимодействием металла с сухими окислителями, и в присутствии влаги.
4 Fe + 3 O = 2 Fe O Электрохимическая – если металлы содержат примеси других металлов или металл разрушается под воздействием ионов водорода.
Zn + 2 HCe = Zn Ce + Ce и если в пробирку погрузить медную проволоку и прикоснуться поверхности цинка, то процесс разрушения цинка усиливается, т.е. более химически активный (стоящий в ряду левее) разрушается в первую очередь.
БИЛЕТ №11.
Неметаллы. Положение в ПС.
Неметаллов в ПС – 16. Наиболее важные 0-кислород, Н-водород, S – сера, С-углерод, Р - фосфор, N – азот, C  – хлор.
– хлор.
В ПС занимают верхний правый угол, входят в главные (А) подгруппы. Атомы неметаллов притягивают электроны, т.е. проявляют окислительные свойства (из-за увеличения заряда ядер и уменьшения атомных радиусов в периодах). В группах эта тенденция возрастает снизу вверх. Фтор – самый активный неметалл.
Атомы неметаллов содержат значительное число электронов (от 4 до 7) притяжение электронов до полного восстановления внешних орбиталей.
По отношению к металлам неметаллы выступают в качестве окислителей. При реакциях между собой окислителем является более электроотрицательный элемент.
Или, чем выше в группе расположен элемент, тем более выражены в нем неметаллические (окислительные) свойства. (Например VI –А группе кислород О - самый активный неметалл).
Ряд неметаллов: Si. B. Te. H. As. H. Se. C. S. I. Br. N. Ce. O. F.
БИЛЕТ №12.
Предельные одноатомные спирты
Это производные углеводородов, в которых один из атомов водорода замещен на гидроксильную группу ОН. Их общая формула – Cn H2n + 1OH
Гомологический ряд.
СН3ОН – метиловый (метанол) С2Н5ОН – этиловый (эталон)
С3Н7ОН – пропиловый (прапонол) С4Н9ОН – бутиловый (бутанол)
Изомерения одноатомных спиртов определяется строением углеродной цепочки и положением ОН-группы. Физические и химические свойства определяются строением молекулы спирта, а точнее функциональной группы ОН. Атом кислорода более электроотрицательный, поэтому смещение электронов химических связей С-О и О-Н происходит в сторону атома кислорода.
Физические свойства: являются жидкостями (низкие), а высшие твердые вещества. Низкие обладают характерным запахом.
Химические свойства:
1. Индикаторы не изменяют своей окраски в водных растворах спиртов.
2. Реакции замещения с активными металлами
3. Реакции окисления: а) частичное (получение альдегида);
б) полное окисление (горение)
4. Реакция дегидратизации (отщепление воды)
5. Взаимодействие с карбоновыми кислотами
- этиловый эфир C2H5OH - производят во многих странах
- производят путем брожения сахаристых веществ
- Из целлюлозы: - Гидратацией этилена
Применение:а) как растворитель; б) моторное масло (топливо); в) компонент алкогольных напитков; г) химическое сырье для производства лекарств, душистых веществ/
БИЛЕТ №13.
БИЛЕТ №14.
БИЛЕТ №15.
БИЛЕТ №16.
БИЛЕТ №17.
БИЛЕТ №18.
БИЛЕТ №19.
БИЛЕТ №20.
БИЛЕТ №21.
2. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель атома. Квантовые постулаты Бора.
Первая модель атома была предложена английским физиком Томсоном. По Томсону, атом представляет собой положительно заряженный шар, внутри которого находятся отрицательно заряженные электроны.
Модель атома Томсона была неверной, что подтвердилось в опытах английского физика Резерфорда в 1906 г.
В этих опытах узкий пучок α-частиц, испускаемых радиоактивным веществом, направлялся на тонкую золотую фольгу. За фольгой помещался экран, способный светиться под ударами быстрых частиц.
Было обнаружено, что большинство α-частиц отклоняется от прямолинейного распространения после прохождения фольги, т.е. рассеиваются. А некоторые α-частицы вообще отбрасываются назад.
Рассеяние α-частиц Резерфорд объяснил тем, что положительный заряд не распределён равномерно по шару, как предполагал Томсон, а сосредоточен в центральной части атома – атомном ядре.При прохождении около ядра α-частица, имеющая положительный заряд, отталкивается от него, а при попадании в ядро – отбрасывается назад.
Резерфорд предположил, что атом устроен подобно планетарной системе.

Но Резерфорд не мог объяснить устойчивости (почему электроны не излучают волны и не падают к положительно заряженному ядру).
Новые представления об особых свойствах атома сформулировал датский физик Бор в двух постулатах.
1-й постулат.Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует соя энергия; в стационарном состоянии атом не излучает.
2-й постулат. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения.
Энергия излученного фотона равна разности энергий атома в двух состояниях:
 постоянная Планка.
постоянная Планка.
БИЛЕТ №2.
БИЛЕТ №4 (1).
БИЛЕТ №5 (1).
БИЛЕТ 19 (1).
БИЛЕТ №15 (1).
БИЛЕТ №21 (2).
2. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель атома. Квантовые постулаты Бора.
Первая модель атома была предложена английским физиком Томсоном. По Томсону, атом представляет собой положительно заряженный шар, внутри которого находятся отрицательно заряженные электроны.
Модель атома Томсона была неверной, что подтвердилось в опытах английского физика Резерфорда в 1906 г.
В этих опытах узкий пучок α-частиц, испускаемых радиоактивным веществом, направлялся на тонкую золотую фольгу. За фольгой помещался экран, способный светиться под ударами быстрых частиц.
Было обнаружено, что большинство α-частиц отклоняется от прямолинейного распространения после прохождения фольги, т.е. рассеиваются. А некоторые α-частицы вообще отбрасываются назад.
Рассеяние α-частиц Резерфорд объяснил тем, что положительный заряд не распределён равномерно по шару, как предполагал Томсон, а сосредоточен в центральной части атома – атомном ядре.При прохождении около ядра α-частица, имеющая положительный заряд, отталкивается от него, а при попадании в ядро – отбрасывается назад.
Резерфорд предположил, что атом устроен подобно планетарной системе.

Но Резерфорд не мог объяснить устойчивости (почему электроны не излучают волны и не падают к положительно заряженному ядру).
Новые представления об особых свойствах атома сформулировал датский физик Бор в двух постулатах.
1-й постулат.Атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует соя энергия; в стационарном состоянии атом не излучает.
2-й постулат. При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения.
Энергия излученного фотона равна разности энергий атома в двух состояниях:
 постоянная Планка.
постоянная Планка.
БИЛЕТ №6.
БИЛЕТ №7 (1).
БИЛЕТ №12 (1).
БИЛЕТ №16 (2).
БИЛЕТ № 9.
БИЛЕТ №13 (1).
БИЛЕТ №11.
БИЛЕТ №12.
БИЛЕТ №13.
БИЛЕТ №17 (2).
БИЛЕТ №6 (2).
БИЛЕТ №18 (1).
БИЛЕТ №20 (2).
БИЛЕТ №17.
БИЛЕТ №18.
БИЛЕТ №19.
БИЛЕТ №20.
БИЛЕТ №21.
Волновые свойства света.
Свет – это электромагнитные волны с длиной волны от 4٠10-7 м до 8٠10-7 м.
Скорость света в вакууме равна 3٠108 м/с.
Основные волновые свойства света: интерференция и дифракция.
Интерференция – это сложение двух световых волн, в результате которого в одних точках пространства происходит усиление амплитуды результирующей волны, а в других – гашение волн.
Усиление света произойдёт в том случае, если одна световая волна отстанет от другой на целое число длин волн (условие максимумов).  или
или  ,
,
где  ,
, 
Если же вторая волна отстанет от первой на половину длины волны или на нечётное число полуволн, то произойдёт ослабление света (условие минимумов). 
где 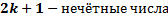
Для наблюдения интерференции необходимо, чтобы волны были когерентными, т.е. имели одинаковую частоту и постоянную разность фаз.
Когерентные волны образуются при прохождении света через тонкие плёнки или стеклянные пластинки. Этим объясняется окраска мыльных пузырей и масляных плёнок на воде, хотя мыльный раствор и масло бесцветны.
БИЛЕТ № 1.
2. Основными элем. частицами, участвующими в образовании химической связи являются валентные электроны. Характером перемещений валентных электронов определяется тип химической связи.
- 1. Ковалетная неполярная и полярная связь:
ков. неполярная связь между атомами одинаковых элементов
ков. полярная связь между разными атомами.
- 2. Ионная связь – если взаимодействуют атомы, сильно отличающиеся по своей электроотрицательности.
- 3. Водороджная связь – если вещество имеет молекулярное строение. Эти связи возникают между атомами водорода и сильно электро – отрицательными атомами
( ) – вода, спирты и т.д.
- 4. Металлическая связь – существует в металлах. Валентные электроны металлов легко покидают свои орбитали.
- 5. Простые и кратные связи.
* если два атома соединены одной электронной парой – простая одинарная связь;
* если две или три электронные пары – то возникают кратные связи: двойная или тройная (например ……………………………………………………………..).
Клеточная теория. Типы клеточной организации и основные положения.
Клеточная теория — важнейшее биологическое обобщение, согласно которому все живые организмы состоят из клеток. Изучение клеток стало возможным после изобретения микроскопа. Впервые клеточное строение у растений (срез пробки) обнаружил английский ученый, физик Р. Гук, он же предложил термин «клетка» (1665 г.). Голландский ученый Антони ван Левенгук впервые описал эритроциты позвоночных, сперматозоиды, разнообразные микроструктуры растительных и животных клеток, различные одноклеточные организмы, в том числе бактерии и пр.
В 1831 г. англичанин Р. Броун обнаружил в клетках ядро. В 1838 г. немецкий ботаник М. Шлейден пришел к выводу, что ткани растений состоят из клеток. Немецкий зоолог Т. Шванн показал, что из клеток состоят и ткани животных. В 1839 г. вышла книга Т. Шванна «Микроскопические исследования о соответствии в структуре и росте животных и растений», в которой он доказывает, что клетки, содержащие ядра, представляют собой структурную и функциональную основу всех живых существ. Основные положения клеточной теории Т. Шванна можно сформулировать следующим образом.
1. Клетка — элементарная структурная единица строения всех живых существ.
2. Клетки растений и животных самостоятельны, гомологичны друг другу по происхождению и структуре.
М. Шдейден и Т. Шванн ошибочно считали, что главная роль в клетке принадлежит оболочке и новые клетки образуются из межклеточного бесструктурного вещества. В дальнейшем в клеточную теорию были внесены уточнения и дополнения, сделанные другими учеными.
Еще в 1827 г. академик Российской АН К.М. Бэр, открыв яйцеклетки млекопитающих, установил, что все организмы начинают свое развитие с одной клетки, представляющей собой оплодотворенное яйцо. Это открытие показало, что клетка является не только единицей строения, но и единицей развития всех живых организмов.
В 1855 г. немецкий врач Р. Вирхов приходит к выводу, что клетка может возникнуть только из предшествующей клетки путем ее деления.
На современном уровне развития биологии основные положения клеточной теории можно представить следующим образом.
1. Клетка — элементарная живая система, единица строения, жизнедеятельности, размножения и индивидуального развития организмов.
2. Клетки всех живых организмов сходны по строению и химическому составу.
3. Новые клетки возникают только путем деления ранее существовавших клеток.
4. Клеточное строение организмов — доказательство единства происхождения всего живого.
Типы клеточной организации
Выделяют два типа клеточной организации: 1) прокариотический, 2) эукариотический. Общим для клеток обоих типов является то, что клетки ограничены оболочкой, внутреннее содержимое представлено цитоплазмой. В цитоплазме находятся органоиды и включения. Органоиды — постоянные, обязательно присутствующие, компоненты клетки, выполняющие специфические функции. Органоиды могут быть ограничены одной или двумя мембранами (мембранные органоиды) или не ограничены мембранами (немембранные органоиды). Включения — непостоянные компоненты клетки, представляющие собой отложения веществ, временно выведенных из обмена или конечных его продуктов.
В таблице перечислены основные различия между прокариотическими и эукариотическими клетками.
| Признак | Прокариотические клетки | Эукариотические клетки |
| Структурно оформленное ядро | Отсутствует | Имеется |
| Генетический материал | Кольцевые не связанные с белками ДНК | Линейные связанные с белками ядерные ДНК и кольцевые не связанные с белками ДНК митохондрий и пластид |
| Мембранные органоиды | Отсутствуют | Имеются |
| Рибосомы | 70-S типа | 80-S типа (в митохондриях и пластидах — 70-S типа) |
| Жгутики | Не ограничены мембраной | Ограничены мембраной, внутри микротрубочки: 1 пара в центре и 9 пар по периферии |
| Основной компонент клеточной стенки | Муреин | У растений — целлюлоза, у грибов — хитин |
К прокариотам относятся бактерии, к эукариотам — растения, грибы, животные. Организмы могут состоять из одной клетки (прокариоты и одноклеточные эукариоты) и из множества клеток (многоклеточные эукариоты). У многоклеточных происходит специализация и дифференциация клеток, а также образование тканей и органов.
Методы изучения клеток: 1) световая микроскопия, 2) электронная микроскопия, 3) дифференциальное ультрацентрифугирование, 4) рентгеноструктурный анализ, 5) хроматография, 6) электрофорез, 7) микрохирургия, 8) метод культуры клеток и др.
БИЛЕТ №2.
Последнее изменение этой страницы: 2016-06-09
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...