
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Между комплексообразователем и лигандами -ковалентные связи, образованные по донорно-акцепторному механизму.
Между комплексообразователем и лигандами -ковалентные связи, образованные по донорно-акцепторному механизму.
 донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)
донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)

Атом Аl (р-элемент) … 3s23р1
Комплексообразователь Al3+:



 3s03p0
3s03p0


 :Br- :Br-:Br- :Br-
:Br- :Br-:Br- :Br-
 |
sp3-гибридизация орбиталей.
Строение комплексного иона - тетраэдр

| |||
 |
|
в противном случае - лиганд слабого поля.

Для 3d-элементов - (в порядке возрастания силы поля):
|
Однако границы между сильным и слабым полями лигандов провести сложно, например:
[MnF6]2- лиганд F- - слабое поле,
[NiF6]2- лиганд F- - сильное поле.

Атом Fe (d -элемент) … 3 d 64s2
Комплексообразователь Fe3+: 3d 54s0
Лиганды CN- - лиганды сильного поля,
|


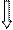






Fe+3
3d 4s 4p
d2sp3-гибридизация орбиталей
структура комплекса - октаэдр
 | |||
 |
· Лиганды располагаются вокруг комплексообразователя так, чтобы силы притяжения были максимальны, а силы отталкивания минимальны.
· Лиганды влияют на энергетическое состояние d-электронов комплексообразователя.
В отсутствии внешнего электростатического поля все d-орбитали - вырожденные.

D - зависит от к.ч., природы лигандов и комплексообразователя (учебник, стр.78)
плоский квадрат
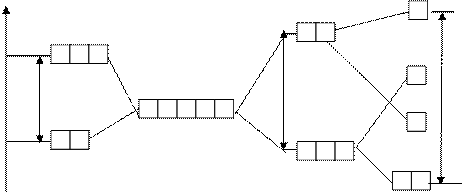 |
октаэдр
тетраэдр
de dg
Dтетр Dокт Dквадр.пл.
dg (n-1)d-орбитали de
свободного иона
комплексообразователя
 | |||
 |
 |
Распределение электронов на (n-1)d-орбиталях:
(зависит от силы поля лиганда)
 |
● В образовании химической связи участвуют :
(n-1)dg-, ns-, np- и nd- орбитали.

■ комплексообразовательСо2+: 3d 74s0
■ К.ч. 6 Þ октаэдрическое расщепление
■ центральный атом – 3d – элемент Þ сила поля лиганда по спектрохимическому ряду:
Н2О – лиганд среднего поля, а для Со2+ (низшая степень окисления) он относится к слабым.

:н2о:н2о:н2о:н2:н2о:н2о

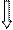














 Е
Е

3dg 4s 4p 4d
 |




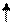

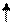
 3de
3de
● sp3d2-гибридизация
● структура комплекса [Со(Н2О)6]2+ - октаэдр
● комплекс – высокоспиновый,
внешнеорбитальный (т.к. взаимодействует внешний d- подуровень).
Высокоспиновые комплексы менее прочные, чем низкоспиновые.

 |
· Если на (n-1)de,g - орбиталях имеются неспаренные электроны, комплекс –
парамагнетик (слабые магнитные свойства)
· Если на (n-1)dg,e – орбиталях нет неспаренных электронов, комплекс -диамагнетик ( нет магнитных свойств)
Þ [Со(Н2О)6]2+ - парамагнетик

■ комплексообразователь Pt4+: 5d 66s0
■ Комплексообразователь 5d- элемент Þ лиганды сильного поля
■ К.ч. 6 Þ октаэдрическое расщепление 5d- орбиталей.

Е :Br-:Br- :Br- :Br- :Br-:Br-
 |
5dg
6s 6p
5d 5de

● d2sp3 – гибридизация
● структура комплекса - октаэдр
● комплекс - внутриорбитальный,
устойчивый, т.к. участвуют внутренние 5dg-
Орбитали
● комплекс - низкоспиновый, диамагнетик,
Таблица. Структура комплексов в зависимости
От вида гибридизации
| К.ч. | компл- обр-ль | лиганды | Гибридизация орбиталей | Структура комплекса |
| любой | Sp | линейная | ||
| 3d-элемент | все слабого поля | d3s, d2sp, sp3 | тетраэдр | |
| 4d, 5d-элемент | все сильного поля | dsp2 | плоский квадрат | |
| любой | d2sp3, sp3d2, dsp3d | октаэдр |

(ученик, стр.81)
Т.к. разность энергии (D) между dg - и de -орбиталями небольшая, возможен переход электрона с более низкого на более высокий уровень энергии за счет поглощения видимого света. Этот переход является причиной определенной окраски комплекса,
т.е. окраска зависит от того, фотоны какой длины волны могут этим комплексом поглощаться.
При этом энергия кванта света должна быть точно равна энергии расщепления D, т.е. h×n=D . Зная длину волны света ( l=c/n ), соответствующую окраске комплекса, можно рассчитать для того или иного лиганда D=ch/l .
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду левее (т. е. обладающие большей силой поля), значение D возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это сказывается на изменении его окраски. Например,
(Со(ONO)(NH3)5)2+- красный
(Co(NO2)(NH3)5)2+ - желтый
(CuCl4)2- - зеленый
(Cu(H2O)4)2+ - голубой
(Cu(NH3)4)2+ - сине-фиолетовый
Фиолетовый 400 – 420 желтый 575 – 585
Голубой 424 – 490 оранжевый 585 – 647
Зеленый 490 –575 красный 647 – 710
Между комплексообразователем и лигандами -ковалентные связи, образованные по донорно-акцепторному механизму.
 донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)
донор – лиганд (поставщик пары электронов ↑↓) акцептор– комплексообразователь(наличие свободных АО)

Атом Аl (р-элемент) … 3s23р1
Комплексообразователь Al3+:



 3s03p0
3s03p0


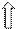
 :Br- :Br-:Br- :Br-
:Br- :Br-:Br- :Br-
 |
sp3-гибридизация орбиталей.
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...
