
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Определение истинных формул химических соединений по процентному составу и молекулярной массе
Количественный состав химического соединения дает возможность вычислить соотношение чисел атомов отдельных элементов, образующих молекулу данного соединения, но ничего не говорит об истинном числе этих атомов. Так, исходя из состава соединения, содержащего 2,24 % водорода, 26,68 % углерода, 71,08 % кислорода, находим, что числа атомов Н, С и О в его молекуле относятся друг к другу, как
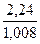 :
: 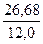 :
:  = 2: 2: 4 = 1: 1: 2.
= 2: 2: 4 = 1: 1: 2.
Такое соотношение отвечает как формуле НСО2, так и формулам Н2С2О4, Н3С3О6 и т. д. Чтобы сделать вывод об истинной формуле химического соединения, надо определить его молекулярную массу. Если она окажется равной 90, то вопрос тем самым решится в пользу формулы Н2С2О4.
О молекулярной массе химического соединения в состоянии газа или пара можно судить по его плотности. Как уже упоминалось, из закона Авогадро вытекает, что массы равных объемов различных газов, взятых при одинаковых условиях, относятся друг к другу как их молекулярные массы. Но отношение этих масс представляет собой число, показывающее, во сколько раз один газ тяжелее или легче другого, т. е. плотность одного газа по отношению ко второму, взятому для сравнения:
 = D,
= D,
где МА и МВ – молекулярные массы газов А и В, а D – плотность газа А относительно газа В. Отсюда
МА= МвD.
Определяя мольную массу Мх некоторого вещества исходя из его плотности по водороду DН, можно пользоваться следующим выражением:
Мх = 2,016DН.
Для вычислений, не требующих большой точности, это выражение читается так: молекулярная масса вещества, находящегося в газообразном или парообразном состоянии, равна его удвоенной плотности по водороду.
Если взять для сравнения кислород или воздух, то
Мх = 32Dк или Мх = 29Dвозд,,
где Dк и Dвозд – плотности исследуемого вещества по кислороду и воздуху, а 29 – средняя молекулярная масса воздуха (масса 22,4 л воздуха при 0 оС и 101,3 кПа составляет 29 г).
Пример. Соединение содержит 82,64 % углерода и 17,36 % водорода. Плотность его по водороду 28,8. Найти истинную формулу соединения.
 Решение
Решение
 =82,64 %
=82,64 %
 =17,36 %
=17,36 %  =
= 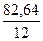 = 2,5:1= 5:2.
= 2,5:1= 5:2.
 DH = 28,8 Мх = 2,016∙28,8 = 58 г/моль
DH = 28,8 Мх = 2,016∙28,8 = 58 г/моль
МС = 12 г/моль
МН = 1,008 г/моль
Ответ. Простейшая формула отвечает составу С2Н5. Молекулярная масса соединения равна 58 г/моль. Следовательно, истинная формула отвечает составу С4Н10.
Задачи
76. Некоторое соединение содержит 75,76 % As и 24,24 % О. Плотность его паров по воздуху составляет 13,65. Найти истинную формулу соединения. Какова будет его формула, если при повышении температуры плотность пара уменьшится в два раза?
77. Соединение содержит 45,15 % углерода, остальное – азот. Плотность по воздуху равна 1,79. Найти истинную формулу соединения.
78. Соединение содержит 24,26 % С, 71,62 % Cl и 4,12 % Н. Плотность по водороду 49,1. Найти истинную формулу соединения.
79. Соединение бора с водородом содержит 78,18 % бора, остальное – водород. Плотность по водороду 13,71. Найти его истинную формулу.
80. Соединение бора с фтором содержит 84,04 % F. Плотность по воздуху 2,34. Найти истинную формулу.
81. Соединение водорода с мышьяком содержит 3,85 % Н. Плотность по воздуху 2,7. Найти истинную формулу.
82. Фторид водорода содержит 95 % фтора. При некоторой температуре плотность его паров по водороду равна 20. Какова истинная формула фторида водорода? Каков будет состав молекулы, если плотность при повышении температуры достигнет 10?
83. Некоторое соединение содержит 54,50 % углерода, 36,34 % кислорода, остальное – водород. Плотность по воздуху 3,04. Найти истинную формулу.
84. Соединение углерода с водородом содержит 92,26 % углерода, остальное – водород. 0,195 г этого соединения заняло при 27 оС и 101,3 кПа объем, равный 61,5 мл. Какова истинная формула соединения?
85. Соединение серы с фтором содержит 62,8 % S и 37,2 % F. Масса 118 мл данного соединения в форме газа, измеренного при 7 оС и 98,64 кПа равна 0,51 г. Какова истинная формула соединения?
86. При сжигании некоторого соединения азота с водородом получено из 0,24 г вещества 0,27 г Н2О и 168 мл азота (при 0 оС и 101,3 кПа). Плотность пара азотсодержащего вещества по воздуху 1,1. Какова истинная формула вещества?
87. Массовые доли серы и кислорода в оксиде серы равны соответственно 40 и 60 %. Определите простейшую формулу этого оксида.
88. Массовая доля хлора в хлориде фосфора составляет 77,5 %. Определите простейшую формулу хлорида.
89. В состав химического соединения входят натрий, фосфор и кислород. Массовые доли элементов составляют (%): натрия – 34,6, фосфора – 23,3, кислорода – 42,1. Определите простейшую формулу соединения.
90. Некоторая кислота содержит водород (массовая доля 2,2 %), иод (55,7 %) и кислород (42,1 %). Определите простейшую формулу этой кислоты.
91. В оксиде молибдена отношение массы молибдена к массе атомного кислорода равно 2. Определите простейшую формулу оксида.
92. Образец соединения фосфора и брома массой 81,3 г содержит фосфор массой 9,3 г. Определите простейшую формулу этого соединения.
93. Молярная масса соединения азота с водородом равна 32 г/моль. Определите формулу этого соединения, если массовая доля азота в нем составляет 87,5 %.
94. Определите простейшую формулу соединения алюминия с углеродом, если известно, что массовая доля алюминия в нем составляет 75 %.
95. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7, 34,8 и 40,5 %.
96. При сжигании 0,1 моль некоторого простого вещества образовалось 0,1 моль оксида, массовая доля кислорода в котором равна 43,6% . Плотность паров этого вещества по воздуху равна 7,6. Установите молекулярную формулу сжигаемого вещества и образующегося оксида.
97. При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл?
98. При разложении 21 г карбоната двухвалентного металла выделилось 5,6 л оксида углерода (IV) (при н. у.). Установите формулу соли.
99. Определите простейшую формулу вещества, если известно, что мольная доля в нем Ag = 7,69 %, N = 23,08 %, Н = 46,15 %, О = 23,08 %.
100. Определите простейшую формулу щавелевой кислоты, если известно, что в 20 г этой кислоты содержится 0,444 г водорода, 5,33 г углерода, остальное — кислород.
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...