
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Глинка Н.Л.Общая химия.- Л.: Химия, 2006 .
Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Курс общей химии.- М.: Высшая школа, 1990 .
Коровин Н.В. Общая химия.- М.: Высшая школа, 2002.
Глинка Н.Л. Задачи и упражнения по общей химии.- Л.:Химия,2008.
Коровин Н.В, Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии.- М.:Высшая школа, 2008.
Коровин Н.В. Общая химия.- М.: Высшая школа, 2008.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ РАБОТ
| номер варианта | номера задач к данному заданию | номер варианта | номера задач к данному заданию |
| 1 19 37 55 73 | 16 36 54 72 77 | ||
| 2 20 38 56 74 | 17 19 38 56 78 | ||
| 3 21 39 57 75 | 18 20 39 57 79 | ||
| 4 22 40 58 76 | 1 21 40 58 80 | ||
| 5 23 41 59 77 | 3 22 41 59 81 | ||
| 6 24 42 60 78 | 4 23 42 60 82 | ||
| 7 25 43 61 79 | 5 24 43 61 83 | ||
| 8 26 44 62 80 | 6 25 44 62 84 | ||
| 9 27 45 63 81 | 7 26 45 63 85 | ||
| 10 28 46 64 82 | 8 27 46 64 86 | ||
| 11 29 47 65 83 | 9 28 47 65 87 | ||
| 12 30 48 66 84 | 10 29 48 66 88 | ||
| 13 31 49 67 85 | 11 30 49 67 89 | ||
| 14 32 50 68 86 | 12 31 50 68 90 | ||
| 15 33 51 69 87 | 13 32 51 69 73 | ||
| 16 34 52 70 88 | 14 33 52 70 74 | ||
| 17 35 53 71 89 | 15 34 53 71 75 | ||
| 18 36 54 72 90 | 16 35 54 72 76 | ||
| 1 20 40 57 77 | 17 36 39 59 77 | ||
| 2 21 41 58 78 | 18 22 40 60 78 | ||
| 3 22 42 59 79 | 4 23 41 61 79 | ||
| 4 23 42 60 80 | 5 24 42 62 80 | ||
| 5 24 43 61 81 | 6 25 43 63 81 | ||
| 6 25 44 62 82 | 7 26 44 64 82 | ||
| 7 26 45 63 83 | 8 27 45 65 83 | ||
| 8 27 46 64 84 | 9 28 46 66 84 | ||
| 9 28 47 65 85 | 10 29 47 67 85 | ||
| 10 29 48 66 86 | 11 30 48 68 86 | ||
| 11 30 49 67 87 | 12 31 49 69 87 | ||
| 12 31 50 68 88 | 13 32 50 70 88 | ||
| 13 32 51 69 89 | 14 33 51 71 89 | ||
| 14 33 52 70 90 | 15 34 52 72 90 | ||
| 15 34 53 71 73 | 16 35 53 55 74 | ||
| 16 35 37 72 74 | 17 36 54 56 75 | ||
| 17 36 38 55 75 | 18 19 40 57 76 | ||
| 18 21 39 56 76 | 1 20 41 58 77 | ||
| 2 22 40 58 77 | 2 21 42 59 78 | ||
| 3 23 41 58 78 | 3 22 43 60 79 | ||
| 4 24 42 59 79 | 4 23 44 61 80 | ||
| 5 25 43 60 80 | 5 24 45 62 81 | ||
| 6 26 44 61 81 | 6 25 46 63 82 | ||
| 7 27 45 62 82 | 7 26 47 64 83 | ||
| 8 28 46 63 83 | 8 27 48 65 84 | ||
| 9 29 47 64 84 | 9 28 49 66 85 | ||
| 10 30 48 65 85 | 10 29 50 67 86 | ||
| 11 31 49 66 86 | 11 30 51 68 87 | ||
| 12 32 50 67 87 | 12 31 52 69 88 | ||
| 13 33 51 68 88 | 13 32 53 70 89 | ||
| 14 34 52 69 89 | 14 33 54 71 90 | ||
| 15 35 53 70 90 | 15 34 37 72 76 |
ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Энергетика (термодинамика) химических процессов.
Внутренняя энергия системы. Теплота. Работа. I закон термодинамики. Энтальпия. Энтальпия образования вещества. Энтальпия реакции. Энтропия. II закон термодинамики. Изменение энтропии при химических процессах. Энергия Гиббса образования вещества. Энергия Гиббса реакции. Направленность химических процессов.
Термодинамика изучает законы перехода различных видов энергии. При химических реакциях эти изменения сопровождаются поглощением или выделением энергии в виде теплоты. Реакции, которые сопровождаются поглощением теплоты, называются эндотермическими, а реакции, сопровождающиеся выделением теплоты - экзотермическими.
Каждая система при постоянных физических условиях обладает определенным запасом энергии, называемым внутренней энергией системы /U/.Она состоит из энергии движения и местоположения, молекул, атомов, ядер и электронов, а также энергии, обусловленной силами притяжения и отталкивания между ними. Однако внутренняя энергия не включает кинетическую энергию движения системы в целом и потенциальную энергию положения системы в пространстве.
При любом процессе соблюдается закон сохранения энергии. Теплота (q) подведённая к системе, расходуется на изменение внутренней энергии (Δ U) и на совершение работы (А).
q = Δ U + A
При постоянном давлении (это большинство химических процессов) работа – это работа по изменению объёма, т.е. А = p · Δ V, где р - давление в системе, а Δ V- изменение объёма системы (Vкон. - Vнач.)
В этом случае q p = Δ U + p · Δ V
или q p = (Uкон. – Uнач.) + p (Vкон. – Vнач.)
q p = (Uкон. + pVкон.) – (Uнач. + р Vнач.)
Сумму U + pV обозначают через H и называют энтальпией.Отсюда теплота реакции (тепловой эффект) при постоянном давлении равна изменению энтальпии системы:
q p = Hкон. – Hнач. = Δ Н
Энтальпия – термодинамическая функция состояния системы, поэтому абсолютное значение энтальпии системы определить невозможно и рассчитывают только изменение энтальпии (Δ Н). В термохимическихрасчётах энтальпия всегда выражается через Δ Н. Для сравнения энтальпии (тепловых эффектов) различных процессов значения этих величин приводят к одинаковым условиям, и в таблицах представлены стандартные значенияэнтальпии ( 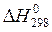 ). В качестве стандартных условий выбраны:
). В качестве стандартных условий выбраны:
температура 298 К (25 0С)
давление 101,3 кПа (1 атм).
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ПРОСТЫХ ВЕЩЕСТВ принимается равной нулю, если их агрегатные состояния и модификации при стандартных условиях устойчивы.
Например: 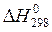 графита/тв/ = 0,0 кДж/моль
графита/тв/ = 0,0 кДж/моль
 алмаза/тв/ = 1,9 кДж/моль
алмаза/тв/ = 1,9 кДж/моль
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ СЛОЖНОГО ВЕЩЕСТВА равна энтальпии реакции образования одного моль этого вещества из простых веществ.
Пример 1. Энтальпия образования воды:
2H2(г) + O2(г) =2H2O(г)  = - 484кДж.
= - 484кДж.
Отсюда следует, что энтальпия образования воды в газовой фазе равна - 484кДж : 2моль = -242 кДж/моль
ЭНТАЛЬПИЯ РЕАКЦИИИ рассчитывается из следствия закона Гесса: «Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов».
ΔНр = ∑(n∙ΔH)прод. - ∑(n∙ΔH) исх.,
где n – число молей.
Пример 2. Рассчитать тепловой эффект реакции. Указать эндо- или экзотермическая реакция при стандартных условиях.
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
Число молей,n 4 5 4 6
Энтальпия,  -46,0 0 +91,0 -242,0
-46,0 0 +91,0 -242,0
∆Н0реакции = [4(+91)+6(-242)]-[4(-46)+5·0]= -904кДж.
Так как ∆ Н< О, данный процесс сопровождается выделением тепла, т.е. является экзотермическим.
Таблица № 1
Значения термодинамических функций в стандартных условиях
| Вещество | Агрегатное состояние |  кДж/моль кДж/моль
|  Дж/моль оК Дж/моль оК
|  кДж/моль кДж/моль
|
| 1 | 2 | 3 | 4 | 5 |
| Al Fe O2 H2 C Al2O3 CO CO2 CH4 C2H2 C3H8 C4H10 CaO Ca(OH)2 CaCO3 Fe2O3 Fe3O4 Na2CO3 MgO MgCO3 H2O H2O H2S SO2 SO3 P2O5 NO NH3 | ТВ. ТВ. Г. Г. Графит ТВ. Г. Г. Г. Г. Г. Г. ТВ. ТВ. ТВ. ТВ. ТВ. ТВ. ТВ. ТВ. Ж. Г. Г. Г. Г. ТВ. Г. Г. | - 1676,8 - 110,6 - 393,8 - 74,9 - 226,8 - 95,4 - 101,2 - 635,0 - 986,8 - 1207,0 - 822,7 - 1117,9 - 1137,5 - 601,8 - 1113,0 - 286,4 - 242,0 - 20,9 - 297,2 - 376,2 - 1492,0 91,0 - 46,0 | 28,4 27,2 205,0 130,7 5,7 50,9 197,6 213,6 186,4 - - - 39,7 83,4 91,7 87,5 146,3 136,4 26,9 65,7 70,0 188,9 193,2 248,2 256,4 114,5 210,5 192,6 | -1563,3 -137,2 -394,4 -50,9 — — — -603,6 -899,2 -1128,4 -740,8 -1014,8 -1047,5 -569,6 -1029,3 -237,4 -228,8 -33,8 -300,4 -370,0 -1348,8 86,6 -16,6 |
Термодинамика устанавливает также направление самопроизвольного протекания процессов в данных условиях. При выяснении природы самопроизвольного протекания реакции было установлено, что самопроизвольные реакции сопровождаются экзотермическим эффектом (∆Н<Ο). Однако связь между снижением энтальпии системы и самопроизвольностью протекания процесса является недостаточным фактором.
Другим фактором определения самопроизвольности протекания процессов является термодинамическая функция называемая энтропией (S). Энтропия является мерой упорядоченности состояния системы. В ходе химической реакции энтропия системы изменяется. Это изменение называется энтропией реакции.
ЭНТРОПИЯ РЕАКЦИИ также рассчитывается по следствию закона Гесса.
∆Sp = ∑ (n · S) прод.— ∑ (n ∙ S) исх.
Пример 3. Рассчитать изменения энтропии системы при реакции в стандартных условиях.
N2(г) + О2(г) = 2NO(г)
Число молей, n 1 1 2
Энтропия  192 205 211
192 205 211
 = 2 · 211—(1 · 192 + 1·205) =14 Дж/моль. К
= 2 · 211—(1 · 192 + 1·205) =14 Дж/моль. К
Все процессы, которые протекают с уменьшением порядка системы, сопровождаются увеличением энтропии и наоборот. Самопроизвольно протекают процессы, идущие с увеличением энтропии. Для процессов протекающих в изобарно - изотермических условиях (p = const, T = const) движущей силой самопроизвольного процесса является стремление системы перейти в состояние с наименьшей энтальпией (энтальпийный фактор), либо с увеличением энтропии (энтропийный фактор). Устойчивому состоянию системы соответствует равенство этих факторов.
∆Н ═ Т ∙ ∆S
Термодинамическая функция, показывающая насколько система в данном состоянии отклонилась от равновесного, называется энергией Гиббса (G).
∆G = ∆Н − Т ∙ ∆S
Если: ∆G < 0, процесс может протекать самопроизвольно в прямом направлении;
∆G = 0, процесс в состоянии равновесия;
∆G > 0, процесс самопроизвольно в прямом направлении
проходить не может.
Из соотношения ∆G = ∆Н − Т ∙ ∆S видно, что самопроизвольно могут протекать процессы:
1. экзотермические: (∆Н < 0). Для которых: ∆S > 0.
2. эндотермические: ( ∆Н > 0). Для которых: ∆S > 0, но /Т·∆S/>/∆Н/,т.е. при высоких температурах.
ЭНЕРГИЯ ГИББСА РЕАКЦИИ также рассчитывается по следствию закона Гесса.
∆Gp = ∑ (n · ∆G) прод.— ∑ (n ∙ ∆G) исх.
Пример 4.Указать возможность самопроизвольного протекания реакции при стандартных условиях.
СО2(г) +С(графит) = 2СО(г)
Число молей, n 1 1 2
Энергия Гиббса,  -394 0 -137
-394 0 -137
 = [ 2 · (-137)] − [1 · (-394) + 1 · 0 ] = + 120 кДж/моль
= [ 2 · (-137)] − [1 · (-394) + 1 · 0 ] = + 120 кДж/моль
Так как  > 0, в данных условиях процесс невозможен.
> 0, в данных условиях процесс невозможен.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Рассчитать тепловой эффект реакции сгорания 448л метана: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(Г). при стандартных условиях.
2.Указать эндо- или экзотермическая реакция. Определить энтальпию реакции: CaCO3(TB) = CaO(TB) +CO2(г).при стандартных условиях.
3.Определить энтальпию образования карбоната натрия при стандартных условиях, если тепловой эффект реакции: Na2CO3(TB) + 2C(TB) = 2Na(TB) + 3CO(г) равен 805,7 кДж.
4.Процесс гашения извести водой выражается уравнением: CaO(ТВ) + H2O(ж) =Ca(OH)2(TB). Рассчитать тепловой эффект этой реакции при стандартных условиях.
5.Рассчитать количество тепла выделяющегося при сгорании 896 л ацетилена (С2Н2) при нормальных условиях: 2С2Н2(г) + 5О2(г) = = 4 СО2(г) + 2Н2О(г).
6.Определить количество тепла необходимого для восстановления 5 молей оксида железа (III) при стандартных условиях: Fe2O3(TB) + 3CO(г) = 2 Fe(TB) + 3CO2(г).
7.Рассчитать количество тепла выделяющегося при сгорании 2240 л бутана при нормальных условиях: 2C4H10(г) + 13O2(г) = 8CO2(г) + 10H2O(г).
8.Определить энтальпию реакции: Fe2O3(TB) + 3C(графит) = 2Fe(TB) + +3CO(г) при стандартных условиях.
9.Определить энтальпию образования этилена, если тепловой эффект реакции: C2H4(г) + 3О2(г) = 2СО(г) + 2Н2О(г) равен -1323 кДж.
10.Процесс восстановления оксида железа (III) водородом выражается уравнением: Fe2O3(TB) + 3H2(г) = 2Fe(TB) + 3H2O(г). Рассчитать тепловой эффект этой реакции при стандартных условиях.
11.Рассчитать тепловой эффект процесса сгорания 224 л водорода при нормальных условиях: 2H2(г) + O2(г) = 2H2O(г).
12.Определить этальпию образования карбоната магния, если тепловой эффект реакции: MgO(TB) + CO2(г) = MgCO3(TB) равен -118 кДж.
13.Процесс сгорания пропана выражается уравнением: C3H8(г) + 5O2 = 3CO2(г) +4H2O(г). Рассчитать тепловой эффект реакции сгорания 112л пропана при стандартных условиях.
14.Сколько теплоты выделиться при реакции: СО(г) + 3H2(г) = CH4(г)+ +H2O(г)?
15.Рассчитать энтальпию образования жидкого бензола, если тепловой эффект реакции сгорания: 2С6H6(Ж) +15O2(Г) = 12СO2(Г) +6H2O(Г) равен -3136кДж.
16.Определить энтальпию образования фосфата кальция, если тепловой эффект реакции:3CaO(TB) + P2O5(TB) = Ca3(PO4)2(TB) равен -739кДж.
17.Рассчитать энтальпию конденсации 224л водяного пара.
18.При образовании 1120мл (при стандартных условиях) оксида серы(IV) из простых веществ выделилось 14,8 кДж. Рассчитать энтальпию образования оксида серы (IV).
19.Указать возможность самопроизвольного протекания процесса: CaCO3(TB)= CaO+CO2(г) при стандартных условиях.
20.Прямая или обратная реакция будет протекать при стандартных условиях в системе: Fe2O3(TB) +3H2(Г) = 2Fe(TB) + 3H2O(Г)?
21.Рассчитать, при какой температуре возможна реакция: Fe2O3(TB) + 3CO(Г) =2Fe(TB) +3CO2(Г).
22.Определить возможность самопроизвольного протекания реакции: CH4(г) + 2O2(Г) = CO2(Г) + 2H2O(Г) при температуре 250С.
23.Прямая или обратная реакция будет протекать при стандартных условиях в системе: СH4(Г) + 3СO2(Г) = 4СO(Г) +2H2O(Г).
24.Рассчитать температуру, при которой возможно самопроизвольное протекание реакции: 2H2O(Ж) = 2H2(Г) + O2(Г).
25.Определить возможность самопроизвольного протекания реакции: 4Al(TB) +3CO2(Г) = 2Al2O3(TB) + 3C(ГРАФИТ) при стандартных условиях.
26.В каком направлении самопроизвольно будет протекать реакция в стандартных условиях: H2(Г) + CO2(Г) = CO(Г) + H2O(Ж).
27.Рассчитать, при какой температуре возможна реакция:
CaO(TB) +CO(Г) = CaCO3(TB).
28.Рассчитать при стандартных условиях энергию Гиббса реакции H2S (г) + 2O2(г) = H2O(г) + SO3(г). Указать возможность самопроизвольного протекания реакции.
29.Прямая или обратная реакция будет протекать при стандартных условиях в системе: 2CO(г) + O2(Г) = 2CO2(Г).
30.Рассчитать, при какой температуре возможна реакция: CO(Г) +3H2(Г) = СН4(г) + Н2О(Г).
31.Определить возможность самопроизвольного протекания реакции: 3Fe(TB) + 4H2O(Г) = Fe3O4(TB) + 4H2(Г) при стандартных условиях.
32.Прямая или обратная реакция будет протекать при стандартных условиях в системе: MgO(TB) + CO2(Г) = MgCO3(TB)?
33.Рассчитать, при какой температуре возможна реакция: Al2O3(TB) + 3H2(Г) = 2Al(TB) + 3H2O(Г).
34. Рассчитать энергию Гиббса при стандартных условиях для реакции: Na2CO3(TB) + 2C(TB) = 2Na(TB) + 3СO(Г).
35. Рассчитать, при какой температуре возможна реакция:
SO2(Г) + O2(Г) = SO3(Г).
36. Прямая или обратная реакция будет протекать при стандартных условиях в системе: CaO(TB) + H2O(ж) = Ca(OH)2(TB).
Последнее изменение этой страницы: 2016-07-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...