
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Предмет, задачи и значение химии. Атомно-молекулярное учение. Моль. Молярная масса.
Вопросы к экзамену по химии для гр. БТБ-11, 12
Предмет, задачи и значение химии. Атомно-молекулярное учение. Моль. Молярная масса.


Химия— наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.В зависимости от атомарной природы изучаемого вещества, типов химических связей между атомами различают неорганическую, органическую и элементоорганическую химии. Объектом неорганической химии являются все химические элементыи их соединения, другие вещества на их основе. Органическая химия изучает свойства обширного класса соединений, образованных посредством химических связей углерода с углеродом. Химия является общетеоретической дисциплиной. Она призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способах превращения одних веществ в другие. Знание основных химических законов, владение техникой химических расчетов, понимание возможностей, предоставляемых химией с помощью других специалистов, работающих в отдельных и узких ее областях, значительно ускоряют получение нужного результата в различных сферах инженерной и научной деятельности.
Химическая отрасль — одна из важнейших отраслей промышленности в нашей стране. Производимые ею химические соединения, различные композиции и материалы применяются повсюду: в машиностроении, металлургии, сельском хозяйстве, строительстве, электротехнической и электронной промышленности, связи, транспорте, космической технике, медицине, быту, и др. Главными направлениями развития современной химической промышленности являются: производство новых соединений и материалов и повышение эффективности существующих производств.
Для инженера:1)фундаментальные знания (любой процесс можно свести к физико-химии, мировоззренческий аспект, научное мировоззрение Игорь Кио.) 2)химические материалы3)хим методы в технологиях в самых разных процессах 4)электрохимич. размерная обработка, Электролитич. осаждение металлов, газотермическое покрытие.
Моля́рная ма́сса вещества — масса одного химических элементов молярной массой является масса одного моля отдельных атомовэтого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомнаяHYPERLINK "B%22атомнаяHYPERLINK%20%22http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F_%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%BC%D0%B0%D1%81%D1%81%D1%8B%22%20единица%20массы" единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Периодические функции.
Периодическая функция ― функция, повторяющая свои значения через какой-то регулярный интервал, то есть не меняющая своего значения при добавлении к аргументу фиксированного ненулевого числа (периода функции).
Говоря более формально, функция периодична, если существует такое число T≠0 (период), что на всей области определения функции выполняется равенство  .
.
Все тригонометрические функции являются периодическими.
Формальное определение
Пусть  есть абелева группа (обычно предполагается
есть абелева группа (обычно предполагается  — вещественные числа с операцией сложения или
— вещественные числа с операцией сложения или  — комплексные числа). Функция
— комплексные числа). Функция  (где
(где  — произвольное множество её значений) называется периодической с периодом
— произвольное множество её значений) называется периодической с периодом  , если справедливо
, если справедливо
 .
.
Если это равенство не выполнено ни для какого  , то функция
, то функция  называется апериодической.
называется апериодической.
Если для функции  существуют два периода
существуют два периода  , отношение которых не равно вещественному числу, то есть
, отношение которых не равно вещественному числу, то есть  , то
, то  называется двоякопериодической функцией. В этом случае значения
называется двоякопериодической функцией. В этом случае значения  на всей плоскости определяются значениями в параллелограмме, натянутом на
на всей плоскости определяются значениями в параллелограмме, натянутом на  .
.
Замечание
Период функции определён неоднозначно. В частности, если  — период, то и любой элемент
— период, то и любой элемент  вида
вида  (или
(или  , если в области определения функции определена операция умножения), где
, если в области определения функции определена операция умножения), где  — произвольное натуральное число, также является периодом.
— произвольное натуральное число, также является периодом.
Множество всех периодов функции образует аддитивную группу.
Однако если у множества периодов  имеется наименьшее значение, то оно называется основным (или главным) периодом функции.
имеется наименьшее значение, то оно называется основным (или главным) периодом функции.
Примеры
- Вещественные функции синус и косинус являются периодическими с основным периодом
 , так как
, так как

- Функция, равная константе
 , является периодической, и любое ненулевое число является её периодом. Основного периода функция не имеет.
, является периодической, и любое ненулевое число является её периодом. Основного периода функция не имеет.
- Функция Дирихле является периодической, её периодом является любое ненулевое рациональное число. Основного периода она также не имеет.
- Функция
 является апериодической.
является апериодической.
Ионная связь.
Ионная связь может быть представлена как крайний случай ковалентной связи. Химическая связь, образующаяся при взаимодействии наиболее электроотрицательных элементов с наименее электроотрицательными, называется ионной (В. Коссель, 1916).
Особенности ионной связи:
1) не направлена. Объясняется тем, что электрическое поле иона обладает сферической симметрией, поэтому взаимодействие между ионами осуществляется одинаково независимо от направления;
2) не насыщена. К данному сферическому иону может присоединиться различное число противоположных ионов.
Отсутствие у ионной связи направленности и насыщаемости обуславливает склонность ионных молекул к ассоциации, т.е. соединении их друг с другом.
Для определения типа связи используется шкала Л. Полинга:
1) разница в электроотрицательности атомов, образующих связь, равна нулю – связь ковалентная неполярная;
2) разница в электроотрицательности атомов, образующих связь, равна 0,5 – связь ковалентная полярная;
3) разница в электроотрицательности атомов, образующих связь, равна 2,1 – связь на 50 % ионная;
4) разница в электроотрицательности атомов, образующих связь, равна больше 2,1 – связь ионная.
Кроме шкалы Л. Полинга можно использовать значения дипольных моментов молекул и по этим значениям можно ориентировочно установить градацию:
− µ = 0 – связь неполярная ковалентная;
− 0 < µ < 3,90 D – связь ковалентная полярная;
− µ > 3,90 D – связь ионная.
Водородная связь.


Металлическая связь.


Задачи химической кинетики
Химическая кинетикатрактует качественные и количественные изменения в ходе химического процесса, происходящие во времени. Обычно эту общую задачу подразделяют на две более конкретные:
1) выявление механизма реакции — установление элементарных стадий процесса и последовательности их протекания (качественные изменения);
2) количественное описание химической реакции — установление строгих соотношений, которые могли бы удовлетворительно предсказывать изменения количеств исходных реагентов и продуктов по мере протекания реакции.
Также в зависимости от необходимости нахождения концентрации веществ по схеме реакции либо восстановление схемы по известным концентрациям ставится задача прямая или обратная.
1) Под прямой задачей химической кинетики понимают задачу нахождения концентраций участвующих в реакции веществ в любой момент времени, исходя из известных начальных концентраций, схемы реакции и констант скоростей отдельных стадий.
2) Обратная задача химической кинетики — восстановление по известной зависимости концентрации веществ от времени схемы реакции и констант скорости.
КИНЕТИЧЕСКОЕ УРАВНЕНИЕ, выражает зависимость скорости хим. р-ции от концентраций компонентов реакц. смеси. Для простой (одностадийной) гомог. р-ции скорость v пропорциональна произведению концентраций реагирующих в-в и кинетическое уравнение записывается в виде:

где [Ai] (i=1,2,...,l) - концентрация i-го в-ва, ni-порядок реакции по i-му в-ву, k-константа скорости р-ции.
МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ, число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) р-ции и превращающихся в продукты. Так, для р-ций в р-рах молекулярность реакции не учитывает число молекул р-рителя, образующих сольватную оболочку или мол. комплексы с реагентами, т. к. эти молекулы не входят в состав продуктов р-ции. В р-циях замещения и элиминирования орг. соед., протекающих часто в неск. стадий, молекулярность реакции оценивается как число молекул, претерпевающих хим. превращение в лимитирующей стадии. Соответственно числу реагирующих частиц различают мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции, отличающиеся кинетич. закономерностями и механизмом. Как правило, молекуляр-ность простой р-ции совпадает с порядком реакции, однако бывают и несовпадения. Напр., рекомбинации атомов в газовой фазе протекают через тройные столкновения типа  где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
Необратимая и обратимая реакции. Химическое равновесие. Константа равновесия. Принцип Ле-Шателье. Примеры.
Необратимые реакции: реакции которые протекают до конца до ионного израсходования одного из реагентов и образует продукты уходящие из сферы реакции в виде осадка, газа , монодиссоциирующего вещ. С большим выдилением теплоты
Обратимые реакции: реакции которые одновременно протекают в двух взаимно противоположных направлениях
Хим.равновесие: это такое состояние реагирующего вещ. При котором скорость прямой реакции равно скорости обратной реакции
Константа равновесия: при установление равновесия произведение концентрации продуктов реакции делимое на произведение концентрации исходного вещ. Величина постоянная
Принцип Ле-Шателье: внешнее воздействие на систему нах. В состояние равновесия приводит к смещению этого равновесия в направление ослабления этого воздействия
1) Влияние концентрации:
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
- При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
- При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
2)Влияние давления: при увиличение давления равновесие смещается в сторону уменьшения числа молекулы газообразных вещ. При уменьшение давления равновесие смещается в сторону возрастания числа молекул газообр. Вещ. , если реакция протекает без изменения числа молекул, то давление не влияет на положение равновесия в этой системе.
N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
3)влияние температуры: при повышение темп. Равновесие смещается в сторону эндотермической реакции, при понижение темпр. В сторону экзотермической реакции.
4) Влияние инертных газов Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
22. Гомогенная, гетерогенная, изолированная, системы. Первый закон термодинамики.
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы.
Примеры
- жидкие или твердые растворы (растворы — гомогенные (однородные) системы, т.е. каждый из компонентов распределен в массе другого в виде молекул, атомов или ионов)[1].
- лед
- смесь газов
Гетерогенная система— неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Число веществ (компонентов), термодинамических фаз и степеней свободы связаны правилом фаз. Примерами гетерогенных систем могут служить: жидкость — насыщенный пар; насыщенный раствор с осадком; многие сплавы. Твердый катализатор в токе газа или жидкости тоже гетерогенная система (гетерогенный катализ). В технике гетерогенной системой является кирпичная и каменная кладка, состоящая из кладочных элементов (кирпича, природных или искусственных камней, бетонных блоков и др.) и строительного раствора.
Изолированная система (замкнутая cистема) — термодинамическая система, которая не обменивается с окружающей средой ни веществом, ни энергией. В термодинамике постулируется (как результат обобщения опыта), что изолированная система постепенно приходит в состояние термодинамического равновесия, из которого самопроизвольно выйти не может (нулевое начало термодинамики).
Адиабатически изолированнаясистема — термодинамическая система, которая не обменивается с окружающей средой энергией в форме теплоты. Изменение внутренней энергии такой системы равно производимой над ней работе. Всякий процесс в адиабатически изолированной системе называется адиабатическим процессом.
На практике относительная адиабатическая изоляция достигается заключением системы в адиабатическую оболочку (например, сосуд Дьюара). Реальный процесс может также считаться адиабатическим, если он протекает достаточно быстро, так, что за короткое время теплообмен с окружающими телами пренебрежимо мал.
23. Термохимия. Термохимические уравнения. Стандартная теплота образования.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Формула
Закон Генри записывается обычно следующим образом:

где:
 — парциальное давление газа над раствором,
— парциальное давление газа над раствором,
 — молярная концентрация газа в растворе,
— молярная концентрация газа в растворе,
 — коэффициент Генри.
— коэффициент Генри.




Ионно-молекулярные уравнения.
Молекулярное уравнение это обычное уравнение, которыми мы часто пользуемся на уроке.
Например: NaOH+HCl -> NaCl+H2O
CuO+H2SO4 -> CuSO4+H2O
H2SO4+2KOH -> K2SO4+2H2O и т.д
Ионное уравнение.
Некоторые вещества растворяются в воде, образуя при этом ионы. Эти вещества можно записать с помощью ионов. А малорастворимые или труднорастворимые оставляем в первоначальном виде. Это и есть ионное уравнение.
Например: 1) CaCl2+Na2CO3 -> NaCl+CaCO3-молекулярное уравнение
Ca+2Cl+2Na+CO3 -> Na+Cl+CaCO3-ионное уравнение
Cl и Na остались такими же, какими они были до реакции, т.н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается:
Ca+CO3 -> CaCO3
2) NaOH+HCl -> NaCl+H2O-молекулярное уравнение
Na+OH+H+Cl -> Na+Cl+H2O-ионное уравнение
Na и Cl остались такими же, какими они были до реакции, т.н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается?
OH+H -> H2O
Произведение растворимости.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1·10−4 моль/л необходимо использовать произведение активностей:

где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
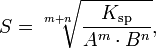
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
POH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:

как в любом водном растворе при 22 °C 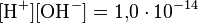 , очевидно, что при
, очевидно, что при
этой температуре:

Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Так как при 25 °C (стандартных условиях)[H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10−7, то у кислых растворов pH < 7, аналогично, у щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
Кислительно-восстановительные реакции (ОВР) (реакции окисления-восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается.
Окисление
Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см.Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисленияэлемента. Примеры: восстановление оксидовметаллов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизацияжиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Методы составления ОВР.
Особые случаи ОВР.
Окисли́тельно-восстанови́тельные реа́кции, ОВР,— окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Примеры
Окислительно-восстановительная реакция между водородом и фтором

Разделяется на две полуреакции:
1) Окисление:
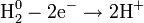
2) Восстановление:

Уравнение Нернста. ЭДС.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
[править]Вывод уравнения Нернста
 ,
,
где
·  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
·  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
·  — число мольэлектронов, участвующих в процессе;
— число мольэлектронов, участвующих в процессе;
·  и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант  и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим

Электролиз - это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать - расссказано дальше) и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливчаются друг от друга. Отличие - в наличии растворителя. При электрролизе растворов кроме ионов самого вещества в процессе учавствуют ионы растворителя. При электролизе расплавов - только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток. В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно - анод. Электрод, заряженный отрицательно - катод. При электролизе происходт окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
При электролизе расплавов в процессе учавствуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ - хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл - натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы.Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Первый закон Фарадея
Основная статья: Законы электролиза Фарадея
В 1832 годуФарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:

если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности  называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
 (1)
(1)
 (2)
(2)
 (3)
(3)
 (4)
(4)
 , где z — валентностьатома (иона) вещества, e — заряд электрона (5)
, где z — валентностьатома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим

 где
где 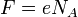 — постоянная Фарадея.
— постоянная Фарадея.


Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
 где
где  — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:

где  — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;  — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с;  — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1;  — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Электролиз находит весьма широкое применение. Для защиты металлических изделий от коррозии на их поверхность наносится тончайший слой другого металла — хрома, серебра, золота, меди, никеля и т.д. Иногда применяют многослойное покрытие. Например, внешние детали автомобиля сначала покрывают тонким слоем меди, на медь наносят тончайший слой никеля, а на него — слой хрома.
Нанесенные на металлы электролизом покрытия получаются ровными по толщине, прочными, служат долго, и, кроме того, таким способом можно покрывать изделия любой формы. Эту отрасль прикладной электрохимии называют гальваностегией. Кроме защиты от коррозии, гальванические покрытия иногда придают красивый декоративный вид предметам.
Другая отрасль электрохимии, близкая по принципу к гальваностегии, называется гальванопластикой. Это получение точных металлических копий с различных предметов. Предмет, с которого хотят изготовить копию, покрывают воском, дают воску застыть и получают восковую матрицу, на которой все углубления копируемого предмета будут выпуклостями. Внутреннюю поверхность матрицы покрывают тонким слоем графита, проводящим электрический ток. Этот графитовый катод опускают в ванную с раствором сульфата меди; анодом служит медь. При электролизе медный анод растворяется, а на катоде осаждается | медь. Таким образом получается точная копия предмета. С помощью гальванопластики изготовляют клише для печати, грампластинки, металлизируют различные предметы. Гальванотехника разработана русским ученым Б. С. Якоби (1838).
Электролиз используется для получения многих металлов — щелочных, щелочноземельных, алюминия, лантаноидов и др. также для очистки некоторых металлов от примесей
Вопросы к экзамену по химии для гр. БТБ-11, 12
Предмет, задачи и значение химии. Атомно-молекулярное учение. Моль. Молярная масса.


Химия— наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.В зависимости от атомарной природы изучаемого вещества, типов химических связей между атомами различают неорганическую, органическую и элементоорганическую химии. Объектом неорганической химии являются все химические элементыи их соединения, другие вещества на их основе. Органическая химия изучает свойства обширного класса соединений, образованных посредством химических связей углерода с углеродом. Химия является общетеоретической дисциплиной. Она призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способа
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...