
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Растворы электролитов. Теория Аррениуса. Диссоциация кислот, солей, оснований. Степень электролитической диссоциации.
Взаимодействие с растворителем растворенного вещества может вызвать распад последнего на ионы.
Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией или ионизацией веществ в растворах – С. Аррениус (1887 г) Провел исследования и установил ,что вещества диссациируют на ионы при отсутствие электрического тока и предложил теорию электролитической диссоциации.
Основные положения теории электролитической диссоциации:
1) электролиты при растворении в воде распадаются (диссоциируют) на положительные и отрицательные ионы;
2) под действием электрического тока положительно заряженные ионы движутся к катоду, отрицательно
заряженные ионы – к аноду. Поэтому первые называются катионами, вторые – анионами;
3) не все электроны в одинаковой степени распадаются на ионы
Вещества, распадающиеся в растворах или расплавах на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы, называются электролитами.
Электролиты при растворении в воде практически польностью диссоциирующие на ионы называются сильными.
Электролиты при растворении в воде, диссоциирующие на ионы лишь частично, называются слабыми.
Отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, называется степенью электролитической диссоциации (α):
α = Nи /No
где Nи – число молекул распавшихся на ионы; No – общее число молекул в растворе.
По степени диссоциации электролиты делятся на: сильные – α > 30 %; средней силы – 3 % < α > 30 %; слабые – α < 3 %.
Вант-Гоффа Я.Г. для использования уравнений, которые описывают свойства неэлектролитов, ввел в эти уравнения поправочный коэффициент i – изотонический коэффициент, Изотонический коэффициент зависит от
природы раствора и его концентрации, но для одного и того же раствора значение изотонического коэффициента одинаково. Таким образом, для растворов электролитов:
Росм = iсRT; (р° – р)/р° = iХА = inA/(nA + nB) = imA/MA(mA/MA + mB/MB);
∆t = iKcm = iKmр.в1000/Mmр-ля.
Отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, называется степенью электролитической диссоциации (α):
α = Nи /No
где Nи – число молекул распавшихся на ионы; No – общее число молекул в растворе.
По степени диссоциации электролиты делятся на: сильные – α > 30 %; средней силы – 3 % < α > 30 %; слабые – α < 3 %.
Закон разбавления Оствальда. Константа диссоциации.
Константа диссоциации зависит от природы элемента и растворителя, t°,но не зависит от концентрации раствора характеризующая способность данной кислоты или данного основания распадаться а ионы . Чем выше константа диссоциации тем легче электролит диссоциирует .
CH3COOH -> H + CH3COO
К равновесия = [ H ] * [ CH3COO2 ] / [ CH3COOH ]
Kg = α2 * c
α2 = kg/c закон освальда (1888 г)
Закон:
Степень диссоциации слабого электролита увеличивается, при разбавлении раствора обратно пропорционально корню квадратному из его малярной концентрации.
Константа диссоциации величина постоянная для слабых эликтролитов
Теория электролитической диссоциации для сильных электролитов. Активность. Коэффициент активности. Ионная сила.
Ионно-молекулярные уравнения.
Молекулярное уравнение это обычное уравнение, которыми мы часто пользуемся на уроке.
Например: NaOH+HCl -> NaCl+H2O
CuO+H2SO4 -> CuSO4+H2O
H2SO4+2KOH -> K2SO4+2H2O и т.д
Ионное уравнение.
Некоторые вещества растворяются в воде, образуя при этом ионы. Эти вещества можно записать с помощью ионов. А малорастворимые или труднорастворимые оставляем в первоначальном виде. Это и есть ионное уравнение.
Например: 1) CaCl2+Na2CO3 -> NaCl+CaCO3-молекулярное уравнение
Ca+2Cl+2Na+CO3 -> Na+Cl+CaCO3-ионное уравнение
Cl и Na остались такими же, какими они были до реакции, т.н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается:
Ca+CO3 -> CaCO3
2) NaOH+HCl -> NaCl+H2O-молекулярное уравнение
Na+OH+H+Cl -> Na+Cl+H2O-ионное уравнение
Na и Cl остались такими же, какими они были до реакции, т.н. они не приняли в нём участие. И их можно убрать и из правой, и из левой частей уравнения. Тогда получается?
OH+H -> H2O
Произведение растворимости.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1·10−4 моль/л необходимо использовать произведение активностей:

где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
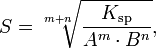
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Последнее изменение этой страницы: 2016-07-23
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...