
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Уравнение состояния идеального газа.
pV = RT = const, (85)
где R — газовая постоянная. [ Дж / кг٠К ].
Для 1 кмоля газа уравнение (85) имеет вид: pVμ = R0T (86)
где Vμ -объем 1кмоля при данных условиях; R0 - универсальная газовая постоянная, одинаковая для 1 кмоля любого газа: R0 = 8,31х1О3 Дж/(кмоль- К). (87)
Для произвольной массы газа М с молекулярной массой μ выражение (85) можно представить в виде: pV = ( M / μ ) RoT, (88)
где V — объем, занимаемый М кг газа; М/μ— число кмолей газа.
Уравнение (85) можно записать также в виде: pV = MRT. (89)
Газовая постоянная связана с универсальной газовой постоянной соотношением: R = R0 / μ (90)
Уравнения (88) и (89) называют характеристическими, поскольку с их помощью можно характеризовать состояние идеального газа.
Пример. Определить массу кислорода в баллоне емкостью 75 дм3 при давлении 9,8 МПа и темп. 20 °С.
Из характеристического уравнения (88) получим:
M = μ p V / R0 T = 32х9,8х106х0,075 /( 8,31х103 х293) = 9,66кг.
Первый закон термодинамики.
Равновесное и неравновесное состояния газа. Состояние системы газа может быть равновесным или неравновесным. Равновесным считают состояние, при котором параметры газа (р, V, Т) остаются неизменными сколь угодно долго, пока какие-либо внешние воздействия не выведут систему из этого состояния (предполагается отсутствие потоков масс, теплоты и др.). Равновесной системой является газ, находящийся в теплоизолированном цилиндре под поршнем, на который действует постоянная сила. Но газ, находящийся в цилиндре с подвижным поршнем, может перейти с некоторой скоростью из одного состояния в другое, например, расшириться или сжаться. При расширении газ, прилегающий непосредственно к поршню, находится под меньшим давлением, чем в других частях цилиндра; при сжатии, наоборот, его давление у поршня выше. Поэтому состояние газа в данном случае неравновесное. Газ также находится в неравновесном состоянии, если к цилиндру подводится или от него отводится теплота, поскольку температура слоев, прилегающих к источнику теплоты, отличается от температуры газа в других частях цилиндра.
Каждое равновесное состояние системы можно изобразить в системе координат одной точкой, координаты которой указывают определенное значение параметров системы.
Понятие о термодинамическом процессе. Последовательность изменения термодинамического состояния системы называют термодинамическим процессом. Он сопровождается в общем случае изменением всех или части параметров системы газа. Если термодинамический процесс осуществляется настолько медленно, что разностью параметров в различных частях системы можно пренебречь на всем протяжении перехода от одного состояния в другое, то такой переход можно считать состоящим из непрерывного ряда равновесных состояний (равновесным термодинамическим процессом).
Очевидно, при переходе газа из одного состояния в другое с конечной скоростью не соблюдается равенство параметров газа в различных частях системы и процесс этот не является равновесным.
Равновесный процесс можно представить в прямоугольной системе координат в виде линии, т. е. совокупности точек, каждая из которых представляет собой определенное равновесное состояние газа (рис.36). Все реальные процессы, протекающие с конечной скоростью, неравновесные, и их графическое изображение носит условный характер.
 p
p
(p1 , V1 )
 |
(p2 ,V2 )
 V
V
Рис. 36. График равновесного процесса.
Если в результате термодинамического процесса (назовем его прямым) система перешла из состояния 1 с параметрами р1,V1, T1 в состояние 2 с параметрами р2 ,V2 , T2, то любой другой процесс, приводящий систему из состояния 2 в состояние 1, называют обратным. Например, если расширение считать прямым процессом, то сжатие — процесс обратный.
Термодинамические процессы могут быть обратимыми и необратимыми. Обратимым называют равновесный процесс, который протекает в прямом и обратном направлениях, через один и тот же ряд равновесных состояний, не вызывая изменений в самом газе и в телах, окружающих систему. Неравновесные процессы необратимы. Все действительные процессы, встречающиеся в теплотехнике, практически необратимы.
Работа газа. Газ, находящийся в сосуде, при повышенном давлении стремится расшириться, т. е. увеличить занимаемый им объем. И если это не всегда осуществляется, то причина тому — внешние силы, воздействующие на газ и препятствующие этому расширению. Если, несмотря на препятствующие внешние силы, газ увеличился в объеме, то при этом газу пришлось совершить работу по преодолению этих сил. Аналогично при сжатии газа, находящегося в сосуде, приходится совершать работу по преодолению давления газа.
Чтобы определить работу сжатия или расширения газа, предположим, что некоторое количество газа находится в цилиндре под поршнем, скользящим без трения, к которому приложена внешняя сила F(рис. 37).






 P p1 V1P
P p1 V1P



 F 1 p = f(V)
F 1 p = f(V)

















 Δh р ΔL 2
Δh р ΔL 2



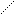
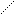
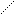
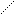



 P2V2 1
P2V2 1






 2
2
∆V V V1 dV V2 V
а. б.
Рис. 37 Сжатие газа в цилиндре. Рис. 38 Графическое определение работы термодинм. процесса.
Пусть в результате подвода теплоты газ расширился так, что его давление осталось неизменным, а поршень переместился вверх на некоторое расстояние ∆h. При этом газ совершил работу, равную произведению силы на пройденный путь. Если давление газа р, а площадь поперечного сечения поршня S, то сила давления равна pS, а совершаемая газом работа ∆L = pS∆h. Но произведение S∆h есть элементарное изменение объема ∆V, занимаемого газом. Таким образом: ∆L = p∆V. (91)
В общем случае при определении работы газа, который в результате термодинамического процесса (рис. 38а) перешел из состояния 1 с параметрами р1 , V1 , в состояние 2 с параметрами р2 , V2 , следует разбить кривую переходного процесса на большое число элементарных участков, на каждом из которых давление можно считать неизменным. На элементарном участке работа газа
∆L = p ∆V (92)
Для определения полной работы нужно провести суммирование элементарных работ: L =∑p ∆V (93)
Графически работа на диаграмме р, V изображается площадью поверхности между кривой и ординатами V1 и V2 (на рис. 38 заштрихована).
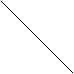
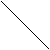
Работа по преодолению внешних сил зависит не только от начального и конечного состояний, но и от пути, по которому совершается процесс. Площадь, ограниченная кривой р = f1 (V) и ординатами V1 и V2 , не равна площади, ограниченной кривой Р = f2 (V) и теми же ординатами (рис.39). Не равны также и работы, совершаемые газом в этих процессах.
 p
p

 1 p=f1 (V)
1 p=f1 (V)











 2
2
























 p=f2 (V)
p=f2 (V)

 V
V
 V1 V2
V1 V2
Рис.39 Зависимость работы от характера протекания термодинамического процесса.
В СИ единицей работы и энергии является джоуль (Дж). Допускается применение внесистемной единицы — киловатт-час (кВт- ч): 1 кВт- ч= 1 кВт- 3600 с = 3,6-103 кДж = 3,6 МДж.
Сущность первого закона термодинамики.
Первый закон термодинамики представляет собой закон сохранения энергии применительно к термодинамическим процессам: энергия не исчезает и не возникает из ничего, а лишь переходит из одного вида в другой в эквивалентных количествах.Примером может служить переход теплоты в механическую работу, и наоборот.
Если к Мкг газа, занимающего при температуре Т объем Vм3, подвести при постоянном давлении некоторое количество теплоты ΔQ, то в результате этого температура газа повысится на ΔT, а объем — на ΔV. Повышение температуры связано с увеличением средней кинетической энергии хаотического движения молекул ΔK. Увеличение же объема приводит к увеличению расстояния между молекулами, а, следовательно, к изменению потенциальной энергии взаимодействия между ними ΔH. Вместе с тем, увеличивая свой объем, газ совершает работу ΔL по преодолению внешних сил.
Если, кроме указанных, никаких иных процессов в рабочем теле не происходит, то на основании закона сохранения энергии можно записать
Q = K +H +ΔL. (94)
Сумма K+H представляет собой изменение внутренней энергии системы молекул U в результате подвода теплоты. Тогда формулу (194) можно переписать следующим образом: Q = U + L (95)
или Q = U + pV (96)
Уравнение (95) представляет собой математическое выражение первого закона термодинамики:количество теплотыQ, подводимое к системе газа, затрачивается на изменение ее внутренней энергии U и совершение внешней работы L.
Для идеального газа, между молекулами которого нет взаимодействия, изменение внутренней энергии U полностью определяется изменением кинетической энергии хаотического движения молекул, а изменение объема характеризует работу по преодолению сил внешнего давления.
Условно считают, что при ΔQ > 0 теплота сообщается рабочему телу; при ΔQ < 0 теплота отнимается от тела; при ΔU > О внутренняя энергия тела увеличивается; при ΔU < О внутренняя энергия тела уменьшается; при ΔL > 0 система совершает работу (газ расширяется); при ΔL < 0 работа совершается над системой (газ сжимается).
При подводе конечного количества теплоты Q к газу на основании формулы (95) можно записать Q = U2 - U1 + L. Так как L зависит от характера процесса, при котором газ перешел из состояния 1 в состояние 2, то, очевидно, и Q зависит от характера этого процесса.
Первый закон термодинамики имеет еще формулировки:
Энергия изолированной термодинамической системы остается неизменной независимо от того, какие процессы в ней протекают.
Невозможно построить вечный двигатель первого рода, т. е. периодически действующую машину, которая совершала бы работу без затраты энергии.
Теплоемкость газов.
Понятие о теплоемкости. Чтобы повысить температуру единицы количества вещества на ΔT, необходимо сообщить ему теплоту Δq.Отношение: C = Δg / ΔT (97)
называют удельной теплоемкостью. Она показывает, какое количество теплоты необходимо подвести к единице количества вещества для нагревания его на 1К. В зависимости от выбранной единицы количества вещества различают массовую СM (отнесенную к 1 кг), киломольную Сμ (отнесенную к 1 кмолю) и объемную СV (отнесенную к 1 м3) удельные теплоемкости. В СИ единица удельной массовой теплоемкости Дж/(кг К), киломольной - Дж/(кмоль К), объемной - Дж/(м3 К).
Удельная теплоемкость газа зависит от способа подвода к нему теплоты. Действительно, на основании (96) и (97) можно записать:
C = Δq / ΔT = (Δu + pΔV) /ΔT = Δu /ΔT + pΔV /ΔT (98)
Величину p ΔV / ΔT называют удельной работой. Она показывает, какую работу совершает единица количества газа при повышении его температуры на 1 К.
Если при подводе к газу теплоты занимаемый им объем остаётся постоянным (V = const), то ΔV = 0 и удельная теплоемкость CV = Δu /ΔT , откуда: Δ u = CV ΔT. (99)
Если же при подводе к газу теплоты его давление остается постоянным (р = const) (например, если газ находится цилиндре под подвижным поршнем, на который действует постоянная внешняя сила), то на основании (98) и (99) удельная теплоемкость:
Cp = CV + p ΔV/ ΔT (100)
Следовательно, удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме на удельную работу. Уравнение состояния pV = RT, при р = const и изменяющихся V и T, будет иметь вид: р ΔV = R ΔT из него получим выражение удельной работы для идеальных газов: R = p ΔV/ ΔT (101)
Эта формула помогает уяснить физический смысл газовой постоянной. Она показывает, какую работу совершает единица количества газа при нагревании на 1 К, если теплота подводилась при постоянном давлении.
Из уравнения (116) следует уравнение Майера: Cp - CV = R. (102)
Для 1 кмоля можно записать:
μCр- μCV = μ ( Cp- CV ) = μ R = R0 = 8,31 103 Дж/(кмоль- К).
Для идеального газа Cp , и CV постоянны, поэтому и отношение Cp /CV = k также постоянно. (k – показатель адиабаты).
Нагревая идеальный газ от температуры Т1до T2 при постоянном объеме, необходимо подвести количество теплоты qV = CV (Т2 - T1), а для нагревания газа при постоянном давлении qp = Cp(Т2 - T1).
Зависимость теплоемкости от температуры. Истинная и средняя теплоемкость. Удельная теплоемкость реальных газов в отличие от идеальных газов зависит от давления и температуры.
При практическом решении теплотехнических задач пользуются понятием средней удельной теплоемкости в данном температурном интервале. Под средней удельной теплоемкостью ( сm ) понимают количество теплоты, которое в среднем надо затратить для нагревания единицы количества газа на 1 К в данном температурном интервале.
С учетом введенного понятия средней удельной теплоемкости количество теплоты необходимое для нагревания единицы количества газа на ∆T = T2 – T1,
q = сm 2 (Т2 - 273) - cm1 (Т1 - 273). (103)
Последнее изменение этой страницы: 2016-08-28
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...