
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Производство крахмала и крахмалопродуктов
Современная крахмал о-паточная промышленность, используя в основном традиционные источники сырья — картофель и кукурузу, — вырабатывает большой ассортимент продукции, включающий десятки наименований, которые используются в различных отраслях промышленности. В первую очередь это отрасли пищевой промышленности (кондитерская, хлебопекарная, молочная, консервная, пищеконцентратная и т.д.), а также другие отрасли (медицинская, текстильная, полиграфическая и др.).
Основными продуктами крахмало-паточного производства являются:
— сухой крахмал;
— модифицированные крахмалы: расщепленные крахмалы (окисленные и набухающие); замещенные крахмалы (фосфатные, ацетилированные, сополимеры крахмала);
— декстрины;
— различные виды крахмальных паток: карамельная (38 — 44% РВ), карамельная низкоосахаренная (30 — 34% РВ), глюкозная высокоосахаренная (44 — 60% РВ), мальтозная (не менее 60% РВ);
— глюкоза (техническая, пищевая, кристаллическая);
— глюкозо-фруктозные сиропы.
В настоящее время в России ведется поиск новых источников крахмала и разработка новых технологических приемов с целью увеличения объема и расширения ассортимента вырабатываемых сахаристых крахмало-продуктов. Одним из т.аких перспективных видов крахмалсодержащего сырья является зерновое сорго, которое может быть использовано наряду с картофелем, кукурузой, рисом и пшеницей. Кроме того, ведется поиск и исследование новых амилолитических ферментных препаратов и способов ферментативного получения сахарных сиропов (гидролизатов) различного углеводного состава с учетом их целевого назначения.
Применение амилаз.Ферментные препараты амилаз нашли широкое применение в технологиях получения различных паток и глюкозы.
Первой технологической операцией производства крахмальных гидролизатов является гидролиз крахмала. Его проводят кислотным, кислотно-ферментативным или ферментативным способом. Во всех случаях процесс гидролиза включает стадии клейстеризации крахмала, разжижения крахмального клейстера и его осахаривания.
Кислотный гидролиз в настоящее время осуществляется в основном, с применением соляной кислоты. При этом можно достичь различной степени гидролиза и получить гидролизаты с различной степенью осахаривания. Однако кислотный гидролиз крахмала, несмотря на дешевизну и быстроту процесса, имеет весьма существенные недостатки: получаемые гидролизаты имеют невысокое качество из-за присутствия в них продуктов деградации белков, а также минеральных примесей, которые образуются при нейтрализации кислоты после гидролиза.
Кислотно-ферментативным методом производят разжижение крахмала сначала кислотой, для этого суспензию крахмала подкисляют соляной кислотой до рН 1,8-2,5, нагревают до 140°С в течение 5 мин. Затем нейтрализуют раствором кальцинированной соды до рН 6,0 — 6,5 и охлаждают до 85°С, после чего добавляют ферментный препарат α-амилазы и ведут гидролиз в течение 30 мин.
С целью разжижения на этой стадии используют ферментный препарат амилосубтилин Г10Х. Этот препарат выпускается в виде порошка; содержит в основном α-амилазу и β-глюконазу. Оптимальные условия действия препарата: рН 6,2 — 6,8, температура — 85 — 87°С.
Осахаривание полученного гидролизата также проводят с использованием ферментов. Для этой цели наиболее широко применяют порошкообразный ферментный препарат глюкавомарин Г20Х.
Препарат содержит в основном глюкоамилазу. Оптимальные условия действия препарата глюкоавомарина Г20Х: оптимум рН 4,0 — 5,5; оптимум температуры 56 — 58°С.
Ферментативный способ заключается в том, что 30 — 35%-ю крахмальную суспензию прогревают до 55°С, доводят рН до 6,3 — 6,5, добавляют раствор ферментного препарата амилосубтилина Г1 ОХ и раствор кальцинированной соды в качестве стабилизатора. Процесс разжижения длится в течение 1 часа при температуре 85 — 90°С при непрерывном перемешивании. Далее стадия декстринизации и осахаривания проводится с использованием препаратов амилосубтилина ПОХ, амилоризина ПОХ и П10Х. Этот процесс идет 2 — 3 ч при температуре от 53 до 85°С и рН 4,7 — 5,5.
Дальнейшее осахаривание ведут при 60°С и оптимальном рН, а продолжительность осахаривания зависит от желаемого результата (требуемой степени осахаривания). Инактивацию фермента и остановку процесса гидролиза производят нагреванием продукта при 80°С в течение 20 мин.
Ферментный препарат амилоризин П10Х и ферментный препарат ами-лоризин ПОХ имеют оптимальные условия действия: рН 4,8 — 5,3 и температуру 53 — 55°С.
Применение глюкозоизомеразы.Фермент глюкозоизомераза (Н.Ф. 5.3.1.18) катализирует реакцию изомеризации глюкозы во фруктозу, то есть превращение альдозы в кетоформу за счет внутримолекулярного процесса окисления одной части молекулы и соответствующего восстановления другой части. Фермент обнаружен в растениях и продуцируется различными микроорганизмами. В промышленности преимущественно используются препараты глюкозоизомеразы, продуцируемые микроорганизмами, которые относятся к роду Streptomyces, а также к родам Aerobacter и Lactobacillus.
На реакции ферментативной изомеризации основана технология получения глюкозно-фруктозных сиропов из крахмала. Для получения глюкозно-фруктозных сиропов используют гидролизаты кукурузного крахмала с высоким содержанием крахмала (96 — 98%), полученные с помощью ферментативного гидролиза. Процесс изомеризации под действием иммобилизованного (закрепленного на носителе) ферментного препарата глюкозоизомеразы длится в течение 20 — 24 часов (до содержания в гидролизате 42% фруктозы и 52% глюкозы). В ходе процесса необходимо контролировать и поддерживать оптимальные условия для работы фермента: температура 60°С, рН 7,0 — 8,5. Кроме того, для повышения активности фермента и его стабильности в субстрат добавляют ионы магния и кобальта (в виде растворимых солей), а также бисульфит для предупреждения развития микрофлоры. Ионы кальция ингибируют фермент.
Иммобилизованные препараты глюкозоизомеразы характеризуются двумя важными показателями: период полужизни препарата, то есть время, за которое активность фермента снижается наполовину (при оптимальных условиях проведения процесса), и продуктивность, то есть количество килограммов глюкозы (на абсолютное СВ), изомеризованное 1 кг или 1 л ферментного препарата при многократном использовании. Для большинства препаратов период полужизни — 20 — 35 сут, продуктивность — до 2000 кг глюкозы на 1 кг фермента.
Полученные с помощью ферментативной изомеризации глюкозо-фруктозные сиропы обладают более высокой степенью сладости, по своим свойствам они близки к инвертному сахару, благодаря чему широко применяются при производстве детского и диетического питания, хлебобулочных изделий, безалкогольных напитков, кондитерских изделий, мороженого и т. д.
Кондитерское производство
Кондитерские изделия в зависимости от вида сырья и типа технологического процесса подразделяют на две группы: мучные и сахаристые. К мучным изделиям относятся печенье, галеты, крекеры, вафли, пряники, кексы, пирожные, рулеты, торты; к сахаристым — какао-порошок, шоколад, конфеты, карамель, мармелад, пастила, ирис, драже, халва.
Применение ферментных препаратов в кондитерском производстве обусловлено, с одной стороны, видом и свойствами сырья, с другой — технологической необходимостью и целесообразностью.
Применение протеаз и амилаз.Комплексные ферментные препараты, содержащие активные протеазы и α-амилазу (например, амилоризин П10Х), применяют при производстве мучных кондитерских изделий с целью ускорения процесса брожения и корректировки физических свойств клейковины муки, изменения реологических свойств теста, ускорения его "созревания".
При производстве мучных кондитерских изделий с использованием дрожжей, таких как галеты, крекеры, кексы, целесообразно применение комплексных препаратов с преобладанием протеолитического действия, но содержащих в своем составе и α-амилазу. Совокупное действие этих ферментов обеспечивают дрожжи сбраживаемыми сахарами и низкомолекулярными азотистыми веществами. Часть неиспользованных при брожении сахаров и азотистых веществ вступает в реакцию меланоидинообразования, благодаря чему галеты и крекеры приобретают интенсивную окраску и приятный аромат.
При производстве затяжного печенья с использованием химических разрыхлителей, когда много усилий направляется на расслабление клейковины, на протяжении длительного технологического процесса наряду с механическим воздействием на белки клейковины целесообразно использование протеолитических ферментных препаратов; α-амилаза, присутствующая в качестве сопутствующего фермента как в грибных, так и бактериальных препаратах, не мешает их использованию.
В случае применения бактериальных протеолитических препаратов (например, протосубтилина ПОХ), содержащих в качестве сопутствующего фермента α-амилазу, при производстве изделий подобных крекерам, галетам, печенью опасности излишней декстринизации не существует, т. к. фермент быстро инактивируется за счет того, что эти тонкие изделия быстро прогреваются до высокой температуры. При выработке кексов, а также бисквитного полуфабриката, выпекающихся в довольно толстом слое при невысокой температуре, в случае необходимости применения комплексных бактериальных препаратов следует осторожно подходить к их дозировке во избежание порчи мякиша. Необходимо также учитывать, что усиленное механическое воздействие на кондитерское тесто приводит к повышению атакуемости ферментами полимеров муки — крахмала, белков, других веществ, усиливая тем самым конечный эффект гидролиза.
Для заварных и сырцовых пряников наибольшее значение имеет протеолиз, но наряду с потребностью в регулируемом расслаблении теста важным является и сохранение свежести (мягкости) продукта. Очевидно, что при производстве таких видов изделий целесообразно применение комплексных ферментных препаратов с преобладанием протеолитической активности.
При производстве бисквитного полуфабриката нужны комплексные ферментные препараты с умеренной активностью протеолитических ферментов и невысокой α-амилазной (декстринирующей) способностью. При таком сочетании обеспечивается умеренное расслабление клейковины, способствующее лучшему подъему теста при выпечке и образованию тонкопористой воздушной структуры готовых изделий. Образование декстринов, в свою очередь, способствует сохранению их свежести.
Комплексные ферментные препараты, содержащие протеазы и α-амилазу, используются для ускорения и облегчения обработки теста при приготовлении слоеного полуфабриката с целью улучшения его эластичных свойств и предупреждения усадки при выпечке. Кроме того, применение таких ферментных препаратов при производстве вафель позволяет оптимально снизить вязкость вафельного теста, способствует получению тонких хрустящих вафельных листов.
Применение инвертазы.Препараты инвертазы, как уже отмечалось, получают из дрожжей S. cerivisiae или S. carlsbergensis путем автолиза. Они представляют собой суспензию спиртоосажденной инвертазы в 25%-м, 50%-м растворе глицерина или 70%-м растворе сорбита. Оптимум рН действия препарата 4,5 — 5,5, что вполне приемлемо для его использования в различных технологиях производства сахаристых изделий.
Инвертаза применяется в кондитерской промышленности для производства отливных помадных корпусов конфет, круглых помадных корпусов и жидких фруктовых начинок, таких как вишневый ликер. В каждом случае ее применение обусловлено необходимостью получить полумягкую или жидкую консистенцию при высоких концентрациях сахара (78%), предотвращающих брожение. Ускорение или замедление действия инвертазы достигается путем изменения концентрации вносимого препарата, количества воды и температурного режима. При высокой температуре инвертаза инактивируется, и даже при температуре отливки (65°С) активность инвертазы снижается на 12% в течение 30 мин и на 24% в течение 60 мин. Некоторые сорта конфет, например, конфеты с вишневым ликером, невозможно изготовить без инвертазы. В случае производства помадной массы из кокосовых орехов применение инвертазы обусловлено и повышенной влагоудерживающей способностью фруктозы, образующейся под действием этого фермента.
Применение липазы.Молочные ингредиенты широко применяются при производстве кондитерских изделий, они в значительной мере обуславливают их аромат, вкус и питательную ценность. В усилении аромата молочного шоколада, карамели, ириса, сливочного крема наряду с другими компонентами принимают участие и свободные жирные кислоты, образующиеся под действием липаз. При низких уровнях свободных жирных кислот аромат изделий усиливается, но новые ароматы не образуются; при средних — появляется аромат масла; при высоких — аромат сыра. Подобные ароматические вещества могут быть получены путем модификации масел или жиров с применением препаратов липаз различного происхождения (животных, растительных, микробных).
Производство плодово-ягодных соков,
безалкогольных напитков и вин
Применение ферментных препаратов при производстве плодово-ягодных соков, вин и безалкогольных напитков осуществляется с целью повышения выхода сока, осветления и стабилизации соков, безалкогольных напитков и вин, предотвращения окислительных процессов в соках и в изготовляемых из них продуктах, а также для инверсии сахарозы при производстве безалкогольных напитков и сиропов. При этом в одних случаях необходимо иметь набор ферментных препаратов, содержащих определенный комплекс ферментов, в других — требуются препараты индивидуальных ферментов. Кроме того, ферментные препараты должны удовлетворять требованиям, предъявляемым технологией получения конкретного продукта, не только по типу катализируемой реакции, но и в отношении условий их протекания.
В соответствии со спецификой плодово-ягодного сырья и целями применения ферментные препараты можно разделить на шесть групп:
1) препараты, предназначенные для получения неосветленных соков, увеличивающие выход и повышающие экстрактивность;
2) препараты, предназначенные для получения осветленных соков, увеличивающие выход, повышающие экстрактивность и обеспечивающие полный гидролиз пектиновых и белковых веществ;
3) препараты, мацерирующие плодово-ягодную ткань, повышающие выход и гомогенность соков с мякотью;
4) препараты, предназначенные для получения осветленных плодово-ягодных виноматериалов, увеличивающие выход и повышающие экстрактивность виноматериалов;
5) препараты, способствующие предотвращению окислительных процессов и развитию аэробных микроорганизмов в соках, винах, безалкогольных напитках;
6) препараты, катализирующие инверсию сахарных сиропов при производстве безалкогольных напитков и товарных сиропов.
Применение пектолитических ферментов.Основной биохимический процесс, протекающий в плодово-ягодной мезге и соке при их обработке пектолитическими препаратами или при совместном применении термической и ферментативной обработки, — гидролиз пектиновых веществ. Но наряду с этим происходят превращения белков, целлюлозы, гемицеллюлозы и других компонентов сырья.
Поэтому ферментные препараты, используемые для получения полностью осветленного сока из большинства плодов и ягод, должны содержать не только пектолитические ферменты, но и ферменты, гидролизующие другие коллоидные соединения, которые обуславливают опалесценцию соков и нестабильность изготовляемых из них вин и безалкогольных напитков.
С целью максимального извлечения сока и облегчения его осветления при гидролизе пектиновых веществ ягод и плодов необходимо учитывать свойства пектолитических ферментов самого сырья и вносимых препаратов. В зависимости от технологических требований и химического состава сырья следует применять препараты с определенным комплексом ферментов; имеется в виду как спектр ферментов (пектинэстераза, эндо-, экзополигалактуроназа и др., а также сопутствующие ферменты), так и их соотношение. Кроме того, необходимо путем подбора режима обработки сырья создать оптимальные условия для действия ферментов.
В настоящее время в мире производится достаточно широкий спектр пектолитических ферментных препаратов. Среди промышленных продуцентов пектолитических ферментов следует отметить A. niger, A. wenti, A. oryzae, A. foetidus, P. expansum, P. italicum, Rhizopus spp.
Применение протеолитических ферментов.Некоторые плодово-ягодные соки и вина трудно осветляются и часто мутнеют при хранении из-за наличия в них белковых соединений. Устранение белкового помутнения может быть осуществлено посредством применения термической обработки и различных адсорбентов с последующей фильтрацией. Все эти методы обедняют химический состав продукта, ухудшают его качество, причем не всегда достигается положительный результат. Для многих видов сырья огромную роль в процессе осветления соков играют протеиназы, в связи с чем наличие кислых протеиназ наряду с ферментами пекто-литического комплекса обязательно.
Применение мацерирующих ферментов.При производстве плодово-ягодных соков с мякотью размельчение плодовой ткани осуществляется механическим путем. Большинство видов сырья перед механическим измельчением подвергается термической обработке. Термическая обработка способствует кислотному гидролизу протопектина, в результате чего плодовая ткань размягчается и легче поддается механическому измельчению. Очевидно, что жесткие режимы обработки сырья ухудшают органолептические свойства и пищевую ценность продукта. Поэтому соки с мякотью часто содержат недостаточно тонко измельченную мякоть, негомогенную и расслаивающуюся при хранении. С позиции устранения указанных выше недостатков и получения гомогенных соков с мякотью, не подвергающихся расслаиванию, целесообразным является применение мацерирующих ферментных препаратов, расщепляющих протопектин, но не снижающих вязкость сока.
Пектолитические ферментные препараты, применяемые для увеличения выхода и осветления соков, непригодны для производства соков с мякотью, т. к. основным ферментом в них является эндополигалактуроназа, резко снижающая вязкость сока. Гемицеллюлаза и целлюлаза способствуют получению однородной консистенции соков с мякотью.
Применение глюкозооксидазы и каталазы.Ферментный препарат глюкозооксидаза (в котором в качестве обязательного компонента присутствует каталаза) применяется с целью улучшения качества и стабилизации плодово-ягодных соков, вин и безалкогольных напитков за счет удаления кислорода в результате реакции окисления глюкозы (см. также разд. 8.2). Таким образом, этот препарат способствует предотвращению окислительных процессов и микробиологической порчи под действием аэробных микроорганизмов.
Препарат обладает строгой специфичностью по отношению к глюкозе, его вносят после завершения технологических процессов с целью стабилизации свойств продукта, полученного в процессе производства. Желательно, чтобы препараты были термостабильны и не инактивировались при температуре 65 — 70°С в течение 10 — 15 мин. Такие препараты можно было бы применять комплексно с легкими режимами пастеризации.
Ферментные препараты, применяемые в плодово-ягодном виноделии, должны сохранять активность в условиях определенного содержания алкоголя (до 10 — 12%) и эффективно действовать при значениях рН, обусловленных химическим составом виноматериалов.
Применение инвертазы.Препараты, катализирующие гидролиз сахарозы при приготовлении сахарных сиропов, используемых при производстве безалкогольных напитков, должны содержать фермент инвертазу (β-фруктофуранозидазу), не должны иметь специфического запаха, темного цвета, окислительных или других ферментов, способных изменять цвет, аромат и вкус продукта.
Необходимо, чтобы препараты катализировали процесс инверсии сахарозы в довольно широком диапозоне рН (для чистого сахарного сиропа рН 6,0 — 6,5; для сахарного сиропа, изготовленного на фруктовых соках, рН 2,5 — 4,5). Кроме того, необходимо учитывать специфику биохимического состава сырья и особенности технологического процесса производства соков и виноматериалов.
Ферментные препараты, применяемые при переработке плодово-ягодного сырья, могут оказывать влияние на цвет изготовляемого продукта. В связи с этим плодово-ягодное сырье следует разделить на две группы: слабоокрашенное — яблоки, айва, белые сорта слив и винограда и др.; окрашенные в красный цвет, т. е. содержащие вещества группы ан-тоцианов — кизил, черника, ежевика, малина, земляника, красные сорта винограда и слив и т.п.
При производстве продуктов, относящихся к первой группе, — слабоокрашенных — следует применять ферментные препараты, не содержащие окислительных ферментов, вызывающих потемнение продукта, а в ряде случаев — снижение органолептических свойств и пищевой ценности, таких как полифенолоксидаза, пероксидаза, каталаза, аскорбатоксидаза. При переработке сырья второй группы — окрашенных в красный цвет — недопустимо применение препаратов, содержащих ферменты, разрушающие антоцианы.
Препараты, предназначенные для переработки шиповника, черной смородины, ценность которых в значительной степени обуславливается наличием в плодах аскорбиновой кислоты, не должны содержать фермента аскорбатоксидазы, т. к. окисление аскорбиновой кислоты под действием этого фермента снижает ценность получаемого продукта.
Спиртные напитки и пивоварение
Производство спиртных напитков.Производство спиртных напитков из крахмалсодержащего сырья практикуется почти во всех странах мира. Основными видами сырья являются картофель и рожь в Европе, картофель и пшеница в России, кукуруза и рожь в США, рис и бататы на Востоке, тапиока в тропических странах.
Крахмал, как основной компонент сухих веществ сырья, из которого и образуется спирт, непосредственно дрожжами не сбраживается. Поэтому его необходимо гидролизовать до сбраживаемых сахаров, для этого требуется применение ферментов.
Применяемый издавна зерновой солод, как источник амилолитичес-ких ферментов, обеспечивает достаточно глубокое осахаривание и выбраживание только за трое суток. Необходимо отметить, что зерновой солод не только выполняет задачу гидролиза крахмала до сбраживаемых сахаров, но и является источником легкоусвояемого азотистого питания для дрожжей, т. к. в процессе солодоращения, под действием протеиназ, в нем накапливается значительное количество аминокислот (до 32% от общего азота). Активность протеиназ в процессе солодоращения возрастает примерно в 40 раз. Зерновой солод обладает и цитолитической активностью, обеспечивая определенную степень гидролиза клеточных стенок растительного сырья и тем самым улучшая контакт крахмала с амилолитическими ферментами.
Таким образом, применяемый в спиртовом производстве зерновой солод выполняет три основные функции: осуществляет гидролиз крахмала до сбраживаемых Сахаров; является источником азотистого питания для дрожжей и при осахаривании крахмалистого сырья производит частичное разрушение клеточных стенок сырья.
Однако скорость осахаривания крахмала при использовании солода остается достаточно низкой, что затрудняет интенсификацию процесса брожения. Применение ферментных препаратов микробного происхождения дает возможность значительно повысить концентрацию необходимых ферментов в среде и обеспечить глубокий гидролиз крахмала за сравнительно короткий период.
Кроме стадии осахаривания ферментные препараты, обладающие сильной разжижающей активностью (α-амилаза), применяются на стадии водно-тепловой обработки сырья с целью смягчить режим разваривания, снизить вязкость замесов и облегчить их дальнейшую транспортировку.
Применяя ферментные препараты на стадии приготовления сусла для дрожжегенерации, необходимо обеспечить интенсивный гидролиз белков с целью обогащения ценным азотистым питанием дрожжевого сусла.
Таким образом, для спиртового производства, перерабатывающего крахмалсодержащее сырье, необходимо применение ферментных препаратов с амилолитическим, протеолитическим и цитолитическим действием. При замене солода культурами микроорганизмов или препаратами ферментов необходимо, чтобы полученный спирт обладал высокими дегустационными качествами и не содержал вредных примесей.
Пивоварение.При производстве пива по обычной технологической схеме необходимые ферментные системы для подготовки зернового сырья и перевода экстрактивных веществ в растворимое состояние на стадии затирания образуются в процессе солодоращения.
Основными ферментами, образующимися в процессе солодоращения и имеющими наиболее существенное значение в технологии пивоварения, являются: амилолитические ферменты, разжижающие и осахаривающие крахмал; протеолитические ферменты, расщепляющие белки ячменя до пептидов различной молекулярной массы и свободных аминокислот; цитолитические ферменты, гидролизующие некрахмальные полисахариды, растворяющие клеточные стенки эндосперма зерна, благодаря чему облегчается доступ амилаз и протеаз к соответствующим субстратам.
Каждый из перечисленных процессов должен пройти с определенной глубиной, чтобы обеспечить нормальное протекание фильтрации затора, брожения сусла, осветление и фильтрацию пива, а также создание определенных физико-химических свойств (пенообразование, прозрачность, стойкость при хранении) и вкусовых качеств готового продукта.
Применение ферментных препаратов микробного происхождения (амилоризин ПХ, П10Х, амилосубтилин Г10Х, Г20Х, протосубтилин Г10Х, цитороземин ПХ) с целью замены солода несоложенным ячменем позволяет интенсифицировать процесс, избежать потерь ценных компонентов сырья на дыхание и образование проростка, в целом повысить рентабельность пивоваренного производства. Кроме отечественных препаратов, в настоящее время широко используются ферментные препараты различных зарубежных фирм. Предназначенные для замены ферментов солода ферментные препараты микробного происхождения должны по характеру своего действия соответствовать ферментам солода и значительно превосходить их по активности.
Ферменты, используемые для борьбы с холодной мутью.К образованию холодной мути в бутылочном пиве приводит рост микрорганизмов; такое биологическое помутнение предотвращается пастеризацией пива или стерильной фильтрацией при заполнении бутылок в асептических условиях. Небиологическое помутнение пива может происходить при его продолжительном хранении; этот процесс ускоряется при действии света, тепла, кислорода, в присутствии следов железа или меди, а также при одновременном воздействии этих факторов. Состав мути зависит от преобладающего действия того или иного из этих факторов. Основными составляющими холодной мути являются: белки — 40 — 76%; танин — 17 — 55%; углеводы — 3 — 13%. Холодная муть состоит из очень тонкого осадка, который образуется при выдержке пива при температурах ниже 10°С. Для борьбы с холодной мутью могут быть использованы растительные ферменты — папаин, фицин, бромелаин, а также грибные (продуцируемая микроскопическими грибами рода Aspergillus, Penicillium, Mucor, Amylomyces) и бактериальные (продуцируемая В. subtilis) протеазы. Но наиболее широко для этой цели применяется лишь папаин или комплексные препараты, включающие папаин и другие протеазы, что объясняется относительно высокой термостабильностью препаратов папаина, сохраняющих свою активность после пастеризации.
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых — один производственный цикл. Однако достижения молекулярной биологии, биохимии и энзимологии привели к тому, что в настоящее время строение и функции многих ферментов изучены очень детально и это позволило создать теоретическую базу для производства ферментов пролонгированного действия или иммобилизованных ферментов, т. е. фиксированных или связанных ферментных препаратов.
Сущность иммобилизации ферментов заключается в присоединении их в активной форме тем или иным способом к инертной матрице (обычно это нерастворимый полимерный носитель).
Иммобилизацию фермента можно определить и как включение молекулы фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться находящимися в ней молекулами субстрата, эффектора или кофактора.
Фаза фермента обычно нерастворима в воде и часто представляет собой высокомолекулярный гидрофильный полимер, например, целлюлозу, полиакриламид, сефарозу и т. п.
Принципы и способы иммобилизации.Включение фермента в изолированную фазу осуществляют различными способами: фермент может быть ко валентно связан с этой фазой, адсорбирован на ней или физически включен в нее.
Возможны следующие способы иммобилизации фермента.
1. Ковалентное связывание. Молекула фермента ковалентно связывается с нерастворимым полимером. Полимер может быть в виде порошка или в форме пленки. Иногда молекулы фермента соединяются ковалентными связями друг с другом или с каким-либо инертным белком; при этом образуется нерастворимый, но активный полимерный фермент (рис. 8.11).
2. Электростатическое связывание. Этот способ иммобилизации основан на использовании электростатических или других нековалентных механизмов связывания (рис. 8.12).
3. Сополимеризация с помощью многофункциональных реагентов. Связывание молекул фермента с белками (например, с альбумином) или друг с другом осуществляется за счет использования определенных реагентов. В качестве такого многофункционального реагента часто используют глутаровый альдегид, гелеобразующее действие которого известно давно. В этом способе необходимо избегать взаимодействия реагента с активным центром фермента и ингибирования последнего (рис. 8.13).

Рис. 8.11.Ковалентное связывание

Рис. 8.12.Электростатическое связывание (адсорбция)

Рис. 8.13. Поперечное сшивание молекул фермента
4. Включение в полимер. В этом способе фермент не прикреплен к полимеру, но удерживается внутри него, поскольку последний образует вокруг фермента сетеобразную матрицу (рис. 8.14). Ячейки этой матрицы настолько малы, что молекула фермента не может освободиться из сети, но в то же время достаточно велики для проникновения низкомолекулярных субстратов. Примером такого способа иммобилизации могут служить:
а) включение в липосомы, когда фермент находится в водном растворе, окруженном фосфолипидным барьером (рис. 8.15);
б) гидрофобное взаимодействие, когда фермент "погружен" в гидрофобную часть двойного липидного слоя (рис. 8.16).

Рис. 8.14. Включение в полимер

Рис. 8.15. Включение в липосомы

Рис. 8.16. Гидрофобное взаимодействие
5. Инкапсулирование. Включение фермента в органическую или неорганическую капсулу, которая представляет собой полупроницаемую мембрану (рис. 8.17).
Выбор способа иммобилизации.Искусство иммобилизации ферментов заключается в правильном выборе подходящего метода. Этот выбор определяется целым рядом факторов, многие из которых невозможно выявить до тех пор, пока метод не будет опробован.
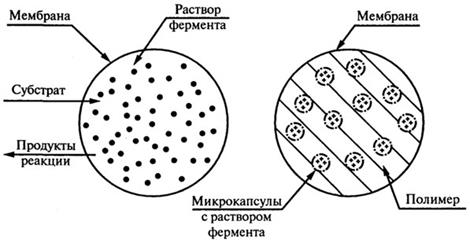
Рис. 8.17.Получение микрокапсул
Первичный отбор осуществляется обычно эмпирическим путем. Сначала нужно решить, необходим ли для прикрепления фермента какой-либо специфический носитель, не будет ли процедура иммобилизации инактивировать фермент и сможет ли иммобилизованный фермент действительно функционировать в тех условиях, при которых его предстоит использовать.
Поэтому для успешной иммобилизации следует по возможности принять во внимание следующие факторы:
— фермент должен быть стабильным в условиях протекания реакции;
— реагенты, образующие поперечные сшивки, не должны взаимодействовать с химическими группировками активного центра. В связи с этим поперечно-сшивающий реагент должен быть как можно больших размеров, что будет препятствовать его проникновению в активный центр;
— всегда, когда это осуществимо, необходимо тем или иным способом защищать активный центр фермента (например, обработка тиоловых ферментов глутатионом или цистеином);
— процедура промывания для удаления "непришитого" фермента не должна оказывать вредного влияния на иммобилизованный фермент;
— полимерная матрица не должна являться субстратом для иммобилизованного фермента;
— необходимо, наконец, учитывать механические свойства носителя, особенно его механическую прочность и физическую форму.
Процесс иммобилизации фермента можно продемонстрировать на примере связывания глюкоамилазы с носителем — ацетил этил целлюлозой.
Носитель выдерживают сутки в дистиллированной воде для набухания. Далее к набухшей ацетилэтилцеллюлозе добавляют сначала натрий-ацетатный буфер с рН 5,5, а затем раствор очищенного фермента; после перемешивания к смеси добавляют поперечно-сшивающий агент — глутаровый альдегид. Через несколько часов полученный препарат промывают последовательно натрий-ацетатным буфером и раствором хлористого натрия для удаления несорбированного на носителе фермента. Иммобилизованный таким образом фермент хранится под слоем воды или буфера при 3 — 5°С.
В настоящее время разработаны методы иммобилизации множества ферментов. Один и тот же фермент можно иммобилизировать несколькими методами. Например, глюкозоизомеразу из S. phaeochromogenes можно иммобилизовать на различных носителях: пористом алюминии, ДЭАЭ-целлюлозе, ДЭАЭ-крахмале и др. Лактатдегидрогеназу можно включить в гель, прикрепить к носителю поперечной сшивкой; аспарагиназу — прикрепить к носителю сорбционным путем или химической (ковалентной) связью. В табл. 8.4 представлены некоторые методы иммобилизации для различных ферментов.
Влияние иммобилизации на ферментативную активность.Иммобилизация часто приводит к резким изменениям основных параметров ферментативной реакции: максимальной скорости (Vmax); константы Михаэлиса (Кт); оптимума рН и температуры, а также отношения к ингибиторам.
Степень и природа этих изменений зависят не только от используемого метода иммобилизации, но и от типа ферментативной реакции. Большое влияние на ферментативную активность может оказывать полимерная матрица, причем это влияние может проявляться как в виде воздействия на микроокружение фермента, так и непосредственно на саму молекулу фермента. Кроме того, сами условия иммобилизации (значение рН, присутствие свободных радикалов, окисляющих агентов и т. п.) могут приводить к частичной или полной инактивации фермента.
При рассмотрении влияния иммобилизации на ферментативную активность одним из важных является вопрос об эффективных кинетических параметрах.
Параметры Кт и Vmax, используемые для характеристики каталитических свойств ферментов в разбавленных растворах (см. разд. 8.2), не могут быть применены в их строгом математическом значении для характеристики иммобилизованных ферментов, т. к. наблюдаются существенные отклонения от гиперболической субстратной кривой, описываемой уравнением Михаэлиса — Ментен, и искривления прямолинейных графиков в двойных обратных координатах (уравнение Лайнуивера — Берка).
Таблица 8.4. Иммобилизация некоторых ферментов известными методами [М. Е. Бекер. Введение в биотехнологию, 1978]
| |
|
|
Последнее изменение этой страницы: 2016-08-28 lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда... |