
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
Методика. Платиновую или нихромовую проволоку погружают в концентрированную хлороводородную кислоту, затем в сухую соль меди и вносят в пламя горелки, которое окрашивается в зеленый цвет.
8. Реакция с тиоцианат – ионами.
Cu2+ + 2 SCN- → Cu(SCN)2↓→ CuSCN↓ + SCN-
Методика. В пробирку вносят 2-3 капли кислого раствора соли меди (II) прибавляют 1-2 капли раствора тиоцианата натрия или калия, либо аммония (NH4SCN). Образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN.
9. Другие реакции меди (II).
Катионы Cu2+ с сульфид -ионами дают черный осадок сульфида меди CuS;
с фосфатами – голубой осадок Cu3(PO4)2.
Известны реакции комплексообразования меди (II) с различными органическими реагентами – купроином, купфероном, дитиоксамидом и др.
6.2. Аналитические реакции катиона кадмия Cd2+.
Акво – ионы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
1. Реакция с щелочами и аммиаком.
Cd2+ + 2 OH- → Cd(OH)2↓(белый)
Методика. В две пробирки вносят по 3-4 капли раствора соли кадмия. В одну пробирку прибавляют 1-2 капли раствора NaOH или КОН. Выпадает белый осадок гидроксида кадмия Cd(OH)2.В другую пробирку прибавляют по каплям раствор аммиака. Выпадает белый осадок.
· Проба на растворимость. Осадок Cd(OH)2 нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
Cd(OH)2 + 4 NH3 → [Cd(NH3)4]2+ + 2 OH-
Осадок Cd(OH)2 растворяется в кислотах:
Cd(OH)2 + 2 H3О+ → [Cd(H2О)4]2+
2. Реакция с сульфид – ионами.
Реакцию проводят в слабо кислых или щелочных растворах.
Cd2+ + S2- → CdS↓(желтый)
Методика. В пробирку вносят 2-3 капли раствора нитрата кадмия, прибавляют две капли раствора сульфида натрия Na2S. Выпадает желто – коричневый осадок сульфида кадмия CdS.
· Проба на растворимость. Осадок CdS не растворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2-:
CdS + 4 Cl- → [CdCl4]2- + S2-
· CdS нерастворим в кислотах, за исключением HCl, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + HCl → H2[CdCl4] +H2S
3. Реакция с тетраиодовисмутатом (III) калия.
Cd2+ + 2 [BiI4]- → CdI2 + 3BiI3 ↓(черный)
Методика. На лист фильтровальной бумаги наносят каплю раствора тетраиодовисмутата (III) калия К[BiI4] и каплю раствора соли кадмия. На бумаге появляется черное пятно. При добавлении по каплям раствора иодида калия или тиосульфата натрия черное пятно исчезает.
4. Реакция с тетрароданомеркуратом (II) аммония.
Cd2+ + [Hg(SCN)4]2- → Cd[Hg(SCN)4]
Методика. В пробирку вносят 2-3 капли раствора соли Cd2+ и прибавляют 2-3 капли раствора (NH4)2[Hg(SCN)4]. Выпадают бесцветные (или белые) кристаллы тетрароданомеркурата (II) кадмия Cd[Hg(SCN)4].
Реакцию можно проводить как микрокристаллоскопическую.
Методика. На предметное стекло наносят каплю раствора соли кадмия и каплю раствора тетрароданомеркурата (II) аммония. При рассмотрении под микроскопом можно видеть образовавшиеся бесцветные продолговатые кристаллы тетрароданомеркурата кадмия Cd[Hg(SCN)4].
5. Другие реакции кадмия Cd2+.
Cd2+ реагирует с комплексоорганическими реагентами:
дитизоном, кадионом, β-нафтохинолином, меркаптобензимидазолом, меркаптобензтиазолом и т.д.
6.3. Аналитические реакции катиона кобальта (II) Cо2+.
Акво – ионы кобальта (II) октаэдрической структуры [Cо(H2О)6]2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта (II) также имеют розовую окраску. Однако при выпаривании водных растворов Cо2+ их окраска меняется на синюю, характерную для комплексов кобальта (II) тетраэдрической структуры.
Соединения Со(II) легко окисляется до соединений Со (III), причем в ряде случаев – уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт (II). В водных растворах кобальт (II) и кобальт (III) присутствуют исключительно в форме комплексных соединений. Комплексы Со(III) устойчивее комплексов Со (II).
1. Реакция с щелочами.
CоCl2 + OH- → CoOHCl↓(синий) + Cl-
CoOHCl + OH- → Co(OH)2↓(розовый) + Cl-
2 Co(OH)2 + 0,5 О2 + Н2О → 2 Co(OH)3↓(черно-бурый)
Методика. В пробирку вносят 3 капли раствора соли кобальта (II), например, CoCl2, и медленно, по каплям, при непрерывном перемешивании смеси прибавляют водный раствор NaOH или КОН до образования синего осадка CoOHCl, переходящего при дальнейшем прибавлении щелочи в розовый осадок Со(ОН)2, который через некоторое время постепенно темнеет за счет окисления до Co(OH)3.
Если к розовому осадку Со(ОН)2 прибавить Н2О2, то реакция окисления Со(ОН)2 в черно-бурый Co(OH)3 протекает практически мгновенно:
2 Co(OH)2 + Н2О2 → 2 Co(OH)3.
Действие смеси Н2О2 со щелочью на раствор соли кобальта (II) сразу приводит к образованию черно-бурого осадка Co(OH)3:
2 CоCl2 + 4 OH- + Н2О2 → 2 Co(OH)3 + 4 Сl-
2. Реакция с аммиаком.
CоCl2 + NH3*H2O → CoOHCl↓(синий) + NH4Cl
CoOHCl + 5 NH3 + NH4Cl → [Co(NH3)6]Cl2 (желтый) + H2O
Методика.
а). В пробирку вносят 3 капли раствора хлорида кобальта (II) и медленно, по каплям прибавляют раствор аммиака до выпадения синего осадка CoOHCl. Добавляют несколько кристаллов хлорида аммония и продолжают прибавление раствора аммиака при перемешивании смеси до полного растворения осадка и образования желтого раствора. При стоянии на воздухе, раствор постепенно меняет окраску на вишнево – красную, за счет окисления кобальта (II) до кобальта (III) с образованием хлоропентамминкобальт (III) – анионов [Co(NH3)5Сl]2- вишнево – красного цвета:
2 [Co(NH3)6]Cl2 + O2 + 2 H2O → 2 [Co(NH3)5Сl](OH)2 + 2 NH3
б). В другую пробирку вносят 3 капли раствора хлорида кобальта (II), прибавляют 2 капли раствора пероксида водорода и затем по каплям – раствор аммиака до выпадения черно – бурого осадка Co(OH)3. Добавляют по каплям концентрированный раствор аммиака до растворения осадка и образования вишнево – красного раствора, содержащего комплексы [Co(NH3)5Сl]2+.
В присутствии Н2О2 и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5Сl]2+ протекает практически мгновенно:
2 [Co(NH3)6]Cl2 + 2 H2O2 + 2 NH4Cl → 2 [Co(NH3)5Сl]Cl2 +4 NH3 + 2 H2O
3. Реакция с тетратиоцианатомеркуратом (II) аммония (тетрароданомеркуратом (II) аммония).
Cо2+ + [Hg(SCN)4]2- → Cо[Hg(SCN)4]↓(темно-синие кристаллы)
Из разбавленных растворов кристаллы выделяются медленно.
Методика. В пробирку вносят 4-5 капель раствора соли кобальта (II), прибавляют каплю раствора соли цинка (например, ZnSO4) и 3-4 капли раствора (NH4)2[Hg(SCN)4]. Выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта (II):
XZn2+ + Yco2+ + (X+Y) [Hg(SCN)4]2- → ZnxCoy[Hg(SCN)4]x+y
Прибавление даже небольших количеств соли цинка приводит к почти полному осаждению кобальта (II).
Проведению реакции мешают катионы Cd2+, Cu2+, Fe3+, Ni2+.
4. Реакция с тиоцианат – ионами.
Co2+ + 4 NCS- ↔ [Co(NСS)4]2+ (синий)
Реакцию проводят в слабо кислой среде.
v Комплекс в водных растворах неустойчив и равновесие комплексообразования смещено влево в сторону образования розового аквокомплекса кобальта (II). Поэтому реакцию проводят при избытке тиоцианат – ионов, чтобы сместить равновесие вправо. Равновесие смещается вправо также в водно – ацетоновых растворах, в силу чего реакцию иногда проводят в водно – ацетоновой среде (ацетон хорошо смешивается с водой).
v В растворах органических растворителей (изоамиловый спирт, эфир) устойчивость комплекса повышается, поэтому при проведении данной реакции водный раствор, содержащий катионы Co2+, смешивают с небольшим количеством органического растворителя (смесь изоамилового спирта и диэтилового эфира). При этом [Co(NCS)4]2+ переходит в органическую фазу и окрашивает ее в синий цвет.
Методика. а). В пробирку вносят 2-3 капли раствора соли Со2+, прибавляют 8-10 капель насыщенного раствора тиоцианата калия KNCS или аммония NH4NCS (или несколько кристаллов этих солей), 5-6 капель органического растворителя (изоамиловый спирт или изоамиловый спирт с диэтиловым эфиром и встряхивают смесь. Верхний слой органической фазы окрашивается в синий цвет.
б). В другую пробирку вносят 2-3 капли раствора соли Со2+, 2-3 капли раствора соли Fe3+ и прибавляют 5-6 капель насыщенного раствора KSCN или NH4SCN. Раствор принимает красную окраску – цвет тиоцианатных комплексов железа (III), на фоне которого нельзя увидеть синюю окраску тиоцианатных комплексов Со2+. К смеси прибавляют порошкообразные NaF или NaKC4H4O6 до исчезновения красной окраски. Затем добавляют 5-6 капель органического растворителя и встряхивают пробирку. Наблюдается синее окрашивание верхней жидкой органической фазы.
в). Реакцию можно также проводить капельным методом на фильтровальной бумаге. Для этого на лист фильтровальной бумаги наносят каплю концентрированного раствора KSСN или NH4SCN, каплю раствора соли кобальта (II) и высушивают бумагу на воздухе. Наблюдают образование синего пятна.
Проведению реакции мешают катионы Fe3+, Сu2+, также образующие окрашенные соединения с тиоцианат – ионами – желто-бурый комплекс меди (II) и красные комплексы железа (III). Мешающее действие катионов Fe3+ устраняют связывая их в устойчивые бесцветные комплексы такими маскирующими агентами, как фторид – и тартрат –анионы, прибавляя NaF и NaKC4H4O6 соответственно.
5. Реакция с сульфид – ионами.
Со2+ + S2- → CoS ↓(черный)
Методика. В пробирку вносят 2-3 капли раствора соли кобальта (II) и прибавляют 2-3 капли раствора сульфида аммония (или Na2S). Выпадает черный осадок CoS.
· Проба на растворимость. Осадок CoS растворяется в минеральных кислотах, однако при стоянии он превращается в форму, трудно растворимую в разбавленной HCl, но растворимую в кислотах в присутствии окислителей.
6. Реакция с солями цинка – образование «зелени Ринмана».
Zn(NO3)2 + Co(NO3)2 → CoZnO2 + 4 NO2 + O2
Методика. В пробирке или в фарфоровом тигле смешивают 5 капель раствора Co(NO3)2 и 5 капель раствора Zn(NO3)2. Смесь нагревают до кипения и кипятят около минуты. Горячим раствором смачивают полоску фильтровальной бумаги, высушивают ее и озоляют в фарфоровом тигле на спиртовой горелке (или газовой). Образуется зола зеленого цвета.
7. Реакция с реактивом Ильинского (1-нитрозо-2-нафтол).
Реакцию проводят в нейтральной или слабо кислой среде. 1-нитрозо-2-нафтол в растворе может существовать в двух таутомерных формах, условно обозначаемых через HL:


 NO N - OH
NO N - OH





 ОН O
ОН O
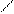


(HL)
В этой реакции вначале кобальт (II) окисляется до кобальт (III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка:
Со3+ + 3 HL → CoL3 + 3 H+
Методика. а). В пробирку вносят 2-3 капли раствора соли кобальта(II), 1-2 капли уксусной кислоты, 2-3 капли 1%-го раствора 1-нитрозо-2-нафтола. При осторожном нагревании наблюдают выделение пурпурно-красного осадка внутрикомплексного соединения.
б). Капельный метод: на листок фильтровальной бумаги наносят каплю раствора соли кобальта (II) и каплю 1%-го раствора 1-нитрозо-2- нафтола в уксусной кислоте. На бумаге возникает красно-коричневое пятно.
8. Реакция с нитрозо- R- солью (фармакопейная).
Нитрозо – R – соль можно представить в двух таутомерных формах:
NO N - OH
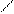




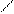


 OH O
OH O
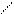


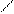


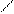 SO3H (HL1)
SO3H (HL1)
НО3S HO3S SO3H
Реакцию проводят в кислой среде при нагревании.
В кислой среде кобальт (II) окисляется до кобальта (III), а последний взаимодействует с HL1 и образует внутрикомплексное соединение состава СоL31:
Со3+ + 3 HL1 = CoL31↓ (красный) + 3 Н+
При больших концентрациях из раствора выпадает красный осадок.
Методика. В пробирку вносят 3-4 капли раствора соли кобальта (II), 3-4 капли разбавленного раствора HCl. Раствор в пробирке нагревают до кипения, прибавляют 3-4 капли свежеприготовленного раствора нитрозо- R- соли в 50% -й уксусной кислоте и нагревают до кипения. Раствор окрашивается в красный цвет и из него выпадает красный осадок.
9. Другие реакции катионов кобальта (II).
Катионы кобальта Со2+ с нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до Со3+) желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединение Со2+ с бурой Na2B4O7*10H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNH2 – желто-бурый осадок комплексного соединения.
6.4. Аналитические реакции катиона никеля (II) Ni2+.
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1. Реакция с щелочами.
Ni2+ + 2 OH- → Ni(OH)2↓(зеленый)
Методика. В пробирку вносят 2-3 капли раствора соли никеля (II) и прибавляют по каплям при перемешивании раствор щелочи. Выпадает светло-зеленый осадок.
· Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака:
Ni(OH)2 + 2 Н+ → Ni2+ + 2 H2О
Ni(OH)2 +6 NH3 → [Ni(NH3)6]2+ + 3 OH-
2. Реакция с аммиаком.
Ni(NO3)2 + NH3*H2O → NiOHNO3 + NH4NO3,
NiCl2 + NH3*H2O → NiOHCl + NH4Cl
2NiSO4 + 2 NH3*H2O → Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) NiCl2, (или нитрата Ni(NO3)2, или сульфата NiSO4) прибавляют по каплям при перемешивании разбавленный раствор аммиака до выпадения зеленого осадка NiOHCl. Добавляют по каплям при перемешивании концентрированный (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 → [Ni(NH3)6]2+ + OH- + Cl-
Оксисоль Ni(II) гексамминникель (II) катион
Осторожно нагревают смесь и прибавляют к ней по каплям концентрированный раствор KBr до выпадения фиолетового осадка [Ni(NH3)6]Br2.
· Комплексы [Ni(NH3)6]Cl2, [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
3. Реакция с реактивом Чугаева (диметилглиоксимом).
O …… H-O
 |  |



 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3
 Ni2++ → Ni + 2 Н+, при рН≈6-9
Ni2++ → Ni + 2 Н+, при рН≈6-9

 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3


О-Н…….. О
Розово-красный
Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Методика. а). В пробирку вносят 3-4 капли раствора соли никеля (II), прибавляют 3-4 капли концентрированного раствора аммиака и 1 каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса.
б). Капельный метод: на листок фильтровальной бумаги наносят каплю раствора соли никеля (II), затем - каплю спиртового раствора диметилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака до появления розово-красного пятна.
· Проба на растворимость. Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
v Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4. Реакция с сульфид - ионами.
Ni2+ + S2- → NiS↓ (черный)
Методика. В пробирку вносят 3-4 капли раствора соли Ni2+, прибавляют 3-4 капли сульфида аммония (или Na2S), или сероводородную воду. Выпадает черный осадок NiS.
5. Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Py) образуют голубой осадок комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды – черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой –сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
6.5. Аналитические реакции катиона ртути (II) Hg2+.
Акво - ионы ртути (II) [Hg(H2O)n]2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
1. Реакция с щелочами (фармакопейная).
Hg2+ + 2 OH- → HgO↓(желтый) + Н2О
Методика. В пробирку вносят 3-4 капли водного раствора соли ртути (II) и прибавляют по каплям водный раствор NaOH или КОН. Выпадает желтый осадок оксида ртути (II) состава HgO.
· Проба на растворимость. Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4]2-:
HgO + 2 HNO3 → Hg(NO3)2 + H2O
HgO +2 Cl- + H2O → HgCl2 + 2 OH-
HgO +4 I- + H2O → [HgI4]2- + 2 OH-
2. Реакция с аммиаком.
HgCl2 + 2 NH3 → HgNH2Cl↓(белый) + NH4Cl
2 Hg(NO3)2 + 4 NH3 + H2O → [OНg2NH2]NO3↓(белый) + 3 NH4NO3
Методика. В одну пробирку вносят 3-4 капли водного раствора хлорида ртути (II) HgCl2, а в другую - столько же водного раствора нитрата ртути (II) Hg(NO3)2. В каждую пробирку прибавляют по каплям водный раствор аммиака до выпадения белых осадков.
· Проба на растворимость. Осадки растворяются (лучше – при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути (II) [Нg(NH3)4]2+.
· После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям – водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ → [Нg(NH3)4]2+ + Cl-
[OНg2NH2]NO2 + 4 NH3 +3 NH4+ → 2 [Нg(NH3)4]2+ +NO3- + H2O
3. Реакция с иодидом калия (фармакопейная).
Hg2+ + 2 I- → HgI2↓(красный)
HgI2 + 2 I- → [HgI4]2- (бесцветный)
Методика. а). В пробирку вносят 2-3 капли раствора соли ртути (II) и прибавляют каплю разбавленного (5%-го) раствора иодида калия. Выпадает красный осадок иодида ртути (II) HgI2.
При дальнейшем прибавлении по каплям (при встряхивании) раствора иодида калия осадок растворяется с образованием бесцветного раствора.
б). Капельный метод: на лист фильтровальной бумаги наносят каплю разбавленного водного раствора иодида калия, затем – каплю раствора соли ртути (II). Возникает красно-оранжевое пятно. При дальнейшем добавлении по каплям раствора иодида калия пятно обесцвечивается.
Проведению реакции мешают катионы Pb2+, Cu2+, Ag+, Bi(III), а также окислители. Капельный метод рекомендуется для открытия Hg2+ даже в присутствии мешающих катионов.
4. Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто – красную и бурую на коричнево-черную при избытке сульфид – ионов.
3 HgCl2 + 2 H2S → 2 HgS * HgCl2↓(белый) + 4 HСl
2 HgS * HgCl2 + H2S → 3 HgS↓(коричнево-черный) + 2 НСl
Аналогично протекает реакция HgCl2 с сульфидом натрия Na2S.
Методика. В пробирку вносят 2-3 капли раствора хлорида ртути (II) HgCl2 и прибавляют по каплям раствор сульфида натрия Na2S или сероводородной воды. Выпадает белый осадок, чернеющий при дальнейшем прибавлении раствора Na2S или H2S.
· Проба на растворимость. HgS не растворяется в разбавленной азотной кислоте, но растворим в царской водке (смесь HCl +HNO3).
3 HgS +6 HСl + 2 HNO3 → 3 HgCl2 + 2 NO + 3S + 4 H2O
5. Реакция с хлоридом олова (II).
Катионы Hg2+ восстанавливается олово (II) вначале до Hg22+, а затем – до металлической ртути Hg0.
2 Hg2+ + [SnCl4]2- + 4 Cl- → Hg2Cl2↓(белый) + [SnCl6]2-
Hg2Cl2 + [SnCl4]2- → 2 Hg0 (темный) + [SnCl6]2-
Методика. а). В пробирку вносят 2-3 капли раствора HgCl2 и прибавляют по каплям соляно кислый раствор хлорида олова (II). Выпадает белый осадок Hg2Cl2, который постепенно темнеет.
б). Капельный метод: при нанесении на фильтровальную бумагу капли раствора хлорида олова (II) и капли раствора хлорида ртути (II) появляется темное пятно.
Проведению реакции мешают катионы Ag2+, Hg22+, Sb(III), Bi(III).
6. Реакция с металлической медью.
Катионы Hg2+ восстанавливаются металлической медью до металлической ртути.
Hg2+ + Cu0 → Hg0 (темный) + Cu2+
Методика. На медную поверхность наносят каплю раствора соли ртути (II). На поверхности возникает темное пятно, которое при протирании фильтровальной бумагой становится серебристо-блестящим.
7. Реакция с хромат – ионами.
Hg2+ + CrO42- → HgCrO4↓(желтый)
Методика. В пробирку вносят 2-3 капли раствора соли ртути (II) и прибавляют 2-3 капли раствора хромата калия K2CrO4. Выпадает желтый осадок HgCrO4.
8. Другие реакции катионов ртути (II).
Катионы Hg2+ с ортофосфат – ионами образуют белый осадок Hg3(PO4)2; с дифенилкарбазидом и дифенилкарбазоном – комплекс сине-фиолетового цвета; с дитизоном – желто-оранжевый или красный комплекс, в зависимости от условий проведения реакции.
Последнее изменение этой страницы: 2016-08-29
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...