
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Курение матери во время беременности
Несмотря на то что неблагоприятное влияние курения на здоровье является доказанным фактом, число курящих женщин в мире достаточно велико, и во время беременности курят от 14 до 35 % женщин (Иванов В. М., Осокина Л. Г., 1995). Курение во время беременности чаще наблюдается на фоне низкого социально-экономического статуса и низкой социальной поддержки семьи, низкого образовательного уровня матери и ее юного возраста, незапланированной беременности, незарегистрированности брака (Литвина С. В., 2000). Курение во время беременности повышает риск спонтанных абортов, и этот риск возрастает с числом выкуриваемых ежедневно сигарет (Chatenoud L. [et al.], 1998), оно увеличивает риск преждевременных родов (Andres R. L., Day M. C., 2000). Курение матери во время беременности является фактором риска нарушения роста и развития плода. Описывают рождение детей с внутриутробной гипотрофией, последующим нарушением периода адаптации в периоде новорожденности, длительной желтушностью, замедлением восстановления первоначальной потери массы тела, что обозначается как «табачный синдром плода» (Гавалов С. М., Соболева М. К., 1991). Выявлена ассоциация курения матери во время беременности с повышенной вероятностью гибели плода в периоде внутриутробного развития и в периоде новорожденности (Tuthill D. P. [et al.], 1999).
Вопрос о возможном тератогенном действии курения матери в течение беременности (т. е. возможности формирования на фоне курения грубых пороков развития у плода) остается открытым. Высказано предположение, что курение женщины во время беременности может изменять генотип ребенка, увеличивая число так называемых транслокаций (Pluth J. M. [et al.], 2000). Показано, что курение матери во время беременности приводит к повышению риска формирования некоторых пороков развития у ребенка, в частности расщелины верхней губы и твердого нёба (Beaty T. H. [et al.], 1997), поликистоза почек, дефекта перегородок сердца, краниостеноза (Kallen K., 1999). Подобные эффекты частично связывают с гипоксией плода вследствие увеличения уровня карбоксигемоглобина в крови у матери на фоне курения (Haustein K. О., 1999). Обсуждается также и возможность передачи канцерогенов, образующихся на фоне курения в организме женщины, к плоду через плаценту (Lackmann G. M. [et al.], 1999). Так называемое пассивное курение женщины во время беременности может также оказывать влияние на плод, что доказывается повышением уровня метаболита никотина (котинина) в моче новорожденных детей (Haustein K. О., 1999). Имеются подтверждения тому, что дети, рожденные курящими матерями, имеют меньшую массу и длину тела при рождении (Horta B. L. [et al.], 1997). Дети могут отставать в физическом развитии в течение всего первого года жизни, а продолжение курения матерью на фоне грудного вскармливания приводит к значимому сокращению прироста массы тела и других антропометрических показателей в первые месяцы жизни ребенка (Кельмансон И. А., 1999). Курение матери во время беременности почти в три раза повышает риск рождения детей с задержкой внутриутробного развития (Secker-Walker R. H. [et al.], 1998). Приводятся данные, согласно которым прекращение курения женщиной перед наступлением беременности или в самом начале беременности способствует увеличению показателей функции внешнего дыхания матери и массы тела ребенка при рождении (Das T. K. [et al.], 1998). Дефицит массы тела при рождении ребенка может быть также связан с низкой концентрацией витамина Е в плазме крови у беременных женщин на фоне курения и, как следствие, увеличением перекисного окисления липидов, снижением трансплацентарной перфузии (Kiely M. [et al.], 1999).
Большого интереса заслуживает возможное влияние курения матери во время беременности на заболеваемость детей в постнатальном периоде. Отмечается общее увеличение заболеваемости детей на первом году жизни, более частое обращение за медицинской помощью (Morales A. W. [et al.], 1997). Показано, что выкуривание женщиной более 15 сигарет в день во время беременности существенно увеличивает вероятность госпитализаций детей в течение первых 8 мес. жизни, а поводом для госпитализаций являются бронхолегочные заболевания, патология желудочно-кишечного тракта, болезни кожи (Wisborg K. [et al.], 1999). Курение матери в течение беременности приводит к более частым эпизодам так называемых колик у детей первого года жизни (Haggart M., Giblin M. J., 1988; Sondergaard C. [et al.], 2001). Более частые инфекции нижних респираторных отделов у детей первых месяцев жизни сочетаются с повышенной концентрацией продуктов распада никотина в первородном кале в периоде новорожденности, что косвенно подтверждает связь курения матери во время беременности с последующим возрастанием частоты бронхолегочных заболеваний у детей (Nuesslein T. G. [et al.], 1999). Курение матери во время беременности повышает риск заболеваний острым средним отитом ребенка первого года (Ey J. L. [et al.], 1995). Оно оказывает неблагоприятное влияние на кроветворение ребенка: выявляется нарушение метаболизма железа, процессов синтеза гемоглобина, что может приводить к возрастанию риска анемии на 1-м году жизни; наблюдается задержка перехода к выработке у ребенка гемоглобина взрослого типа, а также более высокий уровень карбоксигемоглобина в крови у детей (Гавалов С. М. [и др.], 1991; Cochran-Black D. L. [et al.], 2001). Дети, подвергшиеся антенатальному воздействию никотина, имеют повышенный риск пищевой сенсибилизации и аллергических реакций на протяжении первых 3 лет жизни (Kulig M. [et al.], 1999).
Внимание многих исследователей привлекает вопрос о влиянии курения матери в течение беременности на особенности гемодинамики и характеристики сердечного ритма ребенка, риск возможных расстройств дыхания. Курение матери во время беременности приводит к повышению цифр артериального давления у новорожденных и у детей первого года жизни (Beratis N. G. [et al.], 1996). Имеются данные о том, что курение матери во время беременности сохраняет свое неблагоприятное влияние на показатели артериального давления детей и в последующие возрастные периоды (Morley R. [et al.], 1995). Курение в течение беременности может нарушать регуляцию сердечного ритма у ребенка (Browne C. A. [et al.], 2000). Дети, матери которых курили во время беременности, характеризуются снижением показателей функции внешнего дыхания (Cunningham J. [et al.], 1994; Jedrychowski W. [et al.], 1997; Hoo A. F. [et al.], 1998). Выявлена ассоциация между курением матери в течение беременности и рецидивирующими эпизодами свистящего дыхания, определяемыми у детей раннего возраста (Karaman O. [et al.], 1999; Henderson A. J. [et al.], 2001).
Курение женщины во время беременности и после родов считается одним из важнейших факторов риска синдрома внезапной смерти младенцев (СВСМ) (Кельмансон И. А., 1996; 2006; 2010). Механизм, благодаря которому курение матери во время беременности способствует повышению риска СВСМ, окончательно не расшифрован. В то же время показано, что антенатальное воздействие никотина на плод вызывает нарушение функций нейроэндокринных клеток легких новорожденного, приводит к повреждению проводящей системы сердца, изменяет соотношение адренергических и холинергических синапсов в мозге. Приводятся данные о том, что курение матери во время беременности повышает порог реакции пробуждения ребенка во время сна в ответ на гипоксию. Выявлена связь частоты и продолжительности патологических остановок дыхания (апноэ) во время сна у детей первого года жизни с количеством сигарет, выкуриваемых матерью во время беременности (Кельмансон И. А., 2006). Подобные апноэ у детей часто сопровождаются такими симптомами, как ночной храп и шумное дыхание во сне, беспокойство во сне, повышенное ночное потоотделение. В свою очередь, эти симптомы также чаще выявляются у детей первого года жизни, матери которых курили в течение беременности. Все отмеченные нарушения рассматриваются как вероятные механизмы СВСМ (Кельмансон И. А., 2006).
Качество сна детей первого года жизни существенно нарушается на фоне курения матери во время беременности. В частности, дети чаще испытывают трудности при засыпании, пробуждаются, и их труднее успокоить (Kelmanson I. A., 2009; 2011).
У детей, подвергшихся антенатальному воздействию никотина, выявлены последующие неврологические нарушения. Так, отмечается более низкая оценка новорожденного по шкале Брейзелтона (Oyemade U. J. [et al.], 1994), измененный крик новорожденных (Nugent J. K. [et al.], 1996), их повышенная раздражительность (Pichini S., Garcia-Algar O., 2006), более частые признаки мышечной гипертонии и повышенной возбудимости у детей в возрасте до одного месяца (Fried P. A. [et al.], 1987). Выявлена связь курения матери во время беременности со снижением реакции на слуховые раздражители у детей первой недели жизни (Fried P. A., Makin J. E., 1987), более высокой интенсивностью реакций в 2–4 мес. (Kelmanson I. A. [et al.], 2002), задержкой предречевого развития детей 8 мес. (Obel C. [et al.], 1998), более низкими оценками уровня психического развития детей к концу первого года жизни и нарушением их ответа на слуховой тест в 1 и 2 года (Fried P. A., Watkinson B., 1988). Обращают внимание на ухудшение интеллектуальных способностей и успеваемости в дошкольном и школьном возрасте тех детей, матери которых курили во время беременности, а также на более частое выявление у них признаков дефицита внимания и гиперактивности (Naeye R. L., Peters E. C., 1984; Fried P. A., Watkinson B., 1990; Sexton M. [et al.], 1990). Указывают также на связь курения матери во время беременности с повышенным риском задержки психического развития (Drews C. D. [et al.], 1996), девиантного поведения и психических расстройств у ребенка в школьном и подростковом возрасте (Fergusson D. M. [et al.], 1993; 1998; Orlebeke J. F. [et al.], 1999).
Алкоголь и наркотики
Неблагоприятное влияние алкоголя на развитие плода у беременной женщины было известно из трудов Аристотеля еще в III в. до н. э. (Mazzadri F. C., 1992). Что касается научных исследований по этой проблеме, то они появились лишь в начале XIX в. (Ulleland C. N., 1972). В середине XX в. были опубликованы работы (Таболин В. А., Урывчиков Г. А., 1986; Lemoine P. [et al.], 1968; Smith D. W., 1979), из которых стало известно, что у новорожденных, родившихся у матерей, злоупотребляющих алкоголем, выявляется характерный симптомокомплекс, названный авторами «алкогольный синдром плода» (АСП) («fetal alcohol syndrome, FAS»). Частота АСП в ряде стран Западной Европы и США составляет 0,97 на 1000 новорожденных, а среди детей, матери которых употребляли алкоголь во время беременности, распространенность этого синдрома достигает 4,3 % (Abel E. L., 1995). Менее серьезные последствия алкоголизации матерей, не укладывающиеся в типичную картину АСП, обычно обозначаются как алкогольные эффекты у плода (АЭП).
Патогенез АСП изучен недостаточно. Установлено, что алкоголь (этанол) сравнительно быстро проникает через плаценту и гематоэнцефалический барьер плода и в повышенных количествах накапливается в тканях, богатых липидами (ЦНС). Присутствие этанола обнаружено также в амниотической жидкости, в связи с чем возникло предположение о проникновении этого вещества, минуя плаценту.
Большое значение в патогенезе АСП, по-видимому, имеют патологические изменения в самой плаценте (дистрофические изменения ворсин хориона, нарушения процессов микроциркуляции). Одним из возможных факторов тератогенного действия этанола является нередко встречающееся при АСП недоразвитие одной из артерий пуповины.
Известную роль в патогенезе АСП играют морфофункциональные нарушения в печени плода. Характерно, что в печени плода отсутствует алкогольдегидрогеназа, которая разрушает этанол у взрослого человека (Савельева Г. М. [и др.], 2000).
Развитие АСП может быть обусловлено прямым воздействием на эмбрион и плод не только этилового спирта, но и его важнейшего метаболита – ацетальдегида. Это соединение особенно активно переходит к плоду в первом триместре беременности, когда происходят активные процессы дифференцировки важнейших органов и тканей (критический период развития).
Диагностика АСП основывается на наличии характерной триады признаков (Савельева Г. М. [и др.], 2000; Astley S. J., 1999):
– замедление роста;
– нарушение структуры и функции ЦНС;
– характерные аномалии лицевого черепа, внутренних органов, конечностей и других систем организма.
Помимо этих трех критериев для точной диагностики АСП требуются сведения об алкоголизации матери во время беременности.
Повреждения ЦНС выражаются в развитии микроцефалии, нарушениях интеллекта и координации движений, состоянии возбуждения. Эти явления, возникающие в период новорожденности, сохраняются на многие годы. Средний уровень IQ пациентов составляет 65–70, однако дети с наиболее тяжелыми морфологическими аномалиями и самыми низкими показателями роста обнаруживают также и наиболее выраженные проявления снижения интеллекта. У младенцев и детей раннего возраста с проявлениями АСП отмечается низкая активность при сосании материнской груди, задержка речевого и двигательного развития, нарушения тонкой моторики, нарушения слуха. Часты случаи формирования синдрома дефицита внимания и гиперактивности. Судорожный синдром наблюдается в 20 % случаев АСП, хотя он и не рассматривается в качестве типичного проявления данного состояния.
Задержка роста возникает еще в период антенатального развития и становится особенно заметной после рождения ребенка. С возрастом масса пациента может приближаться к средним показателям, однако стойко сохраняется отставание в росте и малая окружность головы.
Характерны аномалии развития лицевого черепа: микрофтальмия (уменьшение размера глазного яблока), удлинение лица, низкий лоб, выраженное недоразвитие подбородка, маленький седловидный нос, дисплазия ушных раковин, большой широко открытый рот, блефароптоз (опущение века), косоглазие, уменьшение длины глазных щелей, уплощение затылка (Astley S. J., 1999) (рис. 36). Сочетание этих симптомов делает внешний вид таких детей весьма характерным и облегчает диагностику АСП. Лицевые дисморфические признаки с возрастом становятся менее отчетливыми, хотя некоторые черты (например, короткая глазная щель) стойко сохраняются.
Из других аномалий развития сравнительно часто встречаются врожденные пороки сердца, множественные гемангиомы (сосудистые опухоли), неправильное развитие верхних и нижних конечностей. Перинатальная смертность при данном синдроме высокая, поэтому систематическое употребление алкоголя во время беременности является фактором высокого риска развития перинатальной патологии.

Рис. 36 . Внешний вид ребенка с алкогольным синдромом плода (по: Astley S. J., 1999)
Таким образом, выраженное тератогенное и эмбриотоксическое действие этилового спирта на плод является основанием для полного запрещения употребления всех спиртных напитков во время беременности. При возникновении беременности у женщин, страдающих хроническим алкоголизмом, целесообразно ставить вопрос об искусственном прерывании беременности (Савельева Г. М. [и др.], 2000).
Употребление кокаина во время беременности может привести к развитию врожденных пороков ЦНС, мочеполовой системы, самопроизвольному выкидышу, отслойке плаценты. Отмечается повышенный риск развития задержки внутриутробного развития плода, последующей задержки психического развития ребенка, а также повышение риска синдрома внезапной смерти младенца (Hutchings D. E., 1993). Героин и метадон оказывают воздействие на формирующиеся опиатные рецепторы ЦНС плода. У новорожденных, матери которых употребляли эти наркотики, отмечаются преходящие, но сильно выраженные признаки синдрома отмены, сопровождающиеся выраженным раздражением ЦНС. Подобный синдром отмены может представлять угрозу для жизни новорожденного (Hutchings D. E., 1990). Прием марихуаны приводит к неврологическим расстройствам у новорожденных: у них отмечается синдром отмены, а начиная с 3 лет у этих детей нередко выявляются низкие показатели IQ (Day N. L. [et al.], 1994), проявления синдрома дефицита внимания и гиперактивности (Fried P. A. [et al.], 1992), признаки задержки психического развития (Fried P. A., 1993).
Внутриутробные инфекции
Под термином «внутриутробное инфицирование» понимают факт внутриутробного заражения. Внутриутробное заражение ребенка встречается значительно чаще, чем развиваются клинические признаки инфицирования. Для обозначения клинических проявлений инфекционной болезни плода и новорожденного, источником которой является мать, выявленных в пренатальном периоде или вскоре после рождения, используют термин «внутриутробная инфекция» (ВУИ) (Сенчук А. Я., Дубоссарская З. М., 2005). Развитие инфекционного заболевания плода, тяжесть поражения, локализация и распространенность патологического процесса, темпы его реализации, а также исход возникшей патологии определяются видом возбудителя, его вирулентностью, тропизмом к тканям плаценты и плода, а также тем, какими путями микроорганизмы проникли от матери к плоду. Важная роль в этом случае принадлежит состоянию защитных резервов матери и способности плода к иммунному ответу. Для реализации внутриутробного инфицирования важен также временной фактор, т. е. срок беременности, во время которого плод был инфицирован, особенно вирусными агентами. Известно, что параллелизм между тяжестью инфекционного процесса у матери и у плода может отсутствовать. Легкая, мало– или даже бессимптомная инфекция у беременной может привести к тяжелым поражениям плода или к его гибели. Этот феномен в значительной степени обусловлен тропизмом возбудителя (особенно вирусного) к определенным эмбриональным тканям, а также тем, что клетки плода с их высоким уровнем метаболизма и энергетики являются идеальной средой для размножения инфекционных агентов. Этим и объясняется значительное сходство патологии эмбриона и плода, вызываемой разными инфекционными возбудителями. Частота внутриутробного инфицирования составляет около 10 % всех беременностей. Частота ранней неонатальной заболеваемости и смертности при внутриутробном инфицировании колеблется от 5,3 до 27,4 %, а мертворождаемость достигает 16,8 % (Сенчук А. Я., Дубоссарская З. М., 2005). Характеристики важнейших ВУИ представлены в Приложении II.
При ВУИ, возникших в первые 3 мес. беременности, соответствующие периодам органогенеза и плацентации, возникают инфекционные эмбриопатии, для которых характерны пороки развития, плацентарная недостаточность, самопроизвольные выкидыши. Ведущую роль в возникновении эмбриопатий играют микроорганизмы с внутриклеточным циклом развития (в частности, вирусы), обладающие высоким тропизмом к эмбриональным тканям (Савельева Г. М. [и др.], 2000). В случае возникновения ВУИ после 3 мес. гестации развиваются инфекционные фетопатии, которые сопровождаются внутриутробной задержкой роста плода, формированием вторичной плацентарной недостаточности, возникновением так называемых стигм дизэмбриогенеза, а также собственно инфекционным поражением плода. В раннем фетальном периоде еще не происходит локализации воспалительного процесса, поэтому ВУИ, как правило, протекает генерализованно, сопровождается нарушением маточно-плацентарного кровообращения, дистрофическими, некробиотическими реакциями, нарушением формообразовательных процессов с избыточным разрастанием соединительной ткани (глиоз мозга, эндокардиальный фиброэластоз). Воспалительные изменения пролиферативного характера могут вызвать сужение или закупорку существующих анатомических каналов и отверстий с последующим развитием аномалии уже сформированного органа (гидроцефалия, гидронефроз). Во второй половине фетального периода (с 6—7-го месяца) благодаря становлению клеточного и гуморального иммунитета плод приобретает способность специфически реагировать на внедрение возбудителей инфекции.
Наиболее характерными клиническими симптомами ВУИ являются многоводие, стойкая тахикардия у плода, задержка роста плода, реже встречается маловодие.
Наибольшую опасность для эмбриона с точки зрения тератогенного действия представляет вирус краснухи (rubella ). При беременности риск заражения краснухой существует в случае отсутствия в крови матери антител к антигену вируса краснухи. Заболевание у матери протекает относительно легко и проявляется умеренной лихорадкой, фарингитом и шейным лимфаденитом. Частота дефектов у плода зависит от срока беременности, в течение которого произошло заражение. По имеющимся данным, при заражении в течение 1-го месяца беременности плод оказывается пораженным в 22 % случаев, в течение 2-го – в 25,2 %, в течение 3-го месяца – в 14,2 % случаев (Dudgeon J. A., 1976). При заражении краснухой после 3 мес. беременности частота дефектов у плода соответствует популяционной. Перинатальная и ранняя детская смертность при синдроме краснухи исключительно велики. Оставшиеся в живых рождаются с признаками гипотонии, задержки внутриутробного развития, в дальнейшем дети отстают в психическом развитии, у 11,2 % таких детей наблюдаются микроцефалия, реже гидроцефалия. Почти в 50 % случаев обнаруживаются аномалии развития зубов: позднее появление молочных зубов, гипоплазия и аплазия их (Лазюк Г. И., 1991). Принимая во внимание высокий риск возникновения эмбриопатий в случае развития заболевания в первые 3 мес. беременности, необходимо ее прерывать (Савельева Г. М. [и др.], 2000). Введение глобулина беременным, больным краснухой, приводит к незначительному снижению частоты аномалий развития плода. Ребенок, родившийся у женщины, перенесшей во время беременности краснуху, является носителем вируса, поэтому необходима его изоляция. При подозрении на контакт беременной с больным краснухой, в случае если она не болела ею в детстве или более позднем возрасте, необходима вакцинация, но не ранее 8—10 нед. гестации, так как с этой целью используют живую ослабленную вакцину и возможен тератогенный эффект. По рекомендации ВОЗ, женщинам детородного возраста вне беременности проводят тестирование крови на наличие соответствующих антител. Мерой профилактики является иммунизация вакциной краснухи школьниц и женщин детородного возраста.
Опасность для плода представляет и вирус цитомегалии. Вирус цитомегалии обычно поражает плод на 3—4-м месяце и приводит к развитию фетопатий. Как следствие, формируются пороки развития головного мозга. Нередко формируются микрофтальмия, катаракта, кистозный фиброз поджелудочной железы, цирроз печени с атрезией желчных протоков, мелкие кисты в легких и почках (Лазюк Г. И., 1991). У детей возникает специфическое нарушение функции клеточного звена иммунитета. Бессимптомное носительство вируса цитомегалии выявляют у 90 % новорожденных. Летальность при врожденной цитомегаловирусной инфекции достигает 20–30 %, а у 90 % выживших детей отмечаются поздние осложнения (потеря слуха, задержка умственного и физического развития, хориоретинит, атрофия зрительного нерва, дефекты роста зубов и т. д.). Как следствие, внутриутробная цитомегалия выступает одним из факторов формирования сложных нарушений развития у детей. При хронической или латентной цитомегаловирусной инфекции у беременной показано иммунологическое исследование не реже 1 раза в 1,5–2 мес. для выявления IgM-антител или увеличения концентрации суммарных противоцитомегаловирусных антител. В случае реактивации инфекции и при наличии острого процесса во время беременности отдельные авторы рекомендуют определять специфические антитела класса IgM в крови плода. Лечение заключается в проведении курсов пассивной иммунизации противоцито-мегаловирусным иммуноглобулином. Число курсов зависит от особенностей течения инфекционного процесса. Специфический противовирусный препарат ацикловир применяют по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Перспективным является использование виферона, который представляет собой рекомбинантный препарат интерферона, ассоциированный с антиоксидантами. Вопрос о медицинских показаниях к прерыванию беременности требует индивидуального подхода, базирующегося на применении ряда современных методов обследования в целях контроля состояния и развития плода (Савельева Г. М. [и др.], 2000).
Вирус простого герпеса (HSV) играет значительную роль в акушерской практике. HSV-2, или генитальный вирус герпеса, вызывает неонатальную инфекцию в 75–80 % случаев. При хроническом течении герпеса в процессе родов инфицируются 0,5–1 % плодов. При остром генитальном герпесе и явном обострении хронического (что проявляется пузырьковыми поражениями кожи и слизистых оболочек у матери) риск инфицирования плода в родах достигает 40 %. При герпетической инфекции поражения плаценты и плода могут возникать на любом сроке беременности (Савельева Г. М. [и др.], 2000). Инфицирование плода при сроке беременности до 20 нед. приводит к спонтанному аборту или аномалиям развития плода в 34 % случаев, при сроке от 20 до 32 нед. – к преждевременным родам или антенатальной гибели плода в 30–40 % случаев, после 32 нед. – к рождению больного ребенка с поражением кожи (герпетические высыпания, изъязвления), глаз (катаракта, микрофтальмия, хориоретинит) и ЦНС (микро– или гидроцефалия, церебральные некрозы) (Лазюк Г. И., 1991). Возможно и постнатальное инфицирование новорожденных при наличии герпетических проявлений на коже у матери, других родственников или медицинского персонала. Следует отметить тяжесть проявлений герпетической инфекции у новорожденных: менингоэнцефалит, сепсис. Летальность достигает 50 %. У выживших детей в дальнейшем возникают тяжелые осложнения (неврологические расстройства, нарушения зрения, отставание в психомоторном развитии).
При наличии у беременной герпетической инфекции характер профилактических и лечебных мероприятий, а также акушерская тактика зависят от характера высыпаний (первичный или рецидивирующий герпес), наличия поражений половых органов, состояния плодных оболочек. При первичном инфицировании беременной в ранние сроки беременности необходимо ставить вопрос о ее прерывании (Савельева Г. М. [и др.], 2000). Если же заболевание возникает в более поздние сроки или женщина была инфицирована до наступления беременности, мероприятия заключаются в проведении динамического контроля состояния плода, назначении курсовой терапии, включающей препараты, воздействующие на метаболизм, стабилизаторы клеточных мембран. Вопрос о прерывании беременности в этих случаях решают индивидуально. В качестве противовирусной терапии применяют препарат ацикловир. Назначение препарата в I триместре при неосложненном течении инфекции нежелательно. Во II триместре ацикловир назначают по 200 мг внутрь каждые 4 ч, однако при осложненном течении заболевания (пневмония, энцефалит, коагулопатия) необходимо внутривенное введение препарата. Особого внимания заслуживает тактика ведения родов у женщин с первичным и рецидивирующим герпесом. Метод родоразрешения зависит от наличия или отсутствия поражения половых органов в конце беременности, выделения вируса герпеса и времени, прошедшего с момента разрыва плодных оболочек. В случае герпетического поражения половых органов женщины в конце беременности родоразрешение рекомендуется проводить путем кесарева сечения.
Большое внимание уделяется внутриутробному токсоплазмозу. Возбудителем является одноклеточный протозойный паразит Toxoplasma gondii . Окончательными хозяевами паразита являются различные представители семейства кошачьих. Заражение человека происходит при прямом и непрямом контакте с кишечными выделениями животных, а также при употреблении в пищу инфицированных овощей или мяса. Риск развития заболевания у плода составляет 25 % в первом триместре беременности и 65 % во втором триместре. Поражение плода на ранних сроках гестации может быть причиной развития микроцефалии, микрогирии, гидроцефалии, ложной порэнцефалии, умственной отсталости и микрофтальмии. При заражении в более поздних стадиях развития плода при его рождении может быть выявлена характерная триада симптомов: гидроцефалия, хориоретинит (воспаление сетчатки) и менингоэнцефалит с внутримозговыми кальцификатами (рис. 37). Если заражение произошло незадолго до родов, то у плода возникают симптомы генерализованного токсоплазмоза: увеличение печени и селезенки, пневмония, миокардит и энцефалит. Помимо тяжелых острых форм врожденного токсоплазмоза, могут наблюдаться и легкие формы. Диагностика токсоплазмоза у беременных сопряжена со значительными трудностями. Заболевание диагностируют на основании обнаружения возбудителей в тканях и жидкостях больной и результатов серологических исследований. Профилактика и лечение врожденного токсоплазмоза заключаются в назначении беременной сульфаниламидных препаратов и антипротозойных средств.
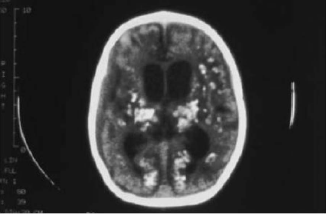
Рис. 37. Гидроцефалия и диффузные кальцификаты в головном мозге, типичные для внутриутробного токсоплазмоза (по: Steele R. W., 2007)
Перечисленные инфекции с 1971 г. нередко объединяются собирательным термином TORCH-инфекции (от Т – Toxoplasmosis ; O – other , другие инфекции; R – Rubella ; С – Cytomegalovirus ; Н – Herpes simplex virus ). Для всех этих инфекций характерны, в частности, такие общие симптомы у новорожденного ребенка, как желтуха, увеличение печени и селезенки, а также характерная сыпь (рис. 38). Урогенитальный хламидиоз (УГХ) – это заболевание привлекает к себе пристальное внимание в связи со значительным числом акушерских и перинатальных осложнений. УГХ диагностируют у 3—12 % беременных, при хронических заболеваниях урогенитального тракта частота его достигает 51–70 %. Неблагоприятное влияние УГХ на рост и развитие плода проявляется в виде хламидийной фетопатии (хроническая гипоксия и задержка роста плода) (Савельева Г. М. [и др.], 2000; Шабалов Н. П., 2003). У 40–50 % новорожденных выявляют клинически выраженные проявления инфекции – конъюнктивит (у 35–50 %) и пневмонию (у 11–20 %). Одновременно могут проявляться и другие признаки врожденного хламидиоза: фарингит, отит, вульвовагинит, уретрит, пневмония. У недоношенных детей после пневмонии возможно развитие генерализованной инфекции и специфического миокардита, описаны случаи хламидийного менингита и энцефалита. Лечение беременных заключается в проведении 10—14-дневных курсов антибактериальной терапии.

Рис. 38 . Сыпь у ребенка с TORCH-инфекцией (по: Steele R. W., 2007)
Урогенитальные микоплазмозы вызываются условно-патогенными микроорганизмами урогенитального тракта (Mycoplasma genitalis, Mycoplasma urealyticum ). Заболевания диагностируют у 2–8 % беременных, а у больных с хроническими урогенитальными заболеваниями и отягощенным акушерским анамнезом частота микоплазмозов достигает 16–40 %. У каждой четвертой больной во время беременности инфекция протекает без клинических проявлений (в виде бактерионосительства). С длительным присутствием в организме беременной этой инфекции связывают такие акушерские осложнения, как невынашивание беременности, задержка роста плода, хориоамнионит. Плацентиты (воспаления плаценты) выявляют у 23 % беременных с микоплазмозом, причем у подавляющего большинства из них воспалительные изменения в плаценте сочетаются с многоводием (Савельева Г. М. [и др.], 2000; Шабалов Н. П., Цвелев Ю. В., 2004). Наиболее частым клиническим проявлением инфекции у новорожденного ребенка является пневмония. Отмечается склонность к распространению возбудителя с током крови, обусловливающая тяжелое течение заболевания (неврологическая симптоматика, геморрагический синдром, острая гидроцефалия). У недоношенных новорожденных микоплазмы вызывают развитие пневмонии, менингита, генерализованной инфекции. Лечение беременных заключается в назначении антибактериальной терапии. Эффективными антибиотиками в отношении микоплазменной инфекции являются гентамицин и линкомицин. С целью профилактики внутриутробного инфицирования плода необходимо проводить обследование беременных женщин, имеющих указания на выкидыш, хронический аднексит, преждевременные роды, пиелонефрит.
Гонорея – возбудителями заболевания являются бактерии Neisseria gonorrhoea . Во время беременности гонорея характеризуется стертой клинической картиной. Могут отмечаться слизисто-гнойные выделения из влагалища с неприятным запахом. У 70–80 % больных очаги поражения локализуются в области уретры и цервикального канала. Беременность и роды на фоне гонореи протекают неблагоприятно. Инфицирование во время беременности приводит к преждевременному прерыванию беременности, инфицированию плода. Инфицирование плода происходит и во время родов. Основным проявлением гонореи новорожденных является так называемая гонобленнорея с симптомами гнойного конъюнктивита. Нелеченая гонобленнорея нередко приводит к слепоте, составляя 24 % от всех причин, обусловливающих эту патологию. Часто наблюдаются внутриутробная задержка роста плода, патологическое уменьшение массы тела в раннем неонатальном периоде, нарушение адаптационных реакций новорожденного, затянувшаяся желтуха. У ослабленных и недоношенных новорожденных может развиться генерализованная гонококковая инфекция (Савельева Г. М. [и др.], 2000; Шабалов Н. П., Цвелев Ю. В., 2004). Лечение гонореи проводится антибиотиками пенициллинового ряда на любом сроке беременности. В случае неэффективности последних применяют эритромицин, цефалоспорины второго и третьего поколений, аминогликозиды.
Помимо перечисленных неблагоприятных последствий ВУИ для течения беременности и развития плода, необходимо отметить доказанную роль, которую играют любые переносимые матерью инфекционные заболевания во время беременности в формировании последующего высокого риска психических нарушений у потомства: как в детском возрасте, так и во взрослом состоянии. Перенесенные матерью во время беременности инфекции относятся к важнейшим негенетическим факторам риска развития шизофрении. Впервые такая связь была установлена в отношении гриппа (Mednick S. A. [et al.], 1988; Bagalkote H. [et al.], 2001). Риск развития шизофрении у потомства на фоне перенесенного матерью гриппа во время беременности повышается в 3–7 раз, а в связи с достаточной распространенностью этой инфекции и высокой заболеваемостью гриппом до 21 % всех случаев шизофрении в популяции могут быть отнесены к неблагоприятным последствиям перенесенного матерью во время беременности гриппа (Brown A. S. [et al.], 2004). Аналогичную закономерность удалось установить применительно к токсоплазмозу (Brown A. S. [et al.], 2005; Mortensen P. B. [et al.], 2007), краснухе (Buka S. L. [et al.], 2001), инфекциям мочеполовой сферы (Babulas V. [et al.], 2006) и ряду инфекционных заболеваний, вызванных бактериями (Sorensen H. J. [et al.], 2009).
Имеются сведения, касающиеся связи между перенесенными матерью во время беременности инфекционными заболеваниями и повышенным риском формирования аутизма у потомства. Так, эпидемия краснухи, наблюдавшаяся во многих странах мира в 1960-е гг., сопровождалась существенным увеличением частоты аутизма среди детей, родившихся у инфицированных женщин (Chess S., 1977).
Связь между инфекцией, перенесенной матерью во время беременности, и риском развития аутизма у ребенка отмечалась и в отношении таких инфекций, как токсоплазмоз, сифилис, ветряная оспа (Ciaranello A. L., Ciaranello R. D., 1995). Экспериментальные исследования, проведенные на животных, позволили выявить аналогичные закономерности (Brown A. S., Susser E. S., 2002). Механизмы, лежащие в основе ассоциации между инфекционными заболеваниями и риском психических нарушений у потомства, до конца не выяснены. Важная роль отводится активации выработки цитокинов в организме беременной на фоне переносимой инфекции. Цитокины – это белки малой молекулярной массы, которые выделяются в сыворотку крови в ответ на многочисленные стимулы, в числе которых инфекции, иммунная активация и стресс. Даже в тех случаях, когда переносимая беременной женщиной инфекция носит достаточно стертый характер, вырабатываемые цитокины проникают через плаценту к плоду. Цитокины сигнализируют о наличии воспалительного процесса путем активации ряда клеточных ферментов (киназ). Примечательно, что эти же ферменты принимают участие в регуляции процессов клеточной дифференциации растущего мозга, миграции нейронов и формирования синапсов. На мембранах формирующихся и уже сформированных нейронов имеются рецепторы к цитокинам. Поэтому воздействие цитокинов может вызывать как структурные, так и функциональные изменения клеток ЦНС (Jankowsky J. L., Patterson P. H., 1999; Gilmore J. H. [et al.], 2004; Baue
Последнее изменение этой страницы: 2016-08-29
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...