
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Теория мономолекулярной адсорбции
Теория Ленгмюра явилась фундаментальным вкладом в учение об адсорбции. Эта теория позволяет учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью адсорбционного объема или поверхности адсорбента. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества.
Теория Ленгмюра основана на следующих основных положениях:
1. Адсорбция происходит на дискретных адсорбционных центрах, которые могут иметь различную природу.
2. При адсорбции соблюдается строго стехиометрическое условие - на одном центре адсорбируется одна молекула.
3. Адсорбционные центры энергетически эквивалентны и независимы, то есть адсорбция на одном центре не влияет на адсорбцию на других центрах.
4. Процесс адсорбции находится в динамическом равновесии с процессом десорбции.
Первое положение означает, что адсорбированные молекулы прочно связаны с адсорбционными центрами; они как бы локализованы на центрах (локализованная адсорбция). Из второго положения следует, что на поверхности может образовываться только один адсорбционный слой, поэтому адсорбцию по Ленгмюру называют мономолекулярной. Третье положение означает, что дифференциальная теплота адсорбции постоянна и что силами взаимодействия адсорбированных молекул можно пренебречь. И, наконец, согласно последнему положению, адсорбированные молекулы вследствие флуктуаций энергии могут отрываться от центров и возвращаться в газовую фазу.
На основании этих положений можно получить уравнение изотермы адсорбции. Скорость адсорбции из газовой фазы Vадс (то есть число молекул, адсорбированных за единицу времени) пропорциональна давлению газа и числу свободных центров на поверхности твердого тела. Если общее число центров Аm, а при адсорбции оказывается занятыми А центров, то число центров, остающихся свободными равно (Аm - А). Поэтому Vадс = kадс∙ р (Аm - А). Адсорбция динамически уравновешена процессом десорбции. Скорость десорбции пропорциональна числу адсорбированных молекул Vдес = kдес ∙А . При равновесии Vадс = Vдес или kадс ∙ р (Аm - А) = kдес ∙ А . Переобозначив kадс / kдес = b (где b - это константа адсорбционного равновесия) и А/Аm = θ (относительное заполнение поверхности) получим
 или
или  (26.23)
(26.23)
Это и есть изотерма адсорбции Ленгмюра.
Из термодинамики известно, что константа равновесия связана со стандартными изменениями энергии Гиббса: RT ln b = - ∆ G°. Кроме того, согласно фундаментальному уравнению термодинамики ∆G° = ∆Н° - T∆S°. Следовательно,
 (26.24)
(26.24)
и
 (26.25)
(26.25)
Таким образом, константа адсорбционного равновесия связана со стандартной энтропией A S° и со стандартной теплотой адсорбции q = -∆Н°.
Уравнение Ленгмюра содержит два параметра, характеризующих адсорбцию. Это константа адсорбционного равновесия b и величина предельной адсорбции, соответствующая полному заполнению поверхности мономолекулярным слоем адсорбата Аm (этот параметр обычно называют емкость монослоя). Изотерма адсорбции Ленгмюра изображена на рис. 26.10. При очень малых заполнениях и, следовательно, при очень малых значениях р в знаменателе уравнения (26.10) в пределе bp « 1. Поэтому в этой области А = Аm bp. Другими словами, в области малых заполнений уравнение Ленгмюра переходит в уравнение Генри. При очень высоких давлениях bp » 1 и из уравнения Ленгмюра следует, что А = Аm, то есть величина адсорбции перестает зависеть от давления.
| Рис. 26.10. Изотерма адсорбции Ленгмюра |
 А
А
Pk
Этому случаю соответствует область 3 - почти все адсорбционные центры уже заняты и свободных центров на поверхности практически нет. В небольшом же интервале концентраций, соответствующему области 2, адсорбция может приблизительно быть описана уравнением Фрейндлиха.
Для определения численных значений параметров Аm и b уравнение Ленгмюра можно представить в виде:
 (26.26)
(26.26)
Тогда в координатах [1/А; 1/р] изотерма Ленгмюра должна выражаться прямой (рис. 26.24). Тангенс угла наклона этой линии равен 1 / Аmb , а отрезок, отсекаемый на ординате, равен 1/ Аm .
Таким образом, с помощью линеаризации уравнения Ленгмюра можно определить предельную величину адсорбции Аm, соответствующую полному мономолекулярному покрытию адсорбента молекулами адсорба-та.
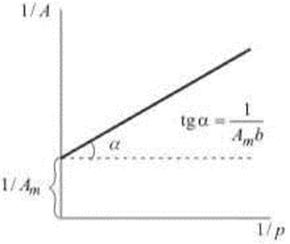
Рис.26.11. Линеаризированная изотерма Ленгмюра
Экспериментальное определение Аm позволяет рассчитать удельную поверхность адсорбента Sуд. Для расчета необходимо располагать величиной площади w0, приходящейся на единичную молекулу адсорбата в мономолекулярном слое
 (26.27)
(26.27)
где Na - постоянная Авогадро.
В ряде случаев реальные изотермы адсорбции газов на твердых адсорбентах удовлетворительно подчиняются уравнению Ленгмюра. Однако это подчинение в достаточной степени формально. Реальная поверхность твердого тела неоднородна, и зависимость энергии взаимодействия от заполнения в обычно представляет собой убывающую функцию. Взаимодействие же адсорбированных молекул между собой существует на любой поверхности и становится более заметным с увеличением степени заполнения. Вклад этого взаимодействия в теплоту адсорбции должен увеличиваться с увеличением степени заполнения. Эти противоположные эффекты во многих случаях компенсируют друг друга, так что наблюдаемые значения q в широком интервале Θмогут оставаться практически постоянными. Кроме того, реальное изменение q может компенсироваться изменением энтропии. Так, противоположное действие двух компенсирующих друг друга факторов делает уравнение Ленгмюра в ряде случаев формально применимым к адсорбции на реальных твердых телах.
Как правило, при адсорбционных процессах приходится иметь дело с адсорбцией газовых смесей, а не индивидуальных адсорбентов. Из модели Ленгмюра легко получить уравнение изотермы адсорбции для смесей. Если газовая смесь состоит, например, из двух компонентов, то на какой-то части адсорбционных центров адсорбируются молекулы одного компонента, на другой части - второго компонента. Число свободных центров будет равно (Аm - А1 - А2). В остальном уравнение адсорбции для газовой смеси не будет отличаться от уравнения (26.23).
 ;
;  (26.28)
(26.28)
Из уравнения (26.28) следует, что увеличение парциального давления одного компонента подавляет адсорбцию других, и тем сильнее, чем больше его адсорбционная константа равновесия.
Последнее изменение этой страницы: 2017-07-07
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...