
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ФОЛДИНГ БІЛКІВ : ЗАГАЛЬНІ УЯВЛЕННЯ
ФОЛДИНГ БІЛКІВ : ЗАГАЛЬНІ УЯВЛЕННЯ
Отже, трансляція мРНК приводить до утворення пептидного ланцюгу із строго певною послідовністю амінокислотних залишків.
Як відзначалося в п. 3.1, наступний етап формування білку - фолдинг, тобто згортання пептидного ланцюга в правильну тривимірну структуру. Якщо білок складається з декількох субодиниць, то фолдинг включає і об'єднання останніх в єдину макромолекулу.
Але, щоб краще зрозуміти істоту фолдинга і його можливі механізми, нам потрібно буде спочатку коротко згадати будову білків.
Будова білків
Розрізняють декілька рівнів структури білків : первинну, вторинну, третинну, а для олігомерних білків - і четвертинну структури.
Первинна структура
Первинна структура це послідовність амінокислотних залишків, пов'язаних один з одним пептидними зв'язками (мал. 3.15).
Саме ця структура безпосередньо кодується послідовністю кодонів в мРНК і відтворюється при трансляції.
Принципово важливо, що практично усі 20 амінокислотних залишків, що зустрічаються в природних білках (і перечислених в таблиці. 2.1, п. 2.2.2.3), мають схожий план будови. Вони містять тричленний остов, з середнім (α-вуглеводневим) атомом якого пов'язаний той або інший радикал R.
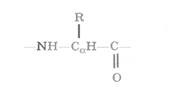
Саме радикалами і розрізняються амінокислотні залишки. З'єднуючись один з одним пептидними зв'язками, остови залишків формують безперервний остов пептидного ланцюга, де чергуються три типи зв’язку.

Навколо одного з них (пептидному зв'язку -СО- NН -) обертання неможливі. Зате навколо двох інших зв'язків (- NН - СαН- і -СαН-СО) можливе обертання. Це і дозволяє пептидному ланцюгу згинатися самм химерним чином, що призводить до утворення вторинної і третинної структур.
Вторинна структура
Спочатку більшість фрагментів пептидного ланцюга набувають періодичного укладання того або іншого типу : α-спираль або β-структуру. Цей нижчий рівень просторової організації називається вторинною структурою.
У одній і тій же молекулі глобулярного білку можуть зустрічатись різні види вторинної структури, а також т. з. біструктурні ділянки (позбавлені вторинної структури). Співвідношення між ними в різних білках по-різному (таблиця. 3.1).
Таблиця 3.1. Розподіл амінокислотних залишків між трьома варіантами вторинної структури
| Білок | α-Спіраль | β-структура | Безструктурні ділянки |
| ТУБУЛІН | 22% | 30% | 48% |
| ІНСУЛІН | 52% | 6% | 42% |
| МІОГЛОБІН | 75% | 0% | 25% |
Навпаки, у фібрілярних білках вторинна структура, як правило, одноманітна.
Так, цілком представлені α-спіраллю наступні білки: міозин, тропоміозин, α-кератин. У цих білках декілька ланцюгів з α-спираллю закручені в суперспіраль.
Білки ж тільки з β-структурой - фіброїн шовку і β-кератин (отримується з α-кератина шляхом обробки останньогого гарячою парою).
Особливий вид вторинної структури в ще одному фібрілярному білку - колагені. Він має загальні риси і з α-спираллю, і з β-структурою і називається колагеновою спіраллю.
Що ж є α-спіраль і β-структура?
а) α -Спіраль (мал. 3.16).
Тут остов пептидного ланцюга закручується в спіраль - так, що радикали амінокислот обернені назовні від спіралі.
Ця структура утримується водневими зв'язками між остовами амінокислот. Точніше, в утворенні одного такого зв'язку беруть участь група - NH - однієї амінокислоти і група -СО- іншої амінокислоти, яка в пептидному ланцюзі відокремлена від першої трьома іншими амінокислотами.
У результаті на один виток α-спіралі доводиться в середньому 3,6 амінокислотних залишків.
Важливо підкреслити, що α-спіраль (як в інших випадках - β-структура) утворюється тільки тому, що є найбільш термодинамічно вигідним станом для цієї ділянки пептидного ланцюга.
б) β-структура (мал. 3.17).

Тут остови пептидних ланцюгів не скручені в спіраль, а мають зигзагоподібну конфігурацію (структура складчастого листа).
Така структура теж утримується водневими зв'язками і між тими ж групами (- NH - і -СО -). Але тепер (якщо йдеться про глобулярний білок) для зближення цих груп і утворення зв'язків пептидний ланцюг утворює складки.
Тобто є подвійна складчастість:
- по-перше, великі складки в результаті повороту ланцюга на 180
- по-друге, дрібні вигини ланцюга в межах однієї складки.
Прилеглі одна до однієї ділянки ланцюга в β-структурі можуть бути як паралельними (йти в одному напрямі), так і антипаралельними.
У фібрілярних білках з β-структурою в утворенні воднених зв'язків беруть участь сусідні і розташовані параллельно пептидні ланцюги
Від чого ж залежить вторинна структура того або іншого білку або його фрагмента? Відповідь однозначна: вона визначається первинною структурою білку або даного фрагмента.
Іншими словами, бічні радикали амінокислот, хоча беспосередньо і не беруть участь в тих, що стабілізують цю структуру зв'язках, проте визначають, яким чином пептидний ланцюг може згорнутися для утворення таких зв'язків і чи може згорнутися взагалі.
Так, наприклад, залишки проліну і гідроксипроліну повністю виключають утворення у своєму локусі як α-спірали, так і β-структури. Однойменно заряджені радикали амінокислот, якщо вони знаходяться в ланцюзі близько один від одного, із-за взаємного відштовхування не можуть зближуватися в α-спірали. І так далі.
Звідси і виходить типове для кожного білку розташування між різними типами вторинної структури (див. таблицю. 3.1).
Третинна структура
Про третинну структуру, зазвичай, говорять стосовно лише до глобулярних білків.
Під нею розуміють конформацію білкової глобули, тобто укладання в просторі α-спіральних, β-структурних і біструктурних ділянок пептидного ланцюга.
На відміну від вторинної, третинна структура утворюється і утримується за рахунок утворення зв'язків безпосередньо між радикалами амінокислот.
Конкретний характер цих зв'язків залежить від природи радикалів (таблиця. 3.2).
Таблиця 3 2 Типи радикалів амінокислот і утворені ними зв'язки
| Типи радикалів | Відповідні амінокислоти | приблизний вміст в білках | Зв'язки, що утворюються радикалами |
| 1) Неполярні радикали | Глн, Ала, Вал, Лей, Ілей, Мет, Фен, Три, Про | 50% | "Гідрофобні" і ван-дер ваальсові (індукційні і дисперсійні) взаємодії |
| 2) Полярні радикали, не здатні до іонізації | Сер, Тре, Цис, Тир, Гіп (гідроксипролин), Асн, Глн | 20% | Водневі зв'язки Для Цис ще і дисульфідні зв'язки |
| 3) Полярні радикали, здатні до іонізації при фізіологічному рН | Асп, Глу, Apг, Ліз, Гнл (гідроксилізин), Гіс | 30% | Іонні і водневі зв'язки |
Як видно з таблиці по своїх фізико-хімічних властивостям радикали усіх амінокислот поділяються на 3 групи, а утворювані між ними зв'язки зводяться до 4-5 видів.
Серед останніх один зв'язок є ковалентним - дисульфидний зв'язок між залишками цистеїну.
Інші зв'язки - нековалентні, тобто відносяться до т. з. слабким взаємодіям. Це:
· іонні зв'язки між різнойменно зарядженими (а отже, гідрофільними) радикалами
· водневі зв'язки між полярними (як зарядженими, так і незарядженими) радикалами
· гідрофобні і ван-дер-ваальсові взаємодії між неполярними (тобто гідрофобними) радикалами (мал. 3.18).

Слабкий характер іонних і водневих зв'язків в значній мірі обумовлений впливом водного середовища, в якому зазвичай знаходиться білок. Так, дипольні молекули води, орієнтуючись навколо полярних (у т. ч. заряджених) радикалів, в 80 разів знижують електричне поле заряджених радикалів і можуть самі утворювати водневі зв'язки з полярними радикалами. На руйнування цих зв'язків витрачається велика частина енергії міжрадикальної взаємодії.
Проте замикання великого числа міжрадикальних зв'язків призводить до утворення термодинамічно найбільш стійкої конфігурації нативної третинної структури білку.
При цьому радикали, що взаємодіють один з одним, можуть знаходитися у витягнутому пептидному ланцюзі дуже далеко один від одного. Зближення ж їх відбувається лише в результаті складних вигинів того ланцюга в тривимірному просторі.
У результаті утворюється глобулярна частка, причому одні радикали знаходяться усередині її, а інші на її поверхні. Зокрема, для модельного міоглобіноподібного білка розподіл радикалів виявився наступним (таблиця. 3.3).
Таблиця 3.3. Розподіл радикалів в міоглобіноподібному білку
| 60 внутрішніх радикалів (40 % ) | 93 зовнішні радикали (60 %) |
| У тому числі: 48 гідрофобних і 12 гідрофільних | У тому числі: 28 гідрофобних і 65 гідрофільних |
Як видно з цих таблиці 3.3, основна частина гідрофобних радикалів знаходиться усередині глобули (куди вони йдуть від водної фази), а більшість гідрофільних радикалів на її поверхні. В той же час це правило не є абсолютним : деяка кількість гідрофобних радикалів залишається на поверхні.
Останнє дуже важливе для взаємодії білку з лігандами, що мають гідрофобні групи.
Взагалі, формування третинної структури грає вирішальну роль в придбанні білком властивої йому функціональної активності. Як правило саме на рівні цієї структури в білку з'являються т. з. активні центри (один або декілька) - групи з декількох радикалів, здатні специфічно взаємодіяти з визначеними лігандами.
Ці радикали знову таки на рівні первинної структури частенько знаходяться далеко один від одного і зближуються лише в процесі фолдингу.
В той же час третинна структура має певну рухливість. На конформації глобули можуть позначатися з’єднувальні чинники:
· теплові флуктуації і коливання окремих груп, коли зв'язки між ними то розриваються, то знову замикаються;
· спеціальні речовини-регулювальники;
· хімічна модифікація білку (наприклад фосфорилювання);
· само виконання білком його функції.
Зміна конформації білків найважливіший спосіб зміни їх біологічної активності, який широко використується в клітині для peгуляції різних процесів.
Ми з цим не раз вже стикались - наприклад, при обгрунтуванні механізму дії дифтерійного токсину (п. 3 3 2.2) і інтерферонів (п. 3.3.2.3). У обох випадках модифікація одного з білкових чинників трансляції змінювала його третинну структур і вела до втрати цим чинником своїй активності.
Четвертинна структура
Про наявність у білку четвертинної структури говорять тоді, коли він складається з декількох субодиниць. Прикладом є гемоглобін, молекула якого включає 4 субодиниці двох видів (п. 2.4.1.3).
Субодиниці зв'язуються за рахунок взаємодії амінокислотних радикалів, що знаходяться на контактуючих поверхнях субодиниць. Ці поверхні по розташуванню даних радикалів є взаємно комплементарнимим.Вони нерідко збагачені гідрофобними і різнойменно зарядженими радикалами.
Таким чином, зв'язування субодиниць може проходити лише після утворення третинної структури.
З іншого боку, це зв'язування само позначається на третинній структурі субодиниць : доводить її до функціонально активного або, навпаки, неактивного стану. Тому такі білки зазвичай активні лише в олігомерній формі (як гемоглобін) або, навпаки, тільки в дисоційованому стані (як деякі протеінкінази).
У останньому випадку одні субодиниці служать для гальмування активності інших і диссоціюють під впливом спеціального сигналу (циклічного АМФ).
Роль первинної структури
Ми вже говорили (п. 3.4.1.2), що первинна структура білкаповністю визначає вторинну структуру різних його фрагментів. Те ж саме можна сказати і відносно більш високих структур - третинної і четвертинної.
Це було показано К. Анфінсеном в 1973 р. в класичному експерименті з рибонуклеазою (мал. 3.19).

Ця РНКаза складається з одного пептидного ланцюга, що включає 124 амінокислотні залишки. Серед останніх - 8 залишків цистеїну (Цис), які утворюють попарно 4 дисульфідні зв'язки.
Принциповий момент: усього може бути 105 комбінацій таких попарних взаємодій; у кожній з них n = 8 залишків Цис утворюють один з одним 4 дисульфідні зв'язки. (Згідно комбінаториці, кількість цих комбінацій розраховується як добуток непарних чисел до n: в даному випадку 3x5x7=105.)
З усіх комбінацій в нативній РНКазі реалізується тільки одна - і строго визначена: 26-84, 40-95, 58 110, 65-72 (цифри вказують положення залишків Цис у витягнутій поліпептидному ланцюгу). Як видно, в більшості випадків взаємодіючі радикали Цис знаходяться в пептидному ланцюзі досить далеко один від одного.
Окрім дисульфідних, в третинній структурі РНКази є і інші зв'язки - зокрема, водневі.
Так, на першій стадії експеримента в середовищі з РНКазою вносили два компоненти:
· сечовину, яка розриває водневі і, можливо, інші слабкі зв'язки,
· а також агент (β-меркаптоетанол), що зворотньо розриває дисульфідні зв'язки.
При цьому нативна структура РНКази руйнувалася і пептидний ланцюг починав утворювати випадковий клубок. Ферментативна активність зникала у зв'язку з руйнуванням активного центру. Таким чином, білок був приведений в приблизно такий стан, який він мав відразу після трансляції, тобто до фолдинга.
На другій стадії експерименту обидва названі агенти з середовища видаляли (шляхом діалізу). І з часом у білку знову з'являлася ферментативна (тобто РНКазна) активність.
Отже, відновлювалася нативна структура білку: знову замикалися дисульфідні зв'язки, причому між тими ж парами радикалів Цис; і знову утворювалися слабкі зв’язки. Якщо користуватися сучасною мовою, відбувався рефолдинг РНКази.
Цей результат справив глибоке враження і на автора експерименту, і на наукове співтовариство. Було зроблено два ключових висновки.
1) Уся інформація про третинну структуру білку (по крайній мірі, якщо він не має небілкового компонента) знаходиться в його первинній структурі, тобто в послідовності амінокислот в пептидному ланцюзі.
Зараз це здається само собою зрозумілим, але, взагалі кажучи, могло бути і інакше. Могли існувати спеціальні інструктивні молекули, які, накладаючись на випадковий клубок (як на воскову заготівлю), цілком визначали б просторову структуру білку.
Ця ідея довгий час лежала в основі одній з гіпотез імуногенезу, яка так і називалася - інструктивною. Малося на увазі, що антигени таким чином призводять до появи специфічних до них антитіл.
Експерименти ж Анфінсена показали, що білок приймає строго певну конфігурацію без яких-небудь "Інструкторів" - на основі тільки фізико-хімічних взаємодій своїх хімічних груп.
Але і ідея про інструктивну роль інших речовин також знайшла своє підтвердження! Тільки не у первинному, а в істотно модифікованому виді. Мається на увазі вже згадуваний факт, що на третинну структуру білку можуть впливати його ліганди, а також хімічна модифікація.
У зв'язку з цим можна згадати популярну теорію індукованої відповідності. Згідно з нею, у відсутність субстрату активний центр ферменту ще не до кінця сформований. Субстрат же в процесі зв'язування індукує такі переміщення радикалів активного центру, які як би "підганяють" структуру цього центру під структуру субстрату.
2) Другий висновок, що виходив з дослідів Анфінсена, полягав в тому, що білок не лише "знає", яку третинну конформацію прийняти, але і робить це цілком самостійно. Дійсно, відновлення нативної структури РНКази відбувалося у відсутність яких-небудь агентів, тобто самовільно.
Цей висновок був поширений на усі білки і довгий час теж вважався цілком очевидним.
І лише не так давно стало з'ясовуватися, що він справедливий, мабуть, тільки для невеликих білків, до яких відноситься і рибонуклеаза Анфінсена.
Для фолдинга ж великих білків потрібні спеціальні білки - шаперони (згадувані в п. 3.1) і ферменти фолдази. Вони не визначають те, яка має бути просторова конфігурація білку (тобто не являються "інструкторами"), але створюють можливість для швидкого її формування.
Детальніше про фолдази і шаперони мова піде в розділі 3.5.
Таким чином, первинна структура пептидного ланцюга відіграє визначальну роль у фолдингу цього ланцюга, але вона не завжди виявляється достатньою для забезпечення фолдинга або (і) його остаточного завершення.
Роль лігандів
По впливу лігандов на конформацію білків білок-лігандні взаємодії можна розділити на декілька класів.
Взаємодії класу I : ліганд, зв'язуючись з білком, не викликає істотних змін конформації, але стабілізує структуру білку.
Приклад - зв'язування іонів Са2+ з лізоцимом. В присутності ліганда (іонів Са2+) для денатурації лізоциму необхідні великі концентрації відповідного агента (сечовини або гуанідингідрохлорида).
Мабуть, в даному випадку за допомогою Са2+ утворюються додаткові зв'язки між радикалами.
Взаємодії класу II : ліганд значно змінює третинну структуру білку, і тільки в такому стані білок стає досить активним.
Приклад - зв'язування іонів Са2+ з кальмодуліном - внутрішньоклітинним рецептором цих іонів. Зв'язавши два іони Са2+, кальмодулін набуває здатність впливати на активність більшості білків клітини.
Взаємодії класу III: у відсутність ліганда білок знаходиться в т. з. стані розплавленої глобули : має достатньо компактну глобулярну форму, але без якої-небудь певної третинної структури - остання формується лише при зв'язуванні ліганда.
Приклад такого білку - лактальбумін (компонент ферментного комплексу синтезу лактози). Це невеликий білок, містить 4 дисульфідні зв'язки і міцно зв'язує 1 іон Са2+ . Видимо, цей іон є ключовим структуротворним елементом. При його видаленні третинна структура білку руйнується. Але глобулярна форма і розмір глобули зберігаються завдяки стабілізуючому впливу дисульфідних зв'язків.
Взаємодії класу IV : без ліганда у білку не до кінця сформована вторинна структура і повністю відсутня третинна структура. При цьому пептидний ланцюг частково розгорнутий.
Приклад білку остеокальцин, що міститься в матриксі кісток. Він містить всього біля 50 амінокислотних залишків і здатний зв'язувати 5 іонів Са2+. Зв'язування супроводжується істотним зменшенням об'єму глобули, формуванням третинної структури і об'єднанням глобул в димери. Тобто в даному випадку ліганд потрібний для появи у білку і четвертинної структури.
Взаємодії класу V : у відсутність ліганда білковий ланцюг практично повністю розгорнутий, тобто представляє собою випадковий клубок. Взаємодія ж з лігандом призводить до повного формування просторової структури білку.
Приклад - цитохром с, один з білків ланцюга перенесення електронів в мітохондріях. Його ліганд - гем (схожий з гемом гемоглобіна). Видалення гема призводить до майже повного розгортання білкової молекули.
Взаємодії класу VI : зв'язування ліганда викликає масштабні переміщення доменів або субодиниць білку.
Приклад - взаємодія гемоглобіну (Нb) з киснем. В ході цього процесу відбуваються численні і складні конформаційні перетворення. У тому числі сусідні субодиниці обертаються один відносно одного на 10-15°.
В результаті при зв'язуванні молекули О2 з гемом однієї субодиниці підвищується спорідненість до кисню сусідніх субодиниц. Це позначається як кооперативний ефект і має велике фізіологічне значення.
Завершуючи цей пункт, зробимо два зауваження:
а) по-перше, як видно, ліганди дійсно можуть дуже істотно впливати на конформацію білку;
б) по-друге, для білку, що має декілька лігандів (особливо якщо останні зв'язуються з різними частинами молекули), характер подібного впливу для різних лігандов може бути досконалий різним.
Наприклад, по-різному впливають на структуру гемоглобіна такі його ліганди, як гем і кисень.
Тому, на відміну від авторів викладеної тут систематизації (В. Н. Уверського і Н. В. Нарижневої), ми говорили не про класи білків, а про класи білок-лігандних взаємодій.
Моделі згортання білків
Модель проміжних станів
Розглядаючи вплив лігандів, ми згадували різні форми існування пептидних ланцюгів. Ці форми можна зв’язати в послідовність, показану на мал.

Як видно, у міру переходу від першої форми до останньої закономірно зростає степінь структурованості білку. Тому природно припустити: а не чи відбувається саме в такій черговості фолдинг білків? Цю думку уперше висловив О. Б. Птіцин в 1972 р.
Таким чином, згідно з цією схемою, фолдинг білка (коли у відсутність, коли у присутності відповідних лігандів) здійснюється не одномоментно, а в декілька стадій.
а) Початкова форма глобулярного білку (безпосередній продукт трансляції) - випадковий клубок, або розгорнутий пептидний ланцюг.
"Розгорнута" - не означає розтягнута. Дійсно, якщо виключити абсолютно усі взаємодії між амінокислотними залишками в пептидному ланцюзі (природно, окрім пептидних зв'язків), то термодинамічно найбільш вигідним станом ланцюга буде рихлий клубок.
Щоб розтягнути цей клубок (і вже тим більше витягнути його в пряму нитку), необхідно прикласти силу. Після зупинення дії сили ланцюг знову повертається в найбільш вірогідний стан клубка. Тобто такий білок, подібно до каучуку, має еластичність; відповідно, його можна назвати каучукоподібним.
Мабуть, на цьому заснована еластичність відомого білку, який так і називається, - еластином. Він має глобулярну природу, і його глобулярні молекули об'єднуються в ланцюжки, складаючи фібрили і потім волокна.
У інших же глобулярних білках еластичність відсутня, тому що у випадковому клубку починають проявлятися багаточисленні взаємодії між амінокислотними залишками.
б) Згідно мал. 3.20, спочатку формується вторинна структура: різні ділянки пептидного ланцюга утворюють α-спіралі, β-структури або залишаються безструктурними.
Після закінчення цього процесу відбувається коллапсування (стискання) клубка в т. з. розплавлену глобулу. Рушійною силою стискування є взаємодія між радикалами амінокислот. Причому за допомогою радикалів фактично взаємодіють окремі елементи вторинної структури (α-спіралі та ін.).
У чому ж принципова відмінність розплавленої глобули від нативної структури?
У тому, що в цій глобулі амінокислотні радикали ще не знайшли своїх остаточних партнерів, не зайняли "правильного" положення, а взаємодіють "з ким припаде". Тому загальну кількість одночасно існуючих зв'язків відносно невелике і зв'язки, а з ними і конфігурація молекули є дуже нестійкими.
в) Але рано чи пізно білок знаходить термодинамічно найбільш оптимальну структуру, при якій між радикалами утворюється максимально можлива кількість зв'язків.
У разі досить великого білку спочатку формується третинна структура доменів, а вже потім останні займають правильне положення один відносно одного.
Найпізніше відбувається зв'язування мономерів в олігомери (якщо нативний білок складається з декількох субодиниць).
3.4.3.2. Згортання за принципом "усе або нічого"
На відміну від вищевикладеного, у дуже маленьких білків (до 100 амінокислотних залишків) проміжні стадії (розплавлена глобула і стан-попередник) відсутні і фолдинг фактично проходить за принципом "усе або нічого".
Дійсно, із-за малого числа амінокислотних залишків "неправильні" взаємодії, що лежать в основі розплавленої глобули, практично не трапляються. Тому немає феномену коллапсування (стискування) клубка до утворення нативной третинної структури.
У цих випадках фолдинг відбувається таким чином. Розгорнутий пептидний ланцюг протягом досить тривалого часу флуктує без утворення контактів між амінокислотними залишками - просто тому, що здатні до взаємодії залишки не зближуються один з одним.
Потім випадково ланцюг досягає стану, в якому може утворитися декілька "правильних", або нативних, контактів. Тим самим як би з'являється ядро згортання (ядро нуклеації).
Після цього фолдинг завершується дуже швидко. Наявність декількох "правильних" зв'язків утримує ланцюг в такий конфігурації, в якій легко знаходять один одного інші "правильні" пари.
Добре вивченим білком з подібним механізмом фолдинга є хімотрипсиновий інгібітор 2 (білок СІ2), що включає 65 амінокислотних залишків. У вторинній структурі він має одну α-спіраль і п'ять тяжів β-структури (β1 .. β5). Критичним моментом фолдинга цього білку служить утворення α-спіралі і тяжів β4, β5, а також гідрофобна взаємодія трьох амінокислотних залишків у складі цих елементів Ала16 (α-спіраль), Лей49 (β4) і Іле59 (β5). Це і означає формування ядра нуклеації.
Феномен кооперативності
У обох викладених моделях фолдинга дуже важливу роль відіграє феномен кооперативності. Суть його в тому, що утворення однієї або декількох "правильних" зв'язків різко прискорює замикання інших нативних зв'язків.
На цьому, по суті, побудовано уявлення про ядро нуклеації. І такий же, очевидно, механізм кожної стадії фолдинга більших білків - наприклад, перетворення розплавленої глобули на нативну структуру.
Продемонструємо значення цього феномену на наступному прикладі.
Нехай білок включає n = 100 амінокислотних залишків і нативна конформація включає 50 пар строго певних взаємодій залишків.
Як відзначалося в п. 3.4.2.1, загальне число будь-яких комбінацій попарних взаємодій дорівнює добутку непарних чисел n: в даному випадку 3х5х.. х97х99 = 3х1078.
Якщо уявити, що в секунду перебирається 1013 різних комбінації (літературні дані), то у відсутність ефекту кооперативності середній час пошуку нативної конформації складав би 4,5х1057 років! Що виключає саму можливість не лише фолдинга хоч би однієї молекули білку, але і утворення життя на Землі.
Тепер фолдинг того ж білку розглянемо з урахуванням феномена кооперативності.
Нехай його вторинна структура включає 5 α-спіральних ділянок приблизно по 20 амінокислотних залишків. Спіралізація кожної такої ділянки спочатку є вільним перебором усіх можливих пар (190) взаємодії груп - NH2- і -СО -. З них "правильних" пар - 16.
Навіть при відносно невеликій швидкості перебору в 106 пар/с необхідні малі частки секунди (близько 10-5 с), щоб утворився хоч би один "правильний" зв'язок.
Далі ж діє ефект кооперативності : від цього зв’язку в обидві сторони даної ділянки пептидного ланцюга з великою швидкістю (1091/с) починають замикатися інші "правильні" зв'язки α-спірали. Тривалість цієї стадії ще на декілька порядків менша (108с), ніж першої – лімітуючої - стадії.
У результаті спіралізація усієї ділянки укладається практично в ті ж частки секунди (близько 105 с), що займав пошук одного "правильного" зв'язку.
Причому, оскільки усі 5 ділянок спіралізуються незалежно один від одного, то за той ж час відбувається формування усієї вторинної структури білку.
А як йде справа з утворенням третинної структури?
На цьому етапі взаємодіють радикали амінокислот, які знаходяться в різних елементах вторинної структури (у нашому випадку - в різних α-спіралях); взаємодії ж в межах одного елементу неможливі. Цю обставину само по собі зменшує кількість взаємодій. Але ще вище роль ефекту кооперативності.
Можна знайти, що загальне число міжрадикальних пар (виключаючи пари в межах однієї α-спірали) дорівнює 4000. Нехай замикання з цих двох певних зв'язків має критичне значення (подібно до утворення ядра нуклеації у випадку маленьких білків). При тій же швидкості перебору, що при утворенні вторинної структури (106 пар/с), на пошук цих зв'язків йде близько 10-3 с.
Інші зв'язки, завдяки кооперативності, замикаються набагато швидше.
У результаті увесь фолдинг білка замість нескінченної кількості років займає час менше секунди. В крайньому випадку, для великих білків із складною структурою, він укладається в декілька хвилин.
ЧИННИКИ ФОЛДИНГА
Відкриття чинників фолдинга
На відміну від тільки що описаних експериментальних підходів А.С. Спіріна, в більшості випадків фолдинг білків вивчають in vitro не в тісному зв'язку з трансляцією, а приблизно так, як це робив Анфінсен (п. 3.4.2.1). Тобто за допомогою спеціальних агентів спочатку руйнують нативну структуру білку (інакше кажучи, викликають його денатурацію), а потім спостерігають за відновленням початкової структури (за ренатурацією, або рефолдингом). Про стан білку судять за допомогою різних спектральних методів, а також по його функціональній активності.
Подібні експерименти показали: повторити результати Анфінсена, отримані для рибонуклеази, вдається лише для таких же, як вона, невеликих білків.
У разі ж більших білків денатурація часто супроводжується агрегацією білку, а мимовільний рефолдинг якщо і відбувається, то дуже повільно і з дуже невеликим відсотком виходу.
В той же час виявилось, що додавання в середовище деяких білкових фракцій клітини значно полегшує рефолдинг денатурованих білків. Звідси і виникло уявлення про допоміжних білок (чи чинників) фолдинга.
Потім було виявлено, що ці чинники можна розділити на дві групи.
а) Перша група - це білки з каталітичною активністю, тобто ферменти фолдинга, або фолдази. Поки виявлено тільки два такі білки. Як і інші ферменти, вони вимагаються лише в каталітичних кількостях, тобто в концентраціях, на порядки менших, ніж у "обслуговуваних" ними білків.
б) Друга група - т. з. молекулярні шаперони. Вважають, що сюди входять білки з самими різними механізмами дії. Об'єднують же їх наступні дві обставини:
· вони вимагаються в кількостях, близьких до стехіометричним, тобто порівнянних за величиною з концентрацією білків, які згортаються; незважаючи на це,
· вони, як і фолдази, не входять до складу кінцевих продуктів фолдинга, якими б складними олігомерними утвореннями ці продукти не були.
Показово у зв'язку з цим початкове значення слова "шаперон" в англійській мові: це літня пані, яка супроводжує молоду дівчину на балах.
Аналогічно і молекулярні шаперони: сприяючи правильному фолдингу, вони як би уперше виводять "у світло" новосинтезовані білки, але самі потім ніякої самостійної ролі, як правило, не відіграють.
Тепер розглянемо фолдази і шаперони детальніше.
Ферменти фолдинга
Протеиндисульфидизомераза
Одна з двох фолдаз вже згадувалася в п. 3.4.3.4: це протеїндисульфідизомераза, або ПДІ.
Там же було сказано, що цей фермент каталізує переміщення в білках дисульфідних зв'язків. Це означає, що під його впливом в білку, що згортається, розриваються одні і замість них замикаються інші дисульфідні зв'язки.
Що було б у відсутність ПДІ? Допустимо, в білці, як в РНКазі Анфінсена, 8 залишків цистеїну, що допускає 105 різних комбінацій замикання між ними 4-х дисульфідних зв'язків (п. 3.4.2.1). З цих комбінацій тільки одна є "правильною".
Так от, без ПДІ замикання тих, що перших попалися, 4-х дисульфідних зв'язків, по суті, назавжди зафіксувало б пептидний ланцюг у відповідній конформації, навіть якщо остання була б дуже далека від нативної і енергетично дуже невигідною. Дійсно, дисульфідні зв'язки є ковалентними, тому для їх розриву необхідно подолати високий кінетичний бар'єр.
Саме наявність такого бар'єру, як відомо, робить стабільними дуже багато енергоємних речовин.
Можливість фіксації білку в "неправильній" конфігурації "неправильними" дисульфідними зв'язками показав ще у своїх експериментах з РНКазою Анфінсен.
Як описувалося в п. 3.4.2.1, денатурацію РНКази він здійснював двома агентами - сечовиною (що розриває слабкі зв'язки) і Р-меркаптоетанолом (що розриває дисульфідні зв'язки), а ренатурацію, або рефолдинг, спостерігав, одночасно видаливши з середовища обидва ці агента.
Зовсім інший результат виходив, якщо спочатку видаляли тільки Р-меркаптоетанол (мал.нижче).

В цьому випадку (тобто при наявності сечовини) слабкі зв'язки не сприяли формуванню нативної конформації. Тому при повільному замиканні дисульфідних зв'язків (шляхом окислення SН-груп цистеїну киснем повітря) з рівною ймовірністю утворювалися білкові молекули з усіма 105 комбінаціями розподілу дисульфідних зв'язків. Тобто на 1 молекулу з правильною конфігурацією виходило 104 «неправильних» молекул.
Еоли потім видаляли із середовища і сечовину, конформація молекул не змінювалась: вона була вже зафіксована дисульфід ними зв’язками. РНКазна активність сумарного продукта була лище біля 1/105 = 1%.
Але цю активність можна було знову довести до повної, якщо додати слідові кількості β-меркаптоетанола. Вони сприяли розриву в білкових молекулах існуючих дисульфід них зв’язків і перешкоджали утворенню інших дисульфід них зв’язків. Тобто ці кількості агенту служили каталізаторами перерозподілу, або переміщення, дисульфід них зв’язків. Інакше кажучи, вони відіграли ту ж роль, яку виконує в клітині ПДІ.
Таким чином, лабілізація (чи ізомеризація) дисульфідних зв'язків в білку, що формується, дає йому можливість знайти (шляхом випадкового перебору) таку комбінацію цих зв'язків, якій відповідає енергетично найбільш оптимальна просторова структура.
З наведеного експерименту ясно також, що необхідність в ПДІ при фолдингутого або іншого білку пов'язана не з розміром цього білку, а з кількістю в нім дисульфідних містків.
У клітині ПДІ пов'язана, в основному, з ендоплазматичною сіткою (ЕПС). З цього виходить, що особливо велика її роль у формуванні тих білків, які синтезуються мембранозв’язаними рибосомами. Це, згідно п. 3.1, "експортні", мембранні і лізосомальні білки. У багатьох з них містяться дисульфідні містки.
Окрім дисульфідізомеразної активності, ПДІ має здатність до неспецифічного зв'язування пептидів в стехіометричних концентраціиях. Таку ж здатність мають типові шаперони. На цій підставі деякі автори роблять висновок, що ПДІ функціонує не лише як ПДІ, але і як шаперон.
Цього вистачало б природно: адже пошук "правильних" дисульфідних містків і утворення "правильних" слабких зв'язків - дві сторони одного і того ж процесу, розділити які дуже важко. Одне сприяє іншому і навпаки.
Одним з доказів шаперонної ролі ПДИ служить та обставина, що in vitro вона сприяє фолдингу білків, які не містять дисульфідних містків.
Пептидилпролілізомераза
Серед 20 амінокислот, що зазвичай зустрічаються в білках, є одна, яка амінокислотою, по суті, не є. Це пролін (а також продукт його гідроксилювання - гідроксипролін). Його радикал пов'язаний не лише з Сα-вуглецевим атомом, але і з азотом (мал.); тому виходить не аміно-, а імінокислота.

Ця обставина позначається на просторовій конфігурації пептидного ланцюга в місці вмісту Про. Як відмічалось в п. 3.4.1.2, тут не утворюється ні α-спіралі, ні β-структури, і пептидний ланцюг часто робить вигин в ту або іншу сторону.
Причому можливість вигину визначається тим, як розташовані радикал сусідньої амінокислоти і радикал проліну відносно площини, яка відповідає пептидному зв'язку.
Говорять, що ці радикали знаходяться в транс-конфігурації, якщо розташовані по різні сторони вказаної площині
Последнее изменение этой страницы: 2017-08-22
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...