
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Посттранскрипционный процессинг РНК.
После завершения синтеза транскрипты отделяются от матрицы и подвергаются дальнейшим превращениям или посттранскрипционному процессингу, на первой стадии которого происходит фрагментация транскрипта. Затем наблюдается модификация фрагментов, и в частности их метилирование, а также защита 5'- и 3'-концов от действия экзонуклеаз.
В структуре мРНК имеется большое количество вставок, которые не имеют смыслового значения - интроны, которые вырезаются из цепи мРНК в процессе ее созревания. Транслируемые участки называются экзонами и составляют цепь зрелой мРНК. Механизм точного вырезания интронов (процессинг) и сшивания экзонов (сплайсинг) достаточно сложен.
Молекула мРНК у эукариотов моноцистронная, т. е. каждая молекула мРНК содержит информацию только об одном белке (молекула мРНК прокариот ‑ полицистронна и содержит в себе информацию о нескольких белках). После завершения процессинга зрелые мРНК перемещаются через поры ядерной мембраны в цитоплазму при помощи специальных белков-переносчиков.
В процессе посттранскрипционных модификаций первичных тран-скриптов тРНК на 3'-конце молекулы формируется акцепторный участок (ЦЦА) для присоединения аминокислот, а в средней части молекулы — антикодон, т. е. триплет нуклеотидов, обеспечивающий взаимодействие тРНК с кодоном мРНК (см. рисунок 2.23).
В ходе посттранскрипционных модификаций пре-рРНК и связывания ее со специфическими белками образуется рибосома.
БИОСИНТЕЗ БЕЛКА (ТРАНСЛЯЦИЯ)
Информация, заложенная в ДНК и РНК, реализуется в процессе синтеза белка. Нуклеотидная последовательность ДНК и мРНК представляют собой своеобразный генетический код всех белков клетки. Код заключается в определенной последовательности расположения нуклеотидов в молекуле нуклеиновой кислоты. Кодом для включения аминокислоты в белковую молекулу служит триплет – участок ДНК (мРНК), состоящий из трех последовательно расположенных нуклеотидов. Каждой из 20 a-аминокислот соответствует определенный триплет, либо одной и той же аминокислоте соответствует несколько кодонов (например, для пролина, глутамина, аргинина и др.) (таблица 3.1).
Таблица 3.1 - Генетический код
| Первый нуклеотид триплета | Второй нуклеотид триплета | Третий нуклеотид триплета | |||||||
| А | Г | У | Ц | ||||||
| А | ААА | лиз | АГА | арг | АУА | иле | АЦА | тре | А |
| ААГ | АГГ | АУГ | мет | АЦГ | Г | ||||
| ААУ | асн | АГУ | сер | АУУ | иле | АЦУ | У | ||
| ААЦ | АГЦ | АУЦ | АЦЦ | Ц | |||||
| Г | ГАА | глу | ГГА | гли | ГУА | вал | ГЦА | ала | А |
| ГАГ | ГГГ | ГУГ | ГЦГ | Г | |||||
| ГАУ | асп | ГГУ | ГУУ | ГЦУ | У | ||||
| ГАЦ | ГГЦ | ГУЦ | ГЦЦ | Ц | |||||
| У | УАА | терм. | УГА | терм. | УУА | лей | УЦА | сер | А |
| УАГ | УГГ | трп | УУГ | УЦГ | Г | ||||
| УАУ | тир | УГУ | цис | УУУ | фен | УЦУ | У | ||
| УАЦ | УГЦ | УУЦ | УЦЦ | Ц | |||||
| Ц | ЦАА | глн | ЦГА | арг | ЦУА | лей | ЦЦА | про | А |
| ЦАГ | ЦГГ | ЦУГ | ЦЦГ | Г | |||||
| ЦАУ | гис | ЦГУ | ЦУУ | ЦЦУ | У | ||||
| ЦАЦ | ЦГЦ | ЦУЦ | ЦЦЦ | Ц | |||||
| П р и м е ч а н и е: терм – терминирующий кодон |
Генетический код обладает рядом свойств, основными из которых являются:
¾ триплетность — одну аминокислоту кодируют три нуклеотида (триплет, или кодон);
¾ специфичность — триплет кодирует только одну аминокислоту;
¾ вырожденность — одну и ту же аминокислоту могут кодировать несколько триплетов;
¾ непрерывность — у всех организмов код линейный, однонаправленный и непрерывный;
¾ универсальность — у всех живых организмов генетический код одинаков.
Трансляция — это процесс перевода последовательности оснований ДНК и соответствующей мРНК в последовательность аминокислот, объединенных в полипептидную цепь и составляющих первичную структуру белков.
Трансляция осуществляется в клетках при помощи сложной белок-синтезирующей системы. Отдельные компоненты которой ассоциируют в единую структуру по мере ее функционирования и разобщаются по окончанию синтеза. В состав белок-синтезирующей системы входят следующие элементы:
¾ рибосомы — нуклеопротеины, содержащие примерно 60% рибосомальной РНК и 40% различных белков;
¾ матричная РНК;
¾ транспортная РНК;
¾ белковые факторы и ферменты инициации, элонгации и терминации трансляции;
¾ набор 20 a-аминокислот;
¾ набор аминоацил-тРНК-синтетаз, образующих аминоацил-тРНК;
¾ макроэргические соединения (АТФ и ГТФ);
¾ ионы Mg2+, Ca2+, K+, NH4+.
Последовательность событий при трансляции можно представить в следующем виде.
Активация и рекогниция аминокислоты.
Большая часть пула аминокислот в цитоплазме клеток находится не в свободном состоянии, а в виде аминоацил-тРНК, что предохраняет аминокислоты от метаболических превращений. Образованию комплекса аминокислота-тРНК предшествует активация аминокислоты и нахождение соответствующей тРНК (рекогниция). Это происходит под действием фермента аминоацил-тРНК-синтетазы. Эти ферменты имеют два активных центра, один из которых соответствует определенной тРНК, а другой строго специфичен соответствующей аминокислоте. Образование аминоацил-тРНК требует источника энергии в виде энергии макроэргов (АТФ).
Инициация трансляции.
Инициация трансляции начинается с момента присоединения формил-метионина (fMet), первой аминокислоты биосинтеза белка, к специфической тРНК-формил-мет, отличающейся от тРНК-мет, с помощью которой метионин включается в срединную часть полипептидной цепи.
Следующий момент инициации – образование инициирующего комплекса. Одним из его компонентов являются рибосомы. Они обладают каталитическими свойствами, образуя пептидную связь, а также выполняют функцию механического переноса пептидил-тРНК. Состав и структура рибосом схематически изображены на рисунке 3.2.
Для процесса трансляции весьма важно правильное положение инициирующего кодона мРНК в этом сайте, так как от этого зависит его попадание в пептидильный (Р) центр полной рибосомы.
 Рисунок 3.2 - Структурная
организация рибосом эукариот
Рисунок 3.2 - Структурная
организация рибосом эукариот
|
У 5'-конца мРНК имеется специальная последовательность нуклеотидов, комплементарная участку 18S, входящему в малую рибосомальную субчастицу. Взаимодействие этих комплементарных участков тРНК и мРНК ориентирует положение кодона в пептидильном сайте (рисунок 3.3).
 Рисунок 3.3 - Схематическое
изображение инициирующего
комплекса
Рисунок 3.3 - Схематическое
изображение инициирующего
комплекса
|
Энергию, необходимую для процессов комплексообразования, предоставляет ГТФ. При ассоциации малой и большой рибосомальных субчастиц происходит образование пептидильного (Р) и аминоацильного (А) центров трансляции, причем в пептидильном Р-центре находится инициирующий кодон мРНК, комплементарно соединенный с fMet-тPHK. В аминоацильном А-центре расположен только кодон мРНК. На этом стадия инициации завершается и наступает следующий этап трансляции – элонгация.
Элонгация трансляции.
Элонгация представляет собой образование и удлинение полипептидной цепи, формирующейся на рибосоме. Этот процесс проходит при участии ГТФ и факторов элонгации.
Процесс элонгации состоит из трех ступеней:
¾ узнавание кодона мРНК антикодоном тРНК, связывание аминоацил-тРНК в А-центре;
¾ образование петидной связи;
¾ транслокация.
Узнавание кодона служит основой для точного последовательного синтеза полипептида и состоит этот процесс в комплементарном узнавании оснований 5`®3`, ориентированных кодонов мРНК, основаниями антикодона тРНК, ориентированных в направлении 3`®5`.
К рибосоме, у которой в Р-центре находится fMet-тPHK, в А-центре присоединяется новая аминоацил-тРНК. Выбор аминоацил-тРНК определяется строением кодона мРНК. Связывание происходит с пользованием энергии ГТФ и при участии фактора элонгации EF1.
На следующей стадии элонгации синтезируется первая пептидная связь за счет реакции транспептидации, в ходе которой метионин от инициаторной тРНК переносится на a-аминогруппу аминоацил-тРНК в А-центре с образованием дипептидил-тРНК. Катализирует данную реакцию РНК большой субъединицы рибосом. К настоящему времени обнаружена целая группа РНК, обладающая ферментативными свойствами, которая получила название рибозимов.
Конечней стадией процесса элонгации принято считать транслокацию. Сущность этого процесса состоит в том, что тРНК участка Р, не связанная с пептидом покидает рибосому, а молекула пептидил-тРНК переходит с участка А на участок Р, и рибосома перемещается вдоль мРНК на три нуклеотида в сторону 3`-ОН конца. В результате высвобождается центр А и становится доступным очередной кодон, а fMet-тPHK покидает рибосому. Далее весь цикл элонгации повторяется сначала.
Терминация трансляции.
Терминация представляет собой завершение синтеза полипептидной цепи и освобождение ее от рибосомы (рисунок 3.4).
 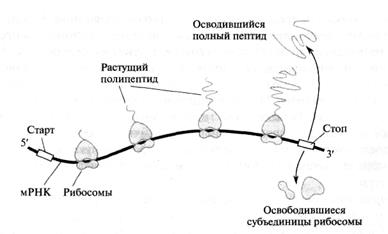 Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза
Рисунок 3.4 - Общая схема высвобождения белка из рибосомы в процессе биосинтеза
|
Сигналами окончание синтеза, являются стоп-кодоны (или терминирующие) на цепи мРНК (см. таблицу 3.1). У этих кодонов нет комплементарных антикодонов тРНК, поэтому при достижении их рибосомой синтез прекращается. В А-центр вместо аа-тРНК входят белковые факторы терминацииRRF, RF1 и RF2.
Под действием этих факторов в Р-центре гидролизуется связь тРНК-полипептид. Освобожденный полипептид диффундирует из рибосомы. Вслед за этим происходит диссоциация комиплекса мРНК-рибосома, а затем рибосома распадается на отдельные субъединицы (малую и большую). После связывания этих частиц с другой молекулой мРНК весь процесс биосинтеза вновь повторяется.
Схема всех стадий процесса трансляции (биосинтеза белка) приведена на рисунке 3.5. Показаны условия, необходимые для начала инициации, формирование инициирующего комплекса, протекание элонгации, транслокации, действие пептидилтрансферазы, и наконец терминации процесса.
Синтез белка — процесс, протекающий со значительной затратой энергии. На образование одной полипептидной связи порядка шести молекул макроэргов. Так, при активации аминокислот АТФ гидролизуется до
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|

IF1, IF2, IF3 – факторы инициации, EF1, EF3 – факторы элонгации
Рисунок 3.5 – Основные этапы трансляции
АМФ, что эквивалентно затрате двух макроэргов, а инициация трансляции требует один макроэрг – ГТФ. В процессе элонгации затрачивается два макроэрга ГТФ: один на доставку аминоацил-тРНК в А-центр рибосомы, а второй — на процесс транслокации. И, наконец, на терминацию требуется один макроэрг ГТФ.
После окончания биосинтеза полипептидной цепи начинается период посттрансляционных превращений полипептида. Эти модификации могут включать в себя: частичный протеолиз (расщепление), модификации аминокислот (карбоксилирование, фосфорилирование, гликозилирование, ацилирование и др.), формирование пространственной структуры белка, образование дисульфидных связей, присоединение простетических групп, образование олигомерных структур и т.д.
Ранее формирование пространственной структуры (фолдинг илисвертывание полипептида) считалось самопроизвольным процессом, в результате которого возникала активная форма белка, энергетически более выгодная и стабильная, нежели хаотичный клубок полипептида. Последние исследования в области молекулярной биологии показали, что пространственная структура белка формируется при участии специальных белков – шаперонов (или белков теплового шока) – белковых комплексов, которые предупреждают неправильное сворачивание полипептида при выходе его из рибосомы и формируют нативную конформацию белка. Механизм сворачивания основан на способности шаперонов изменять кинетику межмолекулярных взаимодействий аминокислотных остатков, причем пространственная структура в конечном итоге будет все-таки опредляться аминокислотной последовательностью белка. Связывание шаперонов с фрагментами полипептидной цепи стабилизирует частично свернутую молекулу до того момента, пока не произойдет правильное пространственное сворачивание белка.
Регуляция синтеза белка.Регуляция синтеза белка очень сложный процесс, поскольку транскрипция и трансляция происходят в разных компартментах и обеспечиваются большим количеством соответствующих структур.
На уровне транскрипции регуляторные механизмы у прокариот и эукариот имеют ряд общих черт, а именно регуляция по механизму индукции и репрессии.
Регуляция по механизму индукции (на примере лактозного оперона). В отсутствие индуктора (лактозы) белок-репрессор связан с оператором. Поскольку участки оператора и промотора перекрываются, присоединение репрессора к оператору препятствует связыванию ДНК-полимеразы с промотором и транскрипция структурных генов оперона не идет. Когда индуктор (лактоза) появляется в среде, то присоединяется к белку репрессору, изменяя его конформацию и снижая сродство к оператору. РНК-полимераза связывается с промотором и траскрибирует структурные гены. В результате синтезируются ферменты, принимающие участие в утилизации лактозы (молочного сахара) (рисунок 3.6).
  П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.6 - Схематическое изображение регуляции синтеза белка
путем индукции
|
Регуляция по механизму репрессии.При регуляции оперона по механизму репрессии белок-репрессор не имеет сродства к оператору. Когда к белку-репрессору присоединится молекула-корепрессор (например, конечный продукт метаболического пути), то в результате конформационных изменений белка комплекс белок-репрессор-корепрессор приобретает сродство к оператору и прекращает транскрипцию (рисунок 3.7).
  П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
П р и м е ч а н и е: ГР – ген-регулятор, П – промотор, ГО – ген-оператор
Рисунок 3.7 - Схематическое изображение регуляции синтеза белка
путем репрессии
|
В клетках высших организмов существует два типа регуляции путем индукции и репрессии – кратковременная и длительная. С помощью первой, регулируется содержание белков в клетках в условиях изменения окружающей среды, с помощью второй –дифференцировка клеток и белковый состав тканей и органов.
Кроме того, для клеток эукариот характерна амплификация генов и их перестройка. Оба механизма обеспечивают резкое увеличение копий тех или иных белков, необходимых для реализации клеточного метаболизма.
Известно, что в клетках эукариот ДНК, соединенная с белками (гистонами), упакована в нуклеосомы. В этом состоянии транскрипция невозможна, и для экспрессии генов необходимо деблокирование транскриптона. Одним из возможных путей активирования транскриптона является процесс фосфорилирования гистонов. В результате действия белковых гормонов происходит опосредованное фосфорилирование ядерных белков (гистонов) и разрушение нуклеосом. Матрица при этом становится доступной для основных факторов инициации транскрипции, и начинается синтез РНК. При прекращении действия гормонов нуклеосомы восстанавливаются.
Ацетилирование и деацетилирование гистонов еще один из факторов регуляции генной активности. В результате ацетилирования положительный заряд белка уменьшается, и сродство гистона к отрицательно заряженной ДНК снижается. Это может привести к разрушению нуклеосом и деблокированию транскриптона. Деацетилирование гистонов приводит к противоположному эффекту.
Скорость синтеза белка напрямую зависит от количества мРНК, которое определяется временем ее «полужизни» или стабильностью in vivo.
Лимитирующей стадией процесса трансляции является ее инициация. Регуляция синтеза белка осуществляется также на стадии процессинга белка. Модификации новосинтезированных полипептидов осуществляются при помощи соответствующих ферментов, активность которых, в свою очередь, находится под генетическим контролем.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Как называется процесс биосинтеза ДНК? Дайте краткую характеристику данного процесса.
2. Как называется процесс биосинтеза РНК? Дайте краткую характеристику данного процесса.
3. Дайте поределение интронам, экзонам, сплайсингу.
4. Как называется процесс биосинтеза белка? Дайте краткую характеристику данного процесса.
5. Что такое генетический код? Перечислите его свойства.
6. Перечислите основные уровни регуляции биосинтеза белка. Дайте им краткую характеристику, приведите примеры.
ГЛАВА 4. МЕТАБОЛИЗМ БИОМОЛЕКУЛ
В ЖИВОМ ОРГАНИЗМЕ
ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ
Под обменом веществ (метаболизмом) понимают строго упорядоченную систему биохимических и физиологических процессов, которые обеспечивают поступление питательных и других веществ в организм, их усвоение, превращение внутри клеток, а также выведение образовавшихся продуктов обмена во внешнюю среду. Обмен веществ обеспечивает процессы роста и размножения, самообновление всех клеточных структур, энергообеспечение, постоянство внутренней среды, приспособление к факторам среды. Поэтому при прекращении обмена веществ нарушается или прекращается жизнедеятельность организма.
В обмене веществ выделяют два взаимосвязанных, но разнонаправленных процесса —катаболизм и анаболизм.
Катаболизм (диссимиляция) — это процессы распада в клетках организма сложных веществ до более простых или до низкомолекулярных конечных продуктов распада (СО2, Н2О, NH3 и мн. др.) и выведения последних из организма. Катаболические реакции сопровождаются выделением свободной энергии, которая заключена в сложных молекулах органических веществ. Часть этой энергии превращается в химическую форму энергии (АТФ, НАДН.Н+ и др.) и запасается в клетках организма. Большая часть энергии рассеивается в виде тепла.
Анаболизм (ассимиляция) — это процессы синтеза сложных химических веществ из простых молекул. В процессе анаболизма образуются нуклеиновые кислоты, белки и другие макромолекулы организма. К ним относятся реакции распада питательных веществ при пищеварении, так как они обеспечивают поступление в клетки строительного материала (молекул-предшественников) и энергии, которые необходимы для процессов анаболизма. Анаболические реакции протекают с использованием химической энергии в виде АТФ или НАДН.Н+.
Анаболизм и катаболизм — разнонаправленные процессы, протекающие независимо друг от друга. Однако они тесно взаимосвязаны между собой. Катаболические процессы поставляют метаболиты и энергию для процессов анаболизма. Анаболические реакции накапливают (запасают) сложные питательные вещества и энергию, что создает возможность дальнейших реакций катаболизма.
Организм человека и животных получает энергию из внешней среды с растительной и животной пищей. Первичным же источником энергии для всех живых организмов является энергия Солнца. Солнечная энергия накапливается зелеными растениями в органических веществах в процессе их фотосинтеза.
Зеленый пигмент растений хлорофилл способен аккумулировать кванты энергии солнечного света (hv) при синтезе органических веществ из углекислого газа и воды: hv + хлорофилл
6СО2 + 6Н2О ¾¾¾¾¾® C6H12O6 + 6O2.
В организме животных энергия химических связей органических веществ извлекается только в процессе их катаболического распада и окисления. При этом высвобождается свободная энергия.
Распад питательных веществ и высвобождение из них свободной энергии происходит постепенно в несколько этапов. Под свободной энергией понимают ту часть химической энергии питательных веществ, которая в организме может использоваться для выполнения полезной работы при постоянной температуре и постоянном давлении.
Свободная энергия в клетках не может использоваться непосредственно в процессах жизнедеятельности. Она в большей степени аккумулируется в химических связях высокоэнергетических (макроэргических) соединений, в основном в молекулах АТФ. Только энергия макроэргических соединений может использоваться клетками для обеспечения многих ее функций. Эта энергия способна превращаться в другие формы энергии.
Изменение свободной энергии (DG) в биохимии принято выражать в джоулях (Дж) на 1 моль вещества.
Таким образом, аккумуляторами и носителями свободной энергии в клетках организма являются высокоэнергетические соединения. В центре энергетического обмена клетки находятся адениннуклеотиды — АТФ и АДФ.
К высокоэнергетическим относят вещества, имеющие химические связи, при гидролизе которых выделяется более 21 кДж/моль свободной энергии. Такие химические связи, как и сами вещества, еще называют макроэргическими и обозначаются значком «~» (тильда).
Как правило, макроэргическими являются фосфорорганические соединения. Кроме АТФ к ним относятся также УТФ, ЦТФ, ГТФ, ТТФ, креатинфосфат, некоторые тиоэфиры (например, ацил-SКоА), фосфоенолпируват, 1,3-дифосфоглицерат и некоторые другие (рисунок 4.1).
Высвобождаемая при их гидролизе свободная энергия используется для переноса фосфата (~РО32-) на молекулу другого вещества, свободная энергия которого ниже. Реакция присоединения фосфата называется фосфорилированием.
Одной из центральных проблем биоэнергетики биохимических процессов является биосинтез АТФ путем фосфорилирования АДФ.
Фосфорилирование АДФ является эндергоническим процессом и требует источника энергии.
Зеленые растения и некоторые микроорганизмы способны трансформировать энергию солнечного света в химическую энергию, которая расходуется на фосфорилирование АДФ в световой фазе фотосинтеза. Этот процесс получил название фотосинтетического фосфорилирования.
|
|
|
|

Рисунок 4.1 - Примеры макроэргических соединений
Трансформация энергии окисления органических молекул в связи АТФ в аэробных условиях происходит преимущественно путем окислительного фосфорилирования. При этом свободная энергия, необходимая для фосфорилирования генерируется в дыхательной цепи митохондрий.
Для субстратного фосфорилирования, в отличие от окислительного, донором активной фосфатной группировки, необходимой для регенерации АТФ из АДФ, служат интермедиаты процессов гликолиза и цикла трикарбоновых кислот.
Несмотря на множество путей получения АТФ клеткой, она быстро расходуется, так как легко отдает свой высокоэнергетический фосфат другим веществам, т.е. выступает в качестве донора фосфатных групп. Практически все реакции энергетического обмена в клетках организма протекают посредством образования и распада молекул АТФ.
В клетках организма химическая форма энергии АТФ преобразуется в другие формы энергии: кинетическую (механическую), электрическую, осмотическую, тепловую (рисунок 4.2).
Выделяемая в реакциях биологического окисления энергия может рассеиваться в виде теплоты или улавливаться в процессе синтеза макроэргических соединений. Поэтому выделяют свободное и сопряженное окисление.
Свободное окисление не связано с переходом энергии биологического окисления в энергию макроэргических соединений. Выделяющаяся энергия рассеивается в виде теплоты. Этот вид энергообразования в клетках важен для теплорегуляции и детоксикации вредных продуктов обмена веществ (микросомальное окисление).
Сопряженное окисление связано с переходом свободной энергии, выделяющейся в процессе биологического окисления, в доступную для использования форму энергии — макроэргические связи АТФ или другие виды энергии, например, ионный градиент.
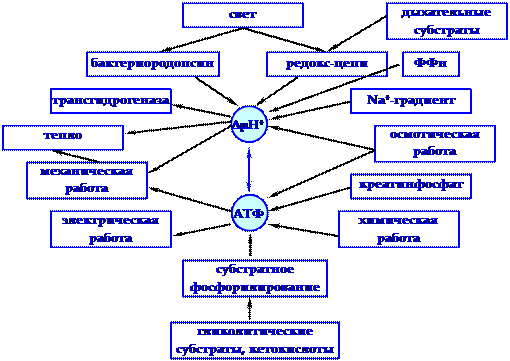 |
DmН+ - протонный электрохимический потенциал, ФФн - пирофосфат
Рисунок 4.2 - Взаимозаменяемость различных видов энергии при
Последнее изменение этой страницы: 2017-07-16
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...