
Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
ЗАДАЧИ И ОРГАНИЗАЦИЯ ЛАБОРАТОРНЫХ СЛУЖБ
Лекция №1
ЗАДАЧИ И ОРГАНИЗАЦИЯ ЛАБОРАТОРНЫХ СЛУЖБ
Задачами аналитических исследований в медико-биологической практике являются определение химического состава и структуры компонентов, содержащихся в разнообразных веществах и материалах биологического происхождения, а также оценка ряда их физических и физико-химических характеристик.
Из всех направлений аналитических исследований биомедицинские исследования выделяются сложностью и разноплановостью. Их отличают как разнообразие самих анализируемых материалов и содержащихся в них веществ, так и множество конкретных задач, которые могут быть поставлены при каждом эксперименте с биопробой.
Вследствие огромного разнообразия конкретных задач лабораторного анализа аналитические лаборатории медико-биологического направления различаются по характеру исследуемых объектов, ввиду проводимых исследований, методикам, скорости и точности выполнения анализов, техническим приемам и средствам, производительности работ, по организационной структуре и внешним связям. Выделяют следующие лабораторные службы:
— диагностические— клинико-диагностические лаборатории (КДЛ);
— санитарные и гигиенические— санитарно-эпидемиоло-гические станции (СЭС);
— экологические— станции экологического контроля (СЭК);
— фармацевтические — лаборатории качества лекарственных препаратов (ЛКЛП);
— биотехнологические— лаборатории контроля продукции биотехнологических производств (ЛКБТП);
— биологические— исследовательские биологические лабо-ратории (ИБЛ);
— пищевые— лаборатории качества продуктов питания (ЛКПП).
Клинико-диагностические лаборатории
Главная задача медицинского лабораторного анализа состоит в получении достоверной диагностической информации о функционировании различных систем человеческого организма на основании проведения лабораторных исследований.
Организационной структурой для выполнения медицинского лабораторного анализа являются клинико-диагностические лаборатории.
Данные из КДЛ, как правило, дополняют данные физиологических исследований, проводимых непосредственно на организме. В то же время диагностическая информация, получаемая с их помощью, почти всегда позволяет ставить диагноз значительно раньше появления симптомов заболеваний, фиксируемых на физиологическом уровне. Поэтому правильный выбор объема проводимых лабораторных диагностических тестов и интерпретация их результатов во многом предопределяют успех и своевременность постановки диагноза, а также выбор терапии и контроль ее эффективности. Особенно важными эти исследования становятся для решения наиболее ответственных и трудных клинических задач, таких, как диагностика инфекционных болезней, определение симптомов онкологических заболеваний, оценка возрастных изменений биохимического статуса организма и т. п.
Значение исследований, проводимых в КДЛ, состоит в том, что они предоставляют непосредственную, часто наиболее раннюю, полную и точную диагностическую информацию о многих тончайших биохимических процессах, происходящих на клеточном, молекулярном и субмолекулярном уровнях. При этом объектом анализа является биологический материал, отобранный из внутренней среды организма: кровь, моча, лимфа, спинномозговая жидкость, желудочный сок, срезы биотканей и другие субстанции, вырабатываемые организмом в процессе его жизнедеятельности.
Обычно в клинической практике используется стандартная аналитическая аппаратура: фотометры, спектроанализаторы, полярографы, масс-спектрометры, центрифуги и т. п., но в зависимости от назначения КДЛ, конкретного биологического материала и метода исследования может использоваться и узкоспециализированная техника.
Характеристика проб окружающей среды
В группу объектов, поступающих на исследование из внешней ОС, включаются вещества, которые участвуют в метаболических процессах организма или определяют среду обитания живых объектов и с которыми постоянно приходится соприкасаться живым объектам в процессе своей жизнедеятельности.
В этой группе можно выделить две подгруппы. В первую подгруппу входят вещества, необходимые человеку для нормального существования: воздух, вода и продукты питания, переработка которых обеспечивает организм энергией и стройматериалами. Вторую подгруппу составляют вещества, определяющие среду обитания организма. Это атмосферный воздух и вода, почва, другие макро- и микроорганизмы, которые живут в этой же среде и, следовательно, могут входить в контакт с организмом человека, отходы жизнедеятельности живых систем и продукты промышленных производств, попадающие в воздух, воду и почву. Соприкосновение с этими составляющими не всегда безвредно для организма человека.
Лекция №2
ГеХрГ – гельхроматография; ИОХрГ – ионнообменная хроматография; АфХрГ — аффинная хроматография; ЭФПААГ — электрофорез в полиакриламидном геле; ИЭФ — изоэлектрофокусирование; МФ — мембранная фильтрация; Д – диализ; ТСХрГ — тонкослойная хроматография; БХрГ— бумажная хроматография
Группа 4. Здесь можно выделить две подгруппы, как наиболее развитые в методическом отношении, — оптические методы и методы, основанные на эффектах ядерной физики.
Оптические методы измерения основаны на использовании различных физико-химических явлений, возникающих при взаимодействии излучения оптического диапазона с веществом пробы: изменении интенсивности, фазы, пространственной ориентации, спектрального состава излучений и т. п. Нашли применение все три оптических диапазона электромагнитного излучения — ультрафиолетовый, видимый и инфракрасный.
Оптические методы широко используются в аналитических лабораториях. Анализаторы, с помощью которых реализуются оптические методы, вместе с электрохимическими анализаторами охватывают более 70 % всей лабораторной техники. Они могут быть использованы как для тончайшего микроанализа биологических веществ, так и для измерения важных макропоказателей, характеризующих свойства или концентрацию отдельных компонентов сложных биосубстратов. Оптические свойства разных компонентов полидисперсных гетерогенных сред отличаются, что позволяет судить об их наличии и концентрации путем регистрации параметров одного или нескольких световых потоков, прошедших исследуемую пробу или отраженных от нее; изучаются и собственные излучения биопробы. При использовании специальных методов освещения исследуемых сред, находящихся в жидкой фазе или с помощью методов подготовки высушенных отпечатков биожидкостей на стеклянных или пленочных подложках, можно восстановить пространственное распределение дисперсных фаз, а также оценить параметры отдельных фрагментов, твердых включений, пузырьков газа, клеток, микроорганизмов.
Большую подгруппу оптических методов составляют также методы спектрального анализа, в которых для изучения состава биопробы и определения концентраций компонентов исследуются оптические спектры излучения и поглощения вещества. В спектральном анализе можно выделить как методически, так и по области применения: атомно-эмиссионный, в том числе и метод пламенной фотометрии; атомно-абсорбционный и атомно-флуоресцентный анализ. Данные методы отличаются необходимостью предварительного перевода исследуемой пробы в атомарное состояние.
Методы лабораторного анализа, основанные на эффектах ядерных взаимодействий, включают ряд методов (масс-спектрометрия, гамма-спектрометрия, рентгеноструктурные методы, электронная микроскопия и др.), позволяющих изучать тонкую структуру многокомпонентных биопроб. Они основаны на взаимодействиях вещества с различного рода проникающими (волновыми и корпускулярными) излучениями, эффекты которых проявляются на молекулярном и атомарном уровнях. Эти методы получили достаточно ограниченное распространение в лабораторной практике в связи со сложностью методического и технического обеспечения и необходимостью соблюдения мер защиты обслуживающего персонала от проникающих излучений. Однако они интенсивно развиваются, совершенствуются и становятся все более доступными, чему способствует появление новых медико-биологических и экологических задач, при решении которых подобные методы оказываются наиболее эффективными.
Рассмотренные методы пригодны для изучения биосубстратов как из ВС, так и из ОС. В то же время особенности задач, решаемых при исследовании биоматериалов из разных сред, отражаются на преимущественном выборе методов анализа.
Лекция №3
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К МЕТОДАМ АНАЛИТИЧЕСКОГО ИССЛЕДОВАНИЯ
Требования, которые предъявляются к методам аналитических исследований, в первую очередь определяются биологической природой и свойствами объекта исследования.
Требования, которые необходимо учитывать при выборе метода лабораторного анализа:
Для проб внутренней среды:
— возможность исследования при малых уровнях воз-действующих энергий и гарантии сохранения исследуемого вещества неповрежденным;
— обеспечение специфичности исследования, т. е. способности получать показатели именно тех компонентов гетерогенной системы, которые позволяют эффективно решить поставленную медико-биологическую задачу;
— высокая чувствительность метода, т. е. получение существенных изменений выходных параметров сигналов при малых изменениях свойств биопробы;
— малые размеры активной зоны, т. е. минимизация объемов анализируемых биопроб;
— минимально возможное время исследования, например за счет перехода к импульсным режимам работы
Для проб окружающей среды:
— возможность определения следов органических и неорга-нических веществ, находящихся в пробе на уровне долей 10-9;
— достаточная селективность (специфичность);
— отсутствие сложной процедуры пробоподготовки;
— небольшая длительность выполнения исследования;
— возможность автоматизации методики (для проведения серийных анализов);
— независимость от уровня квалификации персонала;
— доступная стоимость оборудования;
— минимальные массогабаритные характеристики анализа-торов, позволяющие проводить исследование в полевых условиях;
— достаточная универсальность (определение большого количества веществ, с одной стороны, и возможность одновременного определения нескольких компонентов пробы — с другой.
Отмеченные требования определяют требования к измерительным преобразователям, например, такие, как их минимизация, высокая чувствительность, помехоустойчивость и др.
МЕТОДИЧЕСКИЕ СХЕМЫ ПРОВЕДЕНИЯ
АНАЛИТИЧЕСКИХ ИССЛЕДОВАНИЙ
Каждый из перечисленных выше методов предназначен для получения информации о состоянии или свойствах изучаемого объекта. Чтобы такая информация стала доступной для исследователя, последнему необходимо организовать само исследование, т. е. предварительно подготовить оборудование и объект к эксперименту, а затем подключить технические средства таким образом, чтобы получить требуемый результат с минимальными искажениями. Определим схему взаимного расположения объекта исследования и всех технических средств, необходимых для реализации выбранного метода лабораторного эксперимента, как методическую схему его выполнения.
При выборе методической схемы основное внимание должно быть уделено качеству получаемой исследовательской информации. При этом качество информации определяется степенью ее достоверности, достигаемой в ходе эксперимента, особенно при наличии мешающих факторов, сопровождающих процесс исследования.
Биопроба из ИС представляет интерес только потому, что несет в себе информацию о состоянии и свойствах этой среды, вещественным носителем которой является тот или иной ее компонент. В то же время Биопроба содержит мешающие компоненты, которые при проведении измерений могут исказить параметр сигнала, несущий исследовательскую информацию. Это различные примеси, а также вещества, которые могут дать при применении выбранного метода такую же реакцию, как и полезная составляющая. Такие компоненты можно считать вещественными помехами. Тогда смысл всех преобразований, проводимых с биопробой, следует определить как выделение из нее полезной (релевантной) составляющей. Следовательно, в процедуру пробоподготовки аналитического этапа целесообразно включать те операции по преобразованию биопробы в конечный продукт, которые позволяют освободиться (по возможности) от мешающих компонентов, но при этом сохранить сведения о тех свойствах исследуемой среды, ради изучения которых и ставится медико-биологический эксперимент.
Получение достоверных результатов предполагает учет следующих принципов адекватности:
— измеряемый физический параметр должен соответствовать исследуемой характеристике биопробы;
— все преобразования, входящие в пробоподготовку, должны изменять БП таким образом, чтобы обеспечить соответствие физических параметров конечного продукта свойствам исходной биопробы.
Методические схемы многих методов по принципам своего построения совпадают, что позволяет во всем их многообразии выделить несколько типовых вариантов.
Одной из самых распространенных схем является внутреннее энергетическое (методическое) воздействие на биопробу, которое осуществляется в первичном измерительном преобразователе анализатора. В зависимости от характера энергетического воздействия будут проявляться различные свойства пробы — каждое воздействие порождает ряд измерительных эффектов (см. подгл. 2.5). При этом доля энергии, измененная взаимодействием с веществом, преобразуется в электрический сигнал, параметры которого несут информацию об исследуемых свойствах пробы.
Все методы, основанные на эффектах взаимодействия пробы с потоком энергии, могут быть представлены общей методической схемой (рис.1 ).

Рис.1 Обобщенная методическая схема аналитического исследования
Пусть Е — поток энергии, подаваемой от специального источника (И) на измерительную кювету с КПИВ. Пренебрегая потерями энергии на пути к кювете, в материале кюветы и индифферентных веществах, можем утверждать, что в общем случае
 ,
,
где  — доли потока энергии, соответственно поглощенная (запасенная), рассеянная (отраженная) биопробой и прошедшая сквозь биопробу.
— доли потока энергии, соответственно поглощенная (запасенная), рассеянная (отраженная) биопробой и прошедшая сквозь биопробу.
Энергия, запасенная биопробой, при определенных условиях может быть излучена в виде потока энергии Е*1 обычно имеющего иные характеристики, чем поток Е или Е1. Поток энергии Е3 может быть подвергнут воздействию со стороны вещества биопробы, при этом некоторые его параметры изменятся. Например, может измениться направление потока излучения в соответствии с законами преломления на границе сред с различными показателями преломления, направление плоскости поляризации и т. д. Такой поток энергии обозначен как Е*3. Энергия Е2 несет в себе информацию о параметрах взаимодействия пробы с падающим потоком Е. Та доля рассеянной энергии, которая подлежит измерению, обозначена как Е*2.
Доля энергии, содержащая информацию о свойствах пробы, улавливается приемником первичного измерительного преобразователя, в котором характеристики потока энергии преобразуются в физические параметры, удобные для дальнейшего преобразования или непосредственного измерения.
Рассмотренная методическая схема пригодна практически для всех методов прямого измерения, применяемых в аналитических исследованиях. Под методами прямого измерения обычно понимают методы, основанные на измерении энергии, несущей информацию о непосредственном взаимодействии вещества с падающим потоком энергии. Свойством, зависящим от природы вещества, является, например, длина волны спектральной линии в эмиссионной спектроскопии, потенциал полуволны в полярографии, а количественной характеристикой служит интенсивность сигнала — интенсивность спектральной линии в первом случае и сила диффузионного тока — во втором. В некоторых методах (абсолютные методы) связь аналитического сигнала с природой вещества установлена математически строго.
В методах косвенного измерения измерительная информация заключена в характеристиках дополнительно воздействующего на биопробу агента (например, химического), а рассмотренное ранее энергетическое воздействие используется только для индикации характерного состояния биопробы. Типичный пример — методы титрования, в которых концентрация исследуемого компонента в биопробе определяется таким количеством вещества известной концентрации (титранта), вступающего в химическую реакцию с анализируемым веществом, которое приводит пробу в характерное состояние (достижение точки эквивалентности), обнаруживаемое тем или иным способом. В ходе титрования измеряется интенсивность аналитического сигнала и строится кривая титрования, представляющая зависимость интенсивности сигнала от объема добавленного в пробу титранта. Точка эквивалентности находится по кривой титрования. Виды кривых весьма многообразны, так как интенсивность аналитического сигнала может быть связана с концентрацией определяемого компонента, титранта или продукта реакции.
Связь интенсивности аналитического сигнала I с концентрацией исследуемого компонента в прямых методах измерения имеет различный характер. Часто эта зависимость выражается простым линейным соотношением:
I = АС, (2.5)
Где 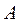 - некоторая константа; С — определяемая концентрация компонента.
- некоторая константа; С — определяемая концентрация компонента.
Лекция №4
Таблица 3.1
Группы операций и преобразований лабораторного исследования
| Этап | Группа | Содержание операций и преобразований | Объект преобразований | Примеры конкретных операций | |
| Доаналитический | Подготовка лабораторного оборудования и аппаратуры | БП | Приготовление реагентов; стерилизация; подготовка прибора к работе | ||
| Отбор, хранение, доставка пробы | Добавление в биопробу антикоагулянта; замораживание бипробы | ||||
| Аналитический | пробоподготовка | Мерные операции | ИВБП Реагенты | Дозирование биопробы и реагентов, взвешивание реагентов | |
| Операции, не приводящие к изменению агрегатного состояния или биохимических свойств вещества | ПП Реагенты | Фильтрование, центрифугирование, отстаивание | |||
| Направленные воздействия, приводящие к изменениям свойств или агрегатного состояния вещества | ПП Реагенты | Термостатирование, химические реакции воздействия полями | |||
| контакт с ИП | Погружение ИП, заполнение реакционного объема и т.п. | КПИВ | Пропускание потока излучения через кювету, погружение электрода | ||
| измерение | Линейные и нелинейные преобразования, получение числового значения ФП | Сигналы ИП | Фильтрация, усиление, интегрирование, расчет по формуле | ||
| Постаналитический | Обработка и интерпретация результатов | МБП | Построение калибровочных графиков, формирование заключения |
Наиболее интересными и разнообразными являются описания аналитических этапов исследования, так как именно на этом этапе применяются различные методы изучения биопроб. Рассмотрение аналитического этапа любого лабораторного исследования показывает, что в нем всегда можно выделить два основных подэтапа, каждый из которых отражает специфические преобразования с различными по физической природе носителями информации.
Первый из них связан с преобразованиями материальных объектов — исходного вещества пробы — в конечный продукт — вещество, с которым непосредственно взаимодействует измерительный преобразователь (вобщем случае их может быть несколько). Определим его как пробоподготовительный этап — ППЭ.
Второй (назовем его измерительным этапом — ИЭ, хотя не для всех видов анализа обязательно присутствие измерения как такового) связан с преобразованиями электрических сигналов ИП до получения оценки результата анализа. Этапы связаны друг с другом через операцию преобразования вида носителя информации, которая осуществляется с помощью измерительных преобразователей.
Как уже отмечалось, задача ППЭ состоит в том, чтобы приспособить биопробу к процессу измерения с учетом соблюдения рассмотренных ранее (см. подгл. 2.6) принципов адекватности исследования.
На аналитическом этапе при осуществлении ППЭ выполняются операции групп 3–5 (см. табл. 3.1). Отмеривание реагентов или вещества пробы (группа 3) обычно производится по объему, массе, заданному значению pH, оптической плотности и т. п. и чаще всего сводится к дозированию жидкостей или твердых реагентов.
Особый интерес для рассмотрения представляют операции, отнесенные к группам 4 и 5. Поскольку одной из задач ППЭ является выделение (концентрирование) из 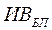 отдельных фракций и компонентов вида
отдельных фракций и компонентов вида 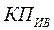 для дальнейшего анализа, то чаще всего это достигается посредством одного из препаративных методов, рассмотренных в подгл. 2.3.
для дальнейшего анализа, то чаще всего это достигается посредством одного из препаративных методов, рассмотренных в подгл. 2.3.
Простейшие операции, использующие физико-механические принципы фракционирования и разделения вещества, не приводят к изменению его агрегатного состояния или биохимических свойств и относятся к группе 4. Сюда же можно включить перемешивание, разбавление, встряхивание и т.п., а также довольно распространенную операцию промывки образцов или частиц в воде (или буферном растворе) для отделения их от избыточных компонентов реакции.
К группе 5 отнесены операции, направленно воздействующие на вещество (под воздействием на вещество будем понимать такие операции, которые приводят к значимому (фиксируемому) изменению его свойств), при которых оно претерпевает физико-химическую, биохимическую или биологическую трансформации. В свою очередь, эта группа может быть разделена на соответствующие подгруппы, представленные в табл. 3.2.
Таблица 3.2
Рис. 3.3. Запись ОТС выполнения некоторого лабораторного исследования
В приведенном примере для реализации конкретной методики на ППЭ требуется проведение операций групп 3, 4 и 5 одновременно как с веществом пробы, так и с реагентами. Поэтому технологические цепочки, отражающие последовательности этих операций, располагаются как бы в двух контурах – основном и вспомогательном.

Рис. 3.4. ИСМ технологического процесса определения концентрации гемоглобина в крови гемиглобинцианидным методом
Вторая (вспомогательная) связана с подготовкой холостой пробы (ХП) и измерением ее оптических характеристик, причем оба этих измерения производятся параллельно с анализом некоторого реактива, который определен в методике анализа как стандартный раствор СТ.
Процедура приготовления холостой пробы отражена последовательностью преобразований в одном из вспомогательных контуров. Она изготовляется путем смешивания четырех предварительно дозированных ингредиентов — цепочка Ri®RiД, где R1—ацетонциангидрин; R2—железосинеродистый калий, R3—гидрокарбонат натрия, R4—дистиллированная вода. Последний ингредиент используется несколько раз: для разведения дозированной пробы ИВБП, а также при приготовлении промежуточного ППД и конечных продуктов — (КП)СТ и (ХП)Д. Над каждым символом «→» технологической операции с веществами стоит дополнительное обозначение: Д—дозирование,  — временная выдержка. Для указания операции смешивания исходных ингредиентов использован символ «♦».
— временная выдержка. Для указания операции смешивания исходных ингредиентов использован символ «♦».
После преобразования сигналов {U}ИП устройствами обработки (операторы 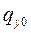 ) в главном и вспомогательном контурах появляются операции отображения результата анализа на устройстве отображения (операторы
) в главном и вспомогательном контурах появляются операции отображения результата анализа на устройстве отображения (операторы  ). Данная запись ИСМ относительно проста, и ее можно представить в ОСФ полностью. Однако для сложных процедур записи структур в подобном виде оказываются очень громоздкими, что затрудняет их анализ. В таких случаях удобно воспользоваться блочным вариантом записи структуры в соответствии с выражением (3.2.).
). Данная запись ИСМ относительно проста, и ее можно представить в ОСФ полностью. Однако для сложных процедур записи структур в подобном виде оказываются очень громоздкими, что затрудняет их анализ. В таких случаях удобно воспользоваться блочным вариантом записи структуры в соответствии с выражением (3.2.).

Рис. 3.5. Блочная форма ИСМ процесса определения гемоглобина крови
Воспользовавшись данным приемом для записи ИСМ, изображенной на рис. 3.4, можно построить блочную схему этого исследования (рис. 3.5), где  — блок операций, а индексы
— блок операций, а индексы  отражают идентификаторы объектов, участвующих в технологической процедуре.
отражают идентификаторы объектов, участвующих в технологической процедуре.
Запись структуры информационных преобразований, описывающей процесс лабораторного анализа в ОСФ, как было определено выше, представляет собой информационно-структурную модель соответствующего технологического процесса, поэтому структуры, представленные на рис. 3.4 и 3.5, отражают ИСМ определения гемоглобина крови.
Рассмотренный способ формализации структур информационных преобразований в процессе аналитических исследований может быть эффективно использован при выявлении особенностей технологических процедур, оптимизации последовательностей типовых блоков операций и в других задачах, связанных с совершенствованием методик ЛА.
Лекция №5
Интерференционный светофильтр
Явление интерференции широко используется в оптической технике, в частности, для изготовления интерференционных светофильтров. Интерференционный светофильтр состоит из нескольких последовательно расположенных тончайших непоглощающих слоев из диэлектрических материалов — окислов 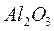 ,
,  ,
, 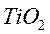 ; фторидов
; фторидов 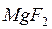 ,
,  ,
, 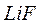 ; сульфидов
; сульфидов  ,
,  и других соединений. При прохождении белого света через такую систему с многочисленными границами раздела свет многократно переотражается. В результате интерференции отраженных лучей с проходящими лучами (отраженные и проходящие лучи когерентны) часть светового потока ослабляется лишь незначительно, а часть—в 10
и других соединений. При прохождении белого света через такую систему с многочисленными границами раздела свет многократно переотражается. В результате интерференции отраженных лучей с проходящими лучами (отраженные и проходящие лучи когерентны) часть светового потока ослабляется лишь незначительно, а часть—в 10 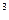 — 10
— 10  раз.
раз.
Светофильтры используются в фотометрах в качестве монохроматоров.
Дифракция света — это отклонение света от прямолинейного распространения, когда свет огибает контур непрозрачных тел и, следовательно, проникает в область геометрической тени. Если на щель падает световая волна, то, фокусируя линзой свет, прошедший через щель, можно наблюдать чередование максимумов и минимумов освещенности.
Если свет падает не на одну щель, а на ряд параллельных щелей (решетку), то пучки, испытав дифракцию на каждой щели, интерферируют между собой.
Простейшая дифракционная решетка состоит из прозрачных участков (щелей), разделенных непрозрачными промежутками. На решетку направляется параллельный пучок света. Наблюдение ведется на непрозрачном экране в фокальной плоскости линзы, установленной за решеткой.
В каждой точке Р на экране в фокальной плоскости линзы соберутся лучи, которые до линзы были параллельны между собой и отклонились на решетке под определенным углом θ. Для того, чтобы в точке Р наблюдался интерференционный максимум, разность хода ∆ между волнами, испущенными соседними щелями, должна быть равна целому числу длин волн:
 ,
,
где d — период решетки, m — целое число, которое называется порядком дифракционного максимума. В тех точках фокальной плоскости линзы, для которых это условие выполнено, располагаются главные максимумы дифракционной картины.
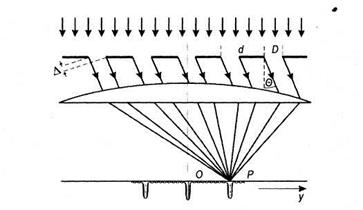
Рис. 6.21. Дифракция света на решетке.
Решетка способна разлагать излучение в спектр, то есть она является спектральным прибором — составной частью монохроматоров (устройств для выделения монохроматического света). Если на решетку падает немонохроматическое излучение, то в каждом порядке дифракции (то есть при каждом значении m) возникает спектр исследуемого |излучения. Одной из важнейших характеристик дифракционной решетки является ее разрешающая способность, характеризующая возможность разделения с помощью данной решетки двух близких спектральных линий с длинами волн  и
и 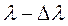 . Спектральной разрешающей способностью R называется отношение длины волны
. Спектральной разрешающей способностью R называется отношение длины волны  к минимальному возможному значению
к минимальному возможному значению 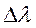 . Разрешение дифракционной решетки зависит только от порядка спектра m и от числа периодов решетки N.
. Разрешение дифракционной решетки зависит только от порядка спектра m и от числа периодов решетки N.
Поляризацией света называется выделение из пучка естественной света лучей, поляризованных в определенной плоскости. В источниках света элементарные процессы излучения света атомами происходят независимым образом, поэтому в обычном свете оси электромагнитных волн ориентированы хаотично, и свет, испускаемый обычны ми источниками (солнечный свет, излучение ламп накаливания и т. п.) неполяризован. Неполяризованный свет называют также естественным светом.
Вещества, способные изменять (вращать) плоскость поляризации света, являются оптически активными веществами; вещества, не способные изменять плоскость поляризации света, являются оптически неактивными. Поляриметрический метод анализа основан на измерении угла вращения плоскости поляризации луча света, прошедшего через оптически активную среду, которая помещается между поляризатором и анализатором.
Глюкоза имеет ассиметричные атомы углерода, связанные с разными группировками, поэтому обладают способностью вращать плоскость поляризованного луча. На этом основано определение глюкозы в моче с помощью поляриметра. Угол вращения плоскости поляризации зависит от оптической толщины раствора и концентрации глюкозы в растворе.
Поляриметр
Основной частью любого прибора для поляриметрического анализа является источник поляризованных лучей (поляризатор) и измеритель угла поляризации (анализатор).
На рис. 6.28. приведена схема простейшего поляриметра.

Рис. 6.28. Схема простейшего поляриметра.
1 — поляризатор; 2 — пластинка бикварца; 3 — кювета с раствором; 4 — анализатор.
При использовании простейшего поляриметра анализатор настраивают на «темноту», вращая его вокруг продольной оси. Затем вносят в прибор кювету с исследуемой жидкостью. При этом наблюдается просветление поля окуляра вследствие вращения плоскости поляризации раствором. Поворачивая анализатор, добиваются нового потемнения поля, причем угол поворота анализатора соответствует углу вращения раствором плоскости поляризации. Для более точного определения момента затемнения поля окуляра применяют дополнительную пластинку 2, состоящую из двух пластинок левовращающего и правовращающего кварца (так называемая пластинка бикварца).
При малейшем повороте анализатора обе половинки бикварца меняют свою окраску: одна становится синей, а другая — красной. Таким образом фиксируется малейший поворот анализатора.
ФОТОМЕТРИЧЕСКИЕ СХЕМЫ
РАСТВОРОВ
Метод измерения оптического поглощения исследуемого раствора относительно раствора сравнения в одной и той же спектральной полосе излучения реализуется двумя основными схемами:
1. Схемой фотометрирования с одним световым лучом (однолучевое фотометрирование).
2. Схемой фотометрирования с двумя световыми лучами (двухлуче-вое фотометрирование).
Однолучевое фотометрирование (рис. 8.20). Вначале измеряется сигнал фотодетектора, соответствующий величине излучения Iст прошедшего через раствор сравнения (стандартный раствор, холостую пробу) и кювету, содержащую этот раствор. Оптическая плотность кюветы с раствором сравнения D  сигнал I
сигнал I  связаны соотношением:
связаны соотношением:


 .
.
Затем измеряется сигнал фотодетектора, соответствующий величины излучения I  , прошедшего через кювету с исследуемой пробой. Оптическая плотность исследуемого раствора D
, прошедшего через кювету с исследуемой пробой. Оптическая плотность исследуемого раствора D  сигнал
сигнал  связаны соотношением:
связаны соотношением:
 .
.
Искомая плотность 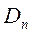 равна:
равна:
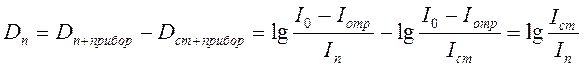 .
.
Рассмотренная схема измерения содержит одно измерительное плечо. Чтобы измерить сигналы, соответствующие 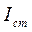 и
и  необходимо попеременно вводить в измерительное плечо кювету с исследуемым раствором и кювету с раствором сравнения. Такую схему называют схемой прямого фотометрирования.
необходимо попеременно вводить в измерительное плечо кювету с исследуемым раствором и кювету с раствором сравнения. Такую схему называют схемой прямого фотометрирования.

Рис. 8.20. Схема однолучевого метода измерения оптической плотности исследуемого раствора относительно раствора сравнения в одной и той же спектральной полосе излучения.
Последовательно измеряется оптическая плотность кюветы со стандартом (а) и исследуемой пробой (б).
Измерение оптической плотности проводится в одном канале последовательно. Вначале измеряется сигнал раствора сравнения (а), затем — исследуемого раствора (б). Результаты регистрируются раздельно, обработка производится вручную. Недостаток метода в большом временном интервале между фотометрированием растворов, что приводит к погрешностям измерений из-за временной нестабильности оптико-электронного тракта (источника излучения и фотоприемников).
Двухлучевое фотометрирование. Оптическая плотность исследуемого и сравнительного образцов измеряется одновременно в двух каналах. Далее могут быть различными схемы сопоставления сигналов. На рис. 8.21. показана схема, при которой сигналы поступают на 2 фотоприемника и представляются на 2-х индикато
Последнее изменение этой страницы: 2016-08-29
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...