Категории:
ДомЗдоровьеЗоологияИнформатикаИскусствоИскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиЭкологияЭкономикаЭлектроника
Оборудование для электрохимических методов анализа
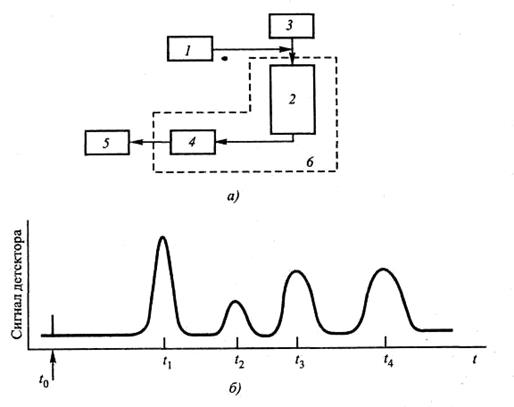
PH метры - это специальные приборы для измерения активности ионов водорода (отсюда и название - pH) в различных средах – питьевой воде, продуктах питания, в окружающей среде, что делает этот прибор практически незаменимым спутником любого уважающего себя исследователя, будь то химик, микробиолог или специалист по окружающей среде. Современные PH-метры позволяют вести исследования даже в агрессивных средах. Электронные ph метры удобны в обращении и широко используются по всему миру. Карманные ph метры, благодаря своему небольшому размеру занимают немного места, но обладают той же богатой функциональностью, что и их старшие собратья. Цифровые ph метры могут использоваться практически во всех условиях, будь то полевые исследования или санитарные измерения. Иономеры - приборы, предназначенные для измерения активности ионов (рХ), ЭДС электродных систем, окислительно-восстановительного потенциала, молярной и массовой концентрации ионов, температуры водных сред. Приборы находят широкое применение в лабораториях предприятий и научно-исследовательских учреждений химической, металлургической, фармацевтической промышленности, в сельском хозяйстве, в медицине, в биологии. Кислородомеры (оксиметры) - портативные и приборы, предназначенные для измерения концентрации кислорода, растворенного в водных средах. Диапазон их применения - от химико-биологических исследований на водоочистных сооружениях и в рыбоводческих хозяйствах, до контроля параметров водно-химических режимов на объектах промышленности, тепловой и атомной энергетики. В зависимости от модели кислородомера, он может иметь выносной датчик, возможность автоматической термо- барокомпенсации и самодиагностики. Кондуктометры- идеальное средсво для контроля количества растворенных солей и взвешенных частиц в воде. Кондуктометры незаменимы для контроля промышленных трубопроводов или вод, для водной флоры и фауны. Кондуктометры предназначены для непрерывного измерения и двухпредельной сигнализации отклонений удельной электропроводимости воды от заданного значения в процессах водоподготовки и контроля водного режима ТЭС. Электроды для электрохимических методов анализа подбираются индивидуально к каждому измерительному прибору с необходимыми для каждого конкретного случая параметрами. При выборе электрода следует обратить внимание на совместимость разъема, установленного на его кабеле с соответствующим гнездом прибора. Возможно, потребуется применение переходника, или замена разъема. Лекция №8 ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ Под общим названием хроматографияХрГобъединены методы разделения вещества биопробы на отдельные компоненты, в основе которых лежит процесс распределения этих компонентов между неподвижной (стационарной) и подвижной фазами, перемещающимися друг относительно друга. В зависимости от строения разделяемые компоненты в различной степени удерживаются той и другой фазами и вследствие этого могут быть отделены друг от друга. Под действием диффузии и других физико-химических механизмов молекулы разделяемых веществ пересекают поверхность раздела обеих фаз. Этот процесс можно охарактеризовать как элементарный акт взаимодействия анализируемого вещества (сорбата) с неподвижной фазой (сорбентом). Данный акт взаимодействия осуществляется многократно, причем каждый раз достигается некоторый эффект разделения. Чем эффективнее такой элементарный акт и чем чаще он повторяется, тем выше эффект разделения, или, иными словами, выше разрешающая способность процесса. При продвижении компонентов исследуемой смеси (биопробы) в разделяющей среде такой процесс межфазового перехода можно описать как многократное повторение актов сорбции и десорбции. По Завершении процесса компоненты удерживаются той или иной фазой в зависимости от своих свойств. В основу классификации вариантов хроматографии могут быть положены различные критерии: — агрегатное состояние фаз; — природа элементарного (единичного) акта взаимодействия; — аппаратурное оформление процесса; — способ относительного перемещения фаз; — конечная цель процесса. Рассмотрим каждый из перечисленных вариантов более подробно. 1. Агрегатное состояние фаз. Обычно данный критерий является основным, так как природа элементарных актов сорбции-десорбции на твердой и жидкой фазах принципиально различна. В зависимости от агрегатного состояния подвижной фазы (ПФ) различают жидкостнуюЖХрГ и газовую ГХрГ хроматографию. В ЖХрГ роль неподвижной фазы (НФ) обычно играет сорбент, а в качестве ПФ используется элюент (растворитель). В этом случае процесс разделения в значительной степени определяется составом ПФ, в качестве которой используется множество веществ, при этом для каждого случая необходимо подбирать подходящую систему разделения. В ГХрГ в качестве носителя биопробы — ПФ выступает газ, а в основе лежат процессы распределения между фазами и адсорбции, поэтому ГХрГ делится на адсорбционную (НФ — твердое вещество) и жидкостную (НФ — жидкость). Свойства газа-носителя имеют второстепенное значение для процесса разделения, он служит только для перемещения разделяемой смеси. 2. Природа элементарного (единичного) акта взаи-модействия. Известно несколько вариантов единичного акта взаимодействия исследуемой среды с веществами НФ и ПФ фаз. А. Адсорбция разделяемых веществ на поверхности адсорбента. При использовании твердой НФ жидкие и газообразные биопробы разделяются на основе отличий в адсорбционном сродстве их компонентов с веществом НФ — классический вариант хроматографии. Адсорбция может быть обусловлена либо физическими ван-дер-ваальсовыми силами межмолекулярного взаимодействия, либо химическими связями (в процессе реакции при обмене ионов разделяемых компонентов на ионы адсорбента). В последнем случае взаимодействуют ионы НФ и раствора. Разделение смеси ионов в растворе основано на степени их сродства к твердой фазе, в качестве которой выступает вещество — ионообменник, способное обмениваться ионами с жидкой биопробой. Явление адсорбции лежит в основе адсорбционной ХрГ — АдХрГ, причем в первом варианте она реализуется как молекулярная адсорбционная ХрГ — МАдХрГ, а во втором — как ионообменная адсорбционная — ИОАдХрГ. Б. Различия в растворимости веществ. Этот вариант реализуется при использовании жидкой НФ. Элементарный акт взаимодействия, как правило, является актом растворения (абсорбции) компонентов биопробы в растворителе (жидкая фаза) и распределении их между ПФ и НФ (распределительная ХрГ — РХрГ). Разделение биопробы на компоненты основано на различии коэффициентов распределения веществ либо между жидкими НФ и ПФ, либо между жидкой и газообразной фазами. Если в качестве НФ используется специальный гель с определенными размерами пор, а разделение пробы основано на различной степени проникновения молекул веществ в поры геля, то этот вариант определяется как гель-хроматография— ГеХрГ. В. Водородная связь или химическое сродство компонентов вещества биопробы с материалом НФ. Разделение происходит за счет химического взаимодействия с образованием плохо растворимого осадка (хемосорбционная, или осадочная, ХрГ — ХСХрГ).Широкого применения этот вариант хроматографии не нашел. Г. Биоспецифическое взаимодействие. В основе сродства лежат сугубо специфичные взаимодействия между компонентами по принципу «ключ-замок». Такой вариант известен под названием аффинная ХрГ — АфХрГ). В реальных условиях почти всегда одновременно с основным процессом взаимодействия компонентов пробы с НФ протекают и другие процессы, которые также вносят свой вклад в механизм разделения. Например, на ионообменниках дополнительно может протекать процесс адсорбции на твердой фазе, в распределительной 3. Аппаратурное оформление процесса. По способу размещения НФ различают колоночную, капиллярную, тонкослойную хроматографию и хроматографию в полях сил. Способ размещения НФ в значительной степени определяет конструкцию хроматографа — прибора в котором протекает процесс разделения пробы. Результатом выполнения исследования является хроматограмма — графическая запись, отражающая информацию о выделенных компонентах (чаще всего — в виде пиков, амплитуда которых пропорциональна их количественному соотношению). 4. Способ относительного перемещения фаз. В зависимости от характера перемещения сорбирующихся веществ вдоль слоя сорбента различают проявителъный (элюентный), фронтальный и вытеснительный варианты хроматографического процесса. Их схематические изображения и хроматограммы представлены на рис. 4.1. По оси ординат на графиках отложено свойство выходного потока, зависящее от его состава (например, концентрация компонента), по оси абсцисс — время разделения. 5. Конечная цель процесса. Хроматографию можно рассматривать как гибридный метод, в котором технологический процесс представляет собой часть аналитической системы, сочетающей разделение и измерение. В связи с этим сам хроматографический процесс может использоваться либо в технологических задачах, связанных с получением материальных продуктов (препаративное применение ХрГ), либо для получения информации о качественном и количественном составе и физико-химических свойствах исследуемых объектов (аналитическое применение ХрГ). В последнем случае хроматография может применяться в сочетании с другими физико-химическими методами. ОБЩАЯ МЕТОДИЧЕСКАЯ СХЕМА ХРОМАТОГРАФИЧЕСКОГО ИССЛЕДОВАНИЯ Для понимания технологии проведения хроматографического разделения рассмотрим в самых общих чертах обобщенную схему хроматографа, которая представлена на рис. 4.2, а. Здесь представлены только основные блоки хроматографа (в реальных условиях аппаратура для проведения колоночного варианта разделения включает много дополнительных элементов). Непосредственно процесс разделения пробы на отдельные компоненты происходит в колонке 2, предварительно заполненной подвижной фазой (сорбентом). Подача ПФ в колонку осуществляется с помощью специального устройства ввода 3. Исходную биопробу вносят дозатором 1 (конструкция его определяется агрегатным состоянием пробы и типом подвижной фазы (ПФ)). Для хорошего разделения биопробу необходимо вводить в колонку в виде небольшой компактной дозы, тогда все компоненты смеси начинают перемещаться одновременно. По мере продвижения через колонку компоненты смеси сорбируются в верхних слоях сорбента, причем менее сорбирующиеся компоненты перемещаются быстрее, чем прочно сорбирующиеся компоненты. При хорошем качестве разделения слои сорбированных веществ вымываются практически полностью, и на выходе колонки получается поток растворителя, содержащего последовательно все компоненты анализируемой смеси. Далее выделенные компоненты поступают в детектор 4, где происходит их идентификация или количественное определение. Детектор представляет собой сложное устройство, основным элементом которого является чувствительный элемент (датчик), определенным образом реагирующий на свойства исследуемых компонентов. На его выходе установлен самописец 5 — регистрирующее устройство, графически отображающий сигналы детектора в виде хроматограммы. Как правило, колонка и детектор хроматографа находятся внутри термостата 6, который обеспечивает требуемый температурный режим разделения.
Рис. 4.2. Принцип хроматографического разделения биопробы: |
Последнее изменение этой страницы: 2016-08-29; просмотров: 601
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...
 наряду, с растворением вещества в жидкой НФ может наблюдаться адсорбция на поверхности раздела газ-жидкость и т. д. Поэтому при проведении разделения надо стремиться к тому, чтобы действие побочных процессов было сведено к минимуму.
наряду, с растворением вещества в жидкой НФ может наблюдаться адсорбция на поверхности раздела газ-жидкость и т. д. Поэтому при проведении разделения надо стремиться к тому, чтобы действие побочных процессов было сведено к минимуму.