
Главная Случайная страница
Категории:
ДомЗдоровьеЗоологияРнформатикаРскусствоРскусствоКомпьютерыКулинарияМаркетингМатематикаМедицинаМенеджментОбразованиеПедагогикаПитомцыПрограммированиеПроизводствоПромышленностьПсихологияРазноеРелигияСоциологияСпортСтатистикаТранспортФизикаФилософияФинансыХимияХоббиРкологияРРєРѕРЅРѕРјРёРєР°Рлектроника
Хімічний зв’язок. Будова молекул.
Кристалічний стан речовини
Програмні питання
Основи квантово-механічної теорії хімічного зв’язку. Природа хімічного зв’язку; типи хімічного зв’язку. Енергія та довжина зв’язку. Ковалентний зв’язок та його характеристики: насиченість, напрямленість, полярність і поляризованість. Метод валентних зв’язків. Обмінний та донорно-акцепторний механізми утворення ковалентного зв’язку. Ефективний заряд атома. Способи перекривання атомних орбіталей: s-іp-зв’язки. Кратні зв’язки. Гібридизація атомних орбіталей, типи гібридизації. Геометрична конфігурація молекул. Валентні кути. Полярність молекул, дипольний момент молекули (електричний момент диполя). Іонний та металічний типи зв’язку.
Міжмолекулярна взаємодія: орієнтаційна, індукційна та дисперсійна. Водневий зв’язок. Енергія міжмолекулярної взаємодії.
Кристалічний та аморфний стани речовини. Анізотропія властивостей кристалів. Явища поліморфізму та ізоморфізму. Типи кристалічних решіток: атомна, іонна, молекулярна і металічна. Залежність властивостей речовин у кристалічному стані від характеру зв’язку між частинками. Ідеальні та реальні кристали.
7.1. Ковалентний хімічний зв’язок
Хімічний зв’язок - це електростатична взаємодія між валентними електронами та ядрами атомів хімічних елементів, що взаємодіють один з одним. Тому вважається, що природа хімічного зв’язку електрична. Оскільки утворення молекул - процес довільний, він є енергетично більш вигідним, тобто енергія молекули менша за суму енергій окремих атомів. Отже, під час утворення хімічного зв’язку енергія виділяється, причому чим більше величина енергії, що виділяється, тим утворюється міцніший зв’язок.
Описати хімічний зв’язок означає з’ясувати, як саме розподіляється електронна густина відносно центрів взаємодіючих атомів. Залежно від характеру її розподілення розрізняють такі основні типи хімічного зв’язку: ковалентний, іонний та металічний.
Найпоширенішим і більш універсальним типом зв’язку вважають ковалентний зв’язок. Щоб описати його, використовують зазвичай два основні методи: метод валентних зв’язків (МВЗ) і метод молекулярних орбіталей (ММО).
Метод валентних зв’язків базується на припущенні про узагальнення пари електронів валентних рівнів двох реагуючих атомів. Якщо ковалентний зв’язок здійснюється перекриванням атомних орбіталей двох атомів за наявності на кожній з них по одному неспареному електрону з протилежними значеннями спінових квантових чисел, такий механізм утворення спільної електронної пари називають обмінним.
Утворення спільної електронної пари можливе також і за донорно-акцепторним механізмом: один з атомів (донор) має неподілену електронну пару, а інший атом (акцептор) - вакантну (вільну) орбіталь. Наприклад, в іоні BF4- три ковалентні зв’язки утворені за обмінним механізмом і лише один - за донорно-акцепторним, причому атом Бору - акцептор, а аніон Флуору - донор електронної пари.
 |
 +
+ 

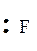


Слід зазначити, що під час утворення іона BF4- негативний заряд рівномірно розподіляється між усіма атомами.
До основних властивостей хімічного зв’язку належать довжина, енергія зв’язку та валентний кут.
РџС–Рґ довжиною зв’язку розуміють відстань РјС–Р¶ ядрами атомів, що утворюють хімічний зв’язок. Довжину хімічного зв’язку вимірюють Сѓ пікометрах (1 РїРј = 10-12 Рј) або РІ ангстремах (1Å = 10-10 Рј). Довжина зв’язку залежить, РїРѕ-перше, РІС–Рґ СЂРѕР·РјС–СЂС–РІ сполучених частинок − збільшується Р·С– зростанням СЂРѕР·РјС–СЂС–РІ реагуючих атомів, Р° РїРѕ-РґСЂСѓРіРµ, РІС–Рґ типу зв’язку та СЃРїРѕСЃРѕР±Сѓ С—С… сполучення атомів (наприклад, довжина кратного хімічного зв’язку менша Р·Р° довжину одинарного).
Енергія зв’язку – це мінімальна енергія, яку потрібно витратити на розрив хімічних зв’язків і отримання ізольованих атомів у 1 моль певної речовини. Енергію зв’язку вимірюють у кДж/моль; вона залежить від довжини зв’язку (зазвичай зменшується зі збільшенням відстані між ядрами взаємодіючих атомів) і від кратності зв’язку (у загальному випадку збільшується у міру зростання кратності зв’язку).
Кут між умовними прямими, які проходять через ядра хімічно зв’язаних атомів, називають кутом зв’язку, або валентним кутом .
Основні положення методу валентних зв’язків (В. Гайтлер, Ф. Лондон):
· Ковалентний зв’язок реалізується за рахунок утворення спільної електронної пари з двох електронів, що мають протилежно спрямовані спіни та належать двом атомам, які власне й утворюють хімічний зв’язок.
· Процес утворення зв’язку, як уже зазначалось, енергетично вигідний, тому під час утворення хімічного зв’язку енергія виділяється.
· Ковалентний зв’язок здійснюється перекриванням електронних хмар взаємодіючих атомів, тому він є тим міцнішим, чим більша площа перекривання електронних хмар, і утворюється в тому напрямку, де це перекривання буде максимальним.
До властивостей ковалентного зв’язку також відноситься його насиченість: кількість можливих для атома хімічних зв’язків обмежена кількістю неспарених валентних електронів та наявністю електронних пар або вільних атомних орбіталей на валентному рівні. Тому валентність також можна визначити за кількістю хімічних зв’язків, які може утворити атом.
Особливу увагу слід приділити таким властивостям ковалентного зв’язку як напрямленість, полярність і поляризованість зв’язку.
Напрямленість зв’язку визначається формою та взаємною орієнтацією електронних хмар у напрямку найбільшого перекривання атомних орбіталей, причому напрямок зміщення спільної електронної пари можна визначити за величинами електронегативностей (додаток 1) або оцінити за положенням елементів у періодичній системі.
Залежно від різниці у значеннях електронегативностей елементів DЕН ковалентний зв’язок може бути полярним чи неполярним. Зокрема, у двохатомній молекулі простої сполуки (Н2, N2, O2, Cl2 та ін.) спільні електронні пари зв’язку розміщені симетрично відносно ядер взаємодіючих атомів. Такий зв’язок називають ковалентним неполярним. Якщо ж сполучаються атоми, що мають різні електронегативності, спільні електронні пари зв’язків зміщуються у бік ядра більш електронегативного атома. Такий зв’язок належить до ковалентного полярного. Утворюючи цей зв’язок, більш електронегативний атом одержує надлишок негативного заряду, а на менш електронегативному атомі виникає деякий позитивний заряд.
Під дією зовнішнього електричного поля спільна електронна пара зміщується у бік одного з атомів, унаслідок чого відбувається зростання полярності хімічного зв’язку, тобто зв’язок поляризується.
Поляризованість хімічного зв’язку - це здатність зв’язку збільшувати полярність (або набувати її) під дією зовнішніх електромагнітних впливів. Поляризованість зв’язку залежить від напруженості електромагнітного поля та від здатності електронних оболонок атомів, що утворюють зв’язок, деформуватись під дією зовнішнього електромагнітного впливу (тобто поляризуватись). Здатність атомів до поляризації зазвичай зростає в міру збільшення їхніх розмірів та зменшення величин електронегативностей.
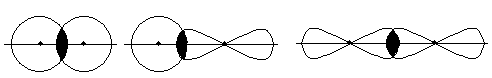 Слід пам’ятати, що спочатку електронні хмари взаємодіючих атомів перекриваються таким чином, щоб область перекривання атомних орбіталей знаходилась на уявній лінії, що з’єднує ядра цих атомів (лінія зв’язку). Такий тип перекривання атомних орбіталей називають s-зв’язком, наприклад, якщо
Слід пам’ятати, що спочатку електронні хмари взаємодіючих атомів перекриваються таким чином, щоб область перекривання атомних орбіталей знаходилась на уявній лінії, що з’єднує ядра цих атомів (лінія зв’язку). Такий тип перекривання атомних орбіталей називають s-зв’язком, наприклад, якщо
s - s − Рђ.Рћ. s - p − Рђ.Рћ. p - p − Рђ.Рћ.
Причому, залежно від кількості одноелектронних орбіталей атом може утворювати декілька s-зв’язків.
Якщо область перекривання атомних орбіталей знаходиться по обидва боки від лінії зв’язку, такий зв’язок називають p-зв’язком, наприклад, якщо
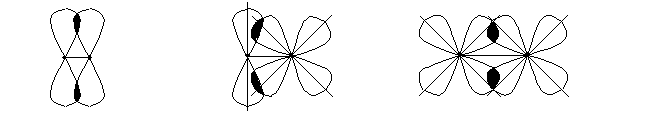 СЂ - p − Рђ.Рћ. p - d − Рђ.Рћ. d - d − Рђ.Рћ.
СЂ - p − Рђ.Рћ. p - d − Рђ.Рћ. d - d − Рђ.Рћ.
p-Зв’язок менш міцний, ніж s-зв’язок, і виникає лише після утворення
s-зв’язку, який реалізується першочергово. Наприклад, у молекулі О2 (8О … 2s22p4) між атомами два зв’язки О=О, оскільки на валентних орбіталях Оксигену знаходяться два неспарені електрони.
Треба пам’ятати, що між двома атомами може утворитися тільки один s-зв’язок, тому в молекулі О2 реалізуються один s-, а другий p-зв’язок (тобто утворюється подвійний зв’язок). Між атомами Нітрогену (7N … 2s22p3) в молекулі N2 можуть утворитися три зв’язки, один з яких s-, а два інші p-зв’язки (тобто реалізується потрійний зв’язок).
Отже, кратність зв’язку визначається кількістю спільних електронних пар між двома взаємодіючими атомами. Як зазначалось раніше, кратні зв’язки можуть бути подвійними або потрійними.
Будова молекул
При поглинанні атомом додаткової (надлишкової) енергії можливий перехід атома у збуджений стан. Тоді у разі збудження один зі спарених електронів атома переходить на підрівень з вищою енергією. Цей перехід тим легший, чим далі від ядра знаходиться валентний електрон. Оскільки збуджений стан атома нестійкий, електрон не може довго перебувати у такому стані; зворотний перехід електрона супроводжується виділенням енергії.
Для переходу атома у збуджений стан потрібна додаткова енергія, але при утворенні хімічного зв’язку енергія виділяється, тому при збудженні атома енергетично вигідним є перехід електронів на підрівні з більш високою енергією в межах одного рівня. Наприклад, атом Магнію в нормальному стані не має неспарених
|
12Рњg 1s22s22p63s2 B = 0,
тобто його валентність у нормальному стані дорівнює нулю. Однак у сполуці MgBr2 валентність Магнію дорівнює двом. Отже, можна припустити, що в молекулі MgBr2 Магній знаходиться у збудженому стані:
 Mg* … 3s13p1 B = 2.
Mg* … 3s13p1 B = 2.
Оскільки обидва зв’язки Мg-Br у молекулі вірогідно рівноцінні, припустимо, що s- i p-орбіталі Магнію під час утворення зв’язку змінюють свої форми та енергії, тобто гібридизуються.
 Гібридизація - це «перетворення», або «змішування» вихідних атомних орбіталей, які відрізняються формою та енергією, унаслідок чого утворюється така сама кількість однакових за формою та енергією атомних орбіталей.
Гібридизація - це «перетворення», або «змішування» вихідних атомних орбіталей, які відрізняються формою та енергією, унаслідок чого утворюється така сама кількість однакових за формою та енергією атомних орбіталей.
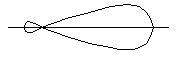
Гібридизація атомних орбіталей, вірогідно, здійснюється в момент утворення хімічного зв’язку. Гібридна орбіталь має форму витягнутої гантелі:
Незважаючи на витрати енергії на гібридизацію атомних орбіталей, одержується виграш в енергії внаслідок утворення міцнішого зв’язку та симетричнішого розподілу електронної густини в молекулі.
Сиджвік і Пауелл (1940 р.) уперше припустили, що геометрична конфігурація молекули залежить від розміщення електронних пар на валентних рівнях взаємодіючих атомів. Пізніше було розвинуто теорію відштовхування валентних електронних пар: електронні пари розміщуються на валентному рівні атома таким чином, щоб бути максимально віддаленими одна від одної (наче вони взаємно відштовхуються). Тому тип гібридизації атомних орбіталей центрального атома та їх просторове розміщення зазвичай визначають геометричну форму (конфігурацію) всієї молекули.
Взаємне розташування кількох гібридизованих орбіталей у просторі відносно атомного ядра залежить від їх кількості та відповідає мінімальній енергії всієї молекули. У свою чергу, тип гібридизації А.О. залежить від кількості та типу вихідних атомних орбіталей:
· Під час змішування однієї s- і однієї р-атомної орбіталі відбувається sp-гібридизація (q2): утворюються дві гібридні орбіталі, розміщені під валентним кутом 180°.
· Під час змішування однієї s- і двох p-атомних орбіталей відбувається sp2-гібридизація (q3), при цьому утворюються три гібридні орбіталі, розміщені під
· кутом 120°.
· Під час змішування однієї s- і трьох p-атомних орбіталей відбувається sp3-гібриди-зація (q4), в результаті чого утворюються чотири гібридні орбіталі, спрямовані до вершин тетраедра. Кут між ними становить 109,5о.


sp-гібридизація А.О. sp2-гібридизація А.О. sp3-гібридизація А.О.
7.1. Типи гібридизації атомних орбіталей.
Згідно з експериментальними даними, молекули найчастіше мають неідеальні геометричні форми. Зокрема, у молекулі амоніаку NH3 валентний кут H-N-H становить 107°, а в молекулі води кут H-O-H дорівнює 104,5°. Причини цих відхилень буде детально розглянуто в Розділі 8.
Молекули речовин можуть бути полярними (диполями) або неполярними. Полярність молекул зумовлена характером розподілу в них електронної густини. В разі симетричного (рівномірного) розподілу електронної густини відносно ядер взаємодіючих атомів утворюються неполярні молекули. У таких молекулах центри позитивних і негативних зарядів збігаються.
Якщо електронна густина в молекулі розподілена несиметрично (нерівно-мірно), то на більш електронегативних атомах зосереджено надлишковий негативний заряд d-, а на менш електронегативних – позитивний d+. У такому випадку електричні центри позитивного і негативного зарядів не збігаються, а розміщені на певній відстані один від одного; тобто утворюється полярна
молекула (диполь) з протилежно зарядженими полюсами.
Схематично диполі зображують так:

де l – довжина диполя (відстань між центрами позитивних і негативних зарядів у полярній молекулі).
Полярність двохатомної молекули визначають за допомогою дипольного моменту 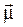 (електричного моменту диполя) єдиного зв’язку, що реалізований в молекулі:
(електричного моменту диполя) єдиного зв’язку, що реалізований в молекулі:
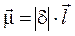 ,
,
РґРµ d - ефективний заряд РЅР° атомі; 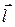 - вектор довжини диполя, СЏРєРёР№ враховує напрям дипольного моменту. Дипольний момент вимірюють Сѓ Кулон-метрах або РІ Дебаях (1D = 3,33 × 10-30 РљР»×Рј).
- вектор довжини диполя, СЏРєРёР№ враховує напрям дипольного моменту. Дипольний момент вимірюють Сѓ Кулон-метрах або РІ Дебаях (1D = 3,33 × 10-30 РљР»×Рј).
Для молекул, що складаються з кількох атомів, сумарний дипольний момент визначають як векторну суму дипольних моментів окремих хімічних зв’язків у молекулі. Причому, напрям дипольного моменту умовно позначають від позитивного заряду до негативного. Наявність або відсутність дипольного моменту в молекулі допомагає передбачити геометричну форму молекули. Наприклад, експериментально було визначено, що молекула СО2 неполярна, а молекула SO2 - полярна.Тому можна припустити, що молекула карбону (IV) оксиду, хоча і має  два полярні зв’язки між атомами Оксигену і Карбону, є неполярною внаслідок лінійноїтасиметричноїбудови:
два полярні зв’язки між атомами Оксигену і Карбону, є неполярною внаслідок лінійноїтасиметричноїбудови:
Рћ = РЎ = Рћ 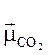 = 0.
= 0.
Для сульфур (IV) РѕРєСЃРёРґСѓ 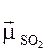 ¹ 0, оскільки Р№РѕРіРѕ молекула має кутову
¹ 0, оскільки Р№РѕРіРѕ молекула має кутову
Р±СѓРґРѕРІСѓ (валентний РєСѓС‚ O − S − O становить 119º).
У ряді однотипних кутових молекул, наприклад Н2О, H2S, H2Se, Н2Те, значення дипольних моментів зазвичай зменшуються зі зменшенням різниці електронегативностей елементів (DЕН).
Багато властивостей речовин (наприклад, розчинність, здатність дисоцію-вати в полярних розчинниках тощо) залежать як від полярності окремих зв’язків у молекулі, так і від полярності всієї молекули.
Последнее изменение этой страницы: 2016-08-11
lectmania.ru. Все права принадлежат авторам данных материалов. В случае нарушения авторского права напишите нам сюда...